plastyczność mięśni
mięsień szkieletowy jest największą tkanką w organizmie. Jest wysoce plastyczny i może ulegać dramatycznym, nie patologicznym wahaniom zarówno masy, jak i siły w odpowiedzi na niezliczone wpływy środowiska. Po wysiłku oporowym lub ekspozycji na sterydy anaboliczne mięśnie przechodzą przerost i zwiększają swoją masę, przekrój i siłę (AAGAARD, 2004; Schiaffino et al., 2013). Te same parametry mogą gwałtownie spadać, gdy mięśnie inicjują atrofię w odpowiedzi na którykolwiek z zakresu obelg, które obejmują: głód, odmowę, unieruchomienie, posocznicę, wyniszczenie raka, niewydolność serca, cukrzycę, niewydolność nerek, przewlekłą obturacyjną chorobę płuc i zespół nabytego niedoboru odporności (Schiaffino et al., 2013).
konsekwencje zaniku mają oczywiste konsekwencje dla zdrowia. Osłabienie mięśni jest głównym czynnikiem zarówno śmiertelności, jak i zachorowalności i wiąże się ze zwiększonym ryzykiem wszystkich przyczyn śmierci (Metter et al., 2002). W rzeczywistości zmniejszenie zaniku mięśni w wyniszczeniu raka może znacznie przedłużyć życie (Zhou et al., 2010). Ponadto wiele starszych osób cierpi na sarkopenię, przedłużające się zaburzenie wyniszczania mięśni, które zwykle zaczyna się po 50 roku życia i wiąże się z utratą około 1% masy mięśniowej rocznie (Woo, 2017). Oznacza to, że w wieku 80 lat Osoby sarkopeniczne straciły około 40% masy mięśniowej, co jest kluczowym czynnikiem w upadkach, słabości i przyjęciach do domów opieki. W związku z tym zrozumienie mechanizmów i potencjalnych reakcji terapeutycznych na zanik ma szerokie podstawowe i kliniczne znaczenie (Ali and Garcia, 2014; Cohen et al., 2015; Ziaaldini et al., 2017).
hipoteza domeny Miojądrowej
mięsień szkieletowy jest dość wyjątkowy, ponieważ dojrzałe komórki są syncytialne i mogą zawierać setki jąder. Jest to niezbędna adaptacja, biorąc pod uwagę, że poszczególne włókna mięśniowe mogą być ogromne, osiągając długość do ~600 mm (23 cale) (np., 1998) i objętości, które mogą być ponad 100 000 razy większe niż typowa komórka mononukleinowa (Bruusgaard et al., 2003). Wkład wielu jąder jest wymagany do wytworzenia dużych ilości mRNA potrzebnych do kierowania niesamowitą syntezę białek wymaganą do wytworzenia i utrzymania aparatu kurczliwego (Nevalainen et al., 2013).
zarówno plastyczny charakter mięśni, jak i jego syncytialna organizacja doprowadziły do kontrowersji, które dopiero niedawno zostały rozwiązane—”hipoteza domeny myonuclear” (Qaisar and Larsson, 2014; Gundersen, 2016; Schwartz et al., 2016). Teoria ta ma swoje źródło w koncepcji „Wirkungssphäre” lub „sfera wpływu” zaproponowanej przez Strassburgera (1893), w której twierdził, że jądro może wspierać tylko dyskretną objętość cytoplazmy, określając w ten sposób górne granice wielkości komórki. Zasada ta została rozwinięta przez Gregory ’ ego (2001), który twierdził, że zawartość i objętość kwasu deoksyrybonukleinowego komórkowego są ściśle sprzężone. Syncytialny charakter mięśni szkieletowych pomaga tym komórkom przezwyciężyć to ograniczenie. Hipoteza domeny miojądrowej głosi, że w celu utrzymania właściwego stosunku jąder do cytoplazmy, nowe jądra są dodawane podczas przerostu i tracone wraz z atrofią.
istnieją znaczne dane wykazujące, że liczba atomowa wzrasta wraz z przerostem mięśni (Moss, 1968; Cabric and James, 1983; Egner et al., 2016), choć pewne kontrowersje pozostają (Murach et al., 2018). Proces ten był obszarem intensywnych badań i niektóre z podstawowych mechanizmów molekularnych, które regulują akwizycję nowych jąder podczas przerostu zostały zdefiniowane niedawno (Guerci et al., 2012; Bentzinger et al., 2014; Ross et al., 2018). Te nadliczbowe jądra są nabywane, gdy komórki macierzyste o ograniczonej linii, zazwyczaj komórki satelitarne, łączą się z włóknami mięśniowymi i przyczyniają się do ich jąder (Brack and Rando, 2012; Bachman et al., 2018). Komórki satelitarne znajdują się pod błoną Piwniczną i przylegają do sarcolemmy (Katz, 1961; Mauro, 1961). Pozostają one w stanie spoczynku, dopóki nie zostaną stymulowane przez sterydy anaboliczne, takie jak testosteron, lub przez ogniskowe uszkodzenie po wysiłku oporowym, w którym to momencie ponownie wchodzą w cykl komórkowy i proliferują (Joubert and Tobin, 1995; Abreu et al., 2017). Niektóre komórki potomne łączą się z włóknem mięśniowym i ułatwiają zarówno naprawę, jak i wzrost, podczas gdy inne zatrzymują i odtwarzają pulę satelitarną(Dumont et al., 2015; Goh i Millay, 2017). Pozostałe nadwyżki komórek ulegają apoptozie (Schwartz, 2008).
kontrowersyjnym aspektem hipotezy domeny mionuklearnej jest twierdzenie, że mionukleie giną podczas atrofii. Istnieje wiele interwencji, które wywołują atrofię w modelach zwierzęcych, w tym: unieruchomienie, denerwacja i sepsa(Fitts et al., 1986; Minnaard et al., 2005; O ’ Leary et al., 2012). W każdym przypadku występuje utrata netto zarówno obszaru przekroju mięśnia (podstawowy test), jak i pojawienia się komórek apoptotycznych w tkance(McCall i wsp ., 1998; Smith et al., 2000; Strasser et al., 2000; Alway et al., 2003; McClung et al., 2007; Andrianjafiniony et al., 2010; Guo et al., 2012; Palumbo et al., 2012; Barnes et al., 2015; Cheema et al., 2015; Li et al., 2016; Kletzien et al., 2018). W tych badaniach apoptozę mierzy się za pomocą różnych metod, w tym aktywacji kaspazy, uwalniania mitochondrialnego Endogenu lub fragmentacji DNA . Badania te dostarczają przekonujących danych, że apoptoza gwałtownie wzrasta we wczesnej fazie atrofii. Na przykład, w niedawnym kompleksowym badaniu (Guo et al., 2012), Guo et al. poddano myszy 14-dniowej zawiesinie tylnej, leczeniu, które spowodowało ~ 69% zmniejszenie mokrej masy mięśniowej i ~ 43,8% zmniejszenie obszaru przekroju poprzecznego w stosunku do unmanipulated contralateral muscle. Autorzy określili również szereg markerów apoptozy, w tym barwienie tunelem, rozszczepianie/aktywacja kaspazy-3 i rozszczepianie polimerazy Poli(rybozy-adenozynodifosforanu) (PARP), białka biorącego udział w naprawie DNA. Każdy z tych środków apoptozy znacznie się zwiększył po zawieszeniu kończyn tylnych. Podczas gdy głównym celem tego artykułu była ocena pozytywnego wpływu stymulacji elektrycznej na ograniczenie atrofii po zniewadze, oni i wielu innych badaczy interpretują tego rodzaju dane jako zapewniające silne wsparcie dla hipotezy domeny nuklearnej.
z biologicznego punktu widzenia komórki, przypuszczalna utrata jąder w tkance syncytialnej, takiej jak mięśnie szkieletowe, stanowi poważny problem praktyczny. Jak pojedyncze jądro może stać się tak zagrożone, że jego genom szybko skrapla się i fragmentuje, podczas gdy jego sąsiedzi utrzymują się i pomagają utrzymać żywotność włókna mięśniowego? Biorąc pod uwagę, że apoptoza jest zwykle pośredniczona przez aktywację klasy proteaz cysteinowych znanych jako kaspazy, nie jest jasne, jaki mechanizm może służyć do ograniczenia aktywności dyfuzyjnej proteazy w obrębie wspólnej cytoplazmy.
to pytanie zostało poruszone pośrednio w innym typie komórek syncytialnych, ludzkiej syncytiotrophoblast, tkance otaczającej łożysko i zawierającej około 5 × 1010 jąder (Mayhew et al., 1999). Gdy apoptoza jest indukowana w syncytiotrophoblast, propaguje się jako fala z szybkością około 5 mikronów na minutę, aż cała tkanka jest zaangażowana(Longtine et al., 2012). W rezultacie nie ma „uprzywilejowanych” regionów w cytoplazmie syncytialnej, a wszystkie jądra zostają ostatecznie zniszczone.
jednym z kluczowych wyzwań związanych z analizą apoptozy w mięśniach szkieletowych jest to, że jest to bardzo niejednorodna tkanka, w której około połowa jej jąder znajduje się poza włóknami mięśniowymi (Schmalbruch i Hellhammer, 1977). Te komórki mononukleinowe obejmują komórki satelitarne, komórki śródbłonka, fibroblasty, perycyty i makrofagi(Tedesco et al., 2010). W związku z tym bardzo trudno jest określić, po której stronie sarkolemmy znajduje się jądro, a więc czy jest to prawdziwy mionukleus.
obrazowanie poklatkowe In Vivo znakowanych włókien mięśniowych myszy
pomimo dużej liczby prac wykazujących apoptozę podczas zaniku mięśni, kilku autorów zakwestionowało te wyniki (Wada et al., 2002; Zhong et al., 2005; Aravamudan et al., 2006; Gundersen and Bruusgaard, 2008; Duddy et al., 2011; Qaisar and Larsson, 2014). Na przykład, przy użyciu izolowanych włókien mięśniowych in vitro, Duddy et al. zauważono, że podczas gdy objętość włókien mięśniowych zmniejszała się z czasem, odzwierciedlając proces zanikowy, liczba mionuklei wydawała się stabilna (Duddy et al., 2011).
w serii eleganckich eksperymentów laboratorium Gundersena wstrzyknęło pojedyncze włókna mięśniowe extensor digitorum longus (EDL) lub soleus z barwnikami, które niezależnie oznaczały jądra i cytoplazmę u znieczulonych myszy (Bruusgaard and Gundersen, 2008; Bruusgaard et al., 2010). Pozwoliło im to zidentyfikować każde jądro w obrębie poszczególnych włókien mięśniowych in vivo w czasie, a następnie ocenić jego los. Na przykład, mięśnie EDL były indukowane do przerostu przez ablację ich głównych synergetyków (Bruusgaard et al., 2010). Między 6. A 11. dniem liczba mionuklei wzrosła o około 54%, a między 9. a 14. dniem nastąpił wzrost o 35% w obszarze przekroju poprzecznego (ryc. 1). Dane te są zgodne z hipotezą, że mięśnie nabywają jądra nadliczbowe przed głównym wzrostem włókna podczas przerostu.

Rysunek 1. Mionukleie są nabywane podczas przerostu, ale nie tracone podczas atrofii u myszy. Mikrografy tego samego włókna mięśniowego EDL w czasie po indukcji przerostu (Górny rząd) i późniejszej indukcji atrofii (dolny rząd). Fluorescencyjnie znakowane oligonukleotydy zostały użyte do wizualizacji jąder in vivo. Kropkowane linie reprezentują sarcolemmę. Skala bar = 50 µm. (Zaadaptowane z Bruusgaard et al., 2010. Używany za zgodą Proceedings of the National Academy of Sciences.)
następnie zbadali los tych jednoznacznie identyfikowalnych jąder mionukleinowych w tych samych włóknach mięśniowych, gdy zostały one wywołane atrofią. Denerwacja doprowadziła do około 50% zmniejszenia objętości włókien mięśniowych, ale bez utraty mionuklei (rycina 1; Bruusgaard i in., 2010). Brak zaobserwowania utraty jądrowej nie był spowodowany zastosowanym bodźcem zanikowym, ponieważ uzyskano te same wyniki, gdy mięśnie były indukowane do atrofii w odpowiedzi na blokadę nerwów wywołaną tetrodotoksyną, zawieszenie tylnego wycięcia, wyniszczenie raka lub oderwanie (Bruusgaard and Gundersen, 2008; Bruusgaard et al., 2010; Winje et al., 2018a). W rzeczywistości w trakcie swoich badań zbadali ponad 200 000 pojedynczych mionuklei w mięśniach zanikowych i zaobserwowali tylko 4 jądra TUNELOWO-dodatnie (apoptotyczne), co stanowi utratę tylko ~0,002% jąder (Bruusgaard et al., 2012). Dane te mocno wspierają hipotezę, że atrofii mięśni szkieletowych nie towarzyszy śmierć miojądrowa.
mięśnie owadów jako Model
chociaż badania te są potężne, istnieją pewne ograniczenia związane z wykorzystaniem modeli ssaków. Po pierwsze, niezmiennie opierają się na eksperymentalnych interwencjach, takich jak denerwacja, aby wywołać zanik mięśni. Po drugie, mięsień kontralateralny jest zwykle używany jako kontrola wewnętrzna, mimo że jest również narażony na niektóre z tych samych sygnałów środowiskowych, takich jak hormony stresu (Bonaldo and Sandri, 2013). Wreszcie, mięśnie szkieletowe mogą również ulegać programowanej śmierci komórkowej (PCD) podczas rozwoju, a modele te rzadko zajmują się rolą apoptozy w tych komórkach.
alternatywnym modelem, który nie cierpi na żadne z tych ograniczeń i pozwala na badanie jąder mięśniowych zarówno podczas atrofii, jak i naturalnie występującego PCD, jest mięsień międzysegmentalny (ISM) z tytoniu hawkmoth Manduca sexta. Izmy składają się z arkuszy olbrzymich włókien mięśniowych, gdzie każda komórka ma około 5 mm długości i do 1 mm średnicy (ryc. 2A). ISM przyczepiają się do granic segmentalnych w obrębie brzucha i generują zarówno pełzające zachowanie larw, jak i eklozję (pojawienie) zachowania dorosłej ćmy, gdy ucieka z naskórka źrenicy pod koniec metamorfozy.
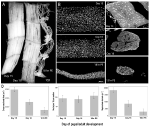
Rysunek 2. Zatrzymanie mionuklei zarówno podczas atrofii, jak i śmierci mięśni międzysegmentalnych (ISMs) od ćmy Manduca sexta. A) izmy z trzech stadiów rozwoju: homeostatyczne (dzień 15 rozwoju poczwarkowo-dorosłego; lewy); zanikowe (dzień 18; środkowy); i umieranie (18 h po eklozji; po prawej). Pasek skali wynosi ~1 mm (zaadaptowany z Schwartz et al., 2016). (B) ISM z tych samych etapów rozwoju zostały oczyszczone i barwione barwnikiem jądrowym dapi i wizualizowane za pomocą mikroskopii konfokalnej (zaadaptowane z Schwartz et al., 2016). (C) sekcje włókien ISM (10 µm) zostały zabarwione atomowym barwnikiem DAPI. Zwróć uwagę na dramatyczną utratę białka mięśniowego (jasnoszara Strefa) podczas atrofii i śmierci, ale zatrzymanie jąder na wszystkich etapach (zaadaptowane z Schwartz et al., 2016). (D) kwantyfikacja objętości włókien ISM (po lewej), liczby jądrowej (w środku) i wielkości domeny miojądrowej (po prawej) podczas homeostazy, atrofii i śmierci. (Błąd średni ± standardowy.) (Zaadaptowane z Schwartz et al., 2016).
w dniu 15 normalnego 18-dniowego rozwoju źrenic i dorosłych, ISMs inicjuje hormonalnie uruchamiany program atrofii, który powoduje 40% utratę masy do czasu eklozji 3 dni później (rysunek 2A; Schwartz i Truman, 1983). Ta dramatyczna utrata masy mięśniowej jest równoważna z obserwowaną u 80-letnich osób z sarkopenią, ale ma miejsce w ciągu 3 dni, a nie 30 lat. Podczas gdy ISM tracą masę, zachowują normalne właściwości fizjologiczne, takie jak potencjał spoczynkowy i siła/pole przekroju (Schwartz and Ruff, 2002). ISM są używane do generowania zachowania eklozyjnego pod koniec dnia 18, a następnie inicjowania PCD, które są wyzwalane przez hormon peptydowy (Schwartz i Truman, 1982, 1983). .
w przeciwieństwie do mięśni ssaków, ISM nie zawierają naczyń włosowatych, komórek satelitarnych, komórek śródbłonka ani perycytów, co oznacza, że praktycznie wszystkie jądra w tkance znajdują się w samych włóknach mięśniowych (Beaulaton and Lockshin, 1977). Użyliśmy dwóch niezależnych metod monitorowania losu jądrowego podczas atrofii i śmierci w tym modelu (Schwartz et al., 2016). Pierwszym z nich było standardowe podejście anatomiczne. Kiedy ISM ulegają atrofii i śmierci, następuje dramatyczne zmniejszenie zarówno objętości, jak i powierzchni przekroju włókien, ale rażąco, liczba jądrowa nie uległa zmianie (ryc. 2b). Używając tkanek podzielonych na sekcje do badań ilościowych, odkryliśmy, że nastąpiło ~49% zmniejszenie powierzchni przekroju włókien podczas atrofii i dalsze 30% spadek we wczesnych stadiach śmierci (Fig., 2016). Jednak liczba jąder nie zmieniła się w tym samym okresie, co oznacza, że nastąpiła funkcjonalna redukcja domeny miojądrowej o 84%.
drugą metodą, którą zastosowaliśmy, był pomiar zawartości DNA poszczególnych włókien mięśniowych zwierząt w dniu 13, kiedy mięśnie są homeostatyczne, do 18 h po eklozji, kiedy mięśnie są silnie zdegenerowane (Schwartz et al., 2016). Oceniliśmy ilościowo zawartość DNA 420 pojedynczych komórek i stwierdziliśmy, że nie było znaczącej utraty podczas rozwoju. Te analizy biochemiczne zgadzają się z danymi anatomicznymi i sugerują, że względne stężenie zarówno jąder, jak i genomowego DNA funkcjonalnie wzrosło, gdy mięśnie zanikły i umarły. W konsekwencji, dane zarówno od myszy jak i Ćmy sugerują, że jądra mięśniowe nie ulegają apoptozie podczas atrofii (lub PCD) i prowadzą do wniosku, że hipoteza domeny miojądrowej powinna zostać odrzucona.
wnioski
te obserwacje mają szereg implikacji zarówno dla zrozumienia podstawowej biologii mięśni, jak i dla rozwoju potencjalnych interwencji terapeutycznych. Chociaż istnieją istotne dane informujące o obecności jąder apoptotycznych w tkance po zaniku, Najnowsze dane sugerują, że nie są to prawdziwe mionukleie, ale raczej skazane komórki jednojądrzaste, które znajdują się poza włóknem mięśniowym. Podstawową przyczyną tej rozbieżności jest to, że tradycyjne narzędzia stosowane do wykrywania apoptozy nie mają rozdzielczości wymaganej do odpowiedniego określenia, po której stronie sarcolemmy znajduje się umierająca komórka. Metody, które konkretnie oznaczają mionukleie, albo za pomocą in vivo iniekcji fluorescencyjnych barwników (Bruusgaard and Gundersen, 2008) lub za pomocą manipulacji genetycznych w celu ekspresji białek markerowych (Duddy et al., 2011), ujawniają kilka, jeśli w ogóle, apoptotycznych jąder w oznaczonych włóknach. Niedawna demonstracja, że przeciwciała skierowane przeciwko Białkowemu materiałowi Perycentriolarnemu 1 (PCM1) etykietują tylko autentyczne mionukleie, oferuje obiecujące narzędzie, które można zastosować do tradycyjnych materiałów histologicznych, które są rutynowo analizowane w terenie (Winje et al.,2018b).
nie dziwi fakt, że mięśnie szkieletowe nie wykorzystują apoptozy jako mechanizmu eliminacji mionuklei. Wydaje się, że Dojrzałe mięśnie szkieletowe są w dużej mierze wykluczone z inicjowania apoptozy, ponieważ reguluje ekspresję silnych białek przetrwania, takich jak X-linked inhibitor białka apoptozy (XIAP) (Smith et al., 2009) i represor apoptozy z domeną rekrutacyjną kaspazy (ARC) (Xiao et al., 2011), jednocześnie wyrażając niskie poziomy mediatorów apoptozy, takich jak czynnik aktywujący proteazę apoptotyczną 1 (Apaf-1) (Burgess et al., 1999). Ma to sens teleologicznie, ponieważ mięśnie są narażone na ekstremalne zaburzenia, w tym zakłócenia sarcolemma po intensywnym wysiłku, więc byłoby katastrofalne, gdyby wywołały śmierć komórek, a nie zainicjowały naprawę tkanek i ewentualnie przerost. Podobnie jak inne terminalnie zróżnicowane komórki, mięśnie mają tendencję do wykorzystywania mechanizmów nieapoptotycznych, w szczególności autofagicznego PCD (znanego również jako degeneracja typu II) (Clarke, 1990; Schwartz et al., 1993; Kole et al., 2013; Ginet et al., 2014), kiedy umierają podczas rozwoju.
nawet jeśli istniał mechanizm, za pomocą którego mięśnie mogły selektywnie celować w poszczególne jądra, nie jest jasne, czy byłoby to korzystne. W rzeczywistości zatrzymanie” nadwyżek ” jąder podczas atrofii daje wyraźną korzyść dla jednostki, ponieważ mięśnie szkieletowe często przechodzą cykle atrofii i przerostu w odpowiedzi na warunki środowiskowe, takie jak dostępność pokarmu. Zdolność do szybkiego powrotu do zdrowia poprzez wykorzystanie wcześniej istniejących jąder mionukleinowych może pełnić ważną rolę w adaptacji (Jackson et al., 2012) i pomagają wyjaśnić zjawisko „pamięci mięśniowej” (Staron et al., 1991; Gundersen, 2016). Jest dobrze udokumentowane w dziedzinie fizjologii ćwiczeń, że o wiele łatwiej jest odzyskać pewien poziom sprawności mięśni poprzez ćwiczenia, niż osiągnąć go na pierwszym miejscu, nawet jeśli nastąpił długi interweniujący okres odkształcenia. Innymi słowy, wyrażenie „Użyj lub strać” może być dokładniej sformułowane jako ” Użyj lub strać, dopóki nie zaczniesz nad tym pracować.”Zostało to udowodnione bezpośrednio przez inny eksperyment z laboratorium Gundersena, który wykazał, że gdy mięsień nabył nowe jądra, zachowuje je długo po usunięciu bodziec przerostowy. Wywołali przerost mięśni u samic myszy, traktując je przez 2 tygodnie testosteronem, a następnie zbadali mięśnie 3 tygodnie po odstawieniu sterydów(Egner et al., 2013). Objętość mięśni powróciła do wartości wyjściowej, ale nowo nabyte jądra utrzymywały się nawet 3 miesiące później. Gdy mięśnie zostały poddane przeciążeniu w celu ponownego przerostu, te poddane sterydom szybko przeszły wzrost objętości włókien o 36%, podczas gdy mięśnie kontrolne wzrosły tylko o 6%. Dane te sugerują, że” nadmiar ” jąder może być zmobilizowany szybko, aby ułatwić przekwalifikowanie.
uwagi te mają potencjalne implikacje dla polityki zdrowia publicznego. Wykazano, że wzrost mięśni, funkcja fizjologiczna i zdolność regeneracyjna zmniejszają się wraz z wiekiem, w dużej mierze ze względu na zmniejszoną proliferację komórek satelitarnych (Blau et al., 2015). W związku z tym ćwiczenia w okresie dojrzewania, gdy wzrost mięśni jest wzmocniony przez hormony, odżywianie i solidną pulę satelitarną, mogą służyć funkcjonalnie do umożliwienia osobom „banku” jąder mionukleinowych, które można wykorzystać w późniejszym życiu, aby spowolnić skutki starzenia się i prawdopodobnie zapobiec sarkopenii.
ponadto dane te mają wpływ na obszar sportów wyczynowych. Stosowanie sterydów anabolicznych jest silnym bodźcem do przerostu mięśni i dodania nowych jąder (Egner et al., 2013). Ponieważ jądra te utrzymują się długo po zakończeniu stosowania sterydów, sportowcy prawdopodobnie czerpać korzyści z nielegalnego używania narkotyków bez ryzyka wykrycia.
podsumowując, podczas gdy dodawanie nowych jąder ze wzrostem mięśni jest w dużej mierze akceptowane, apoptotyczna utrata jąder z atrofią nie może być wspierana, co sugeruje, że ścisła interpretacja hipotezy domeny miojądrowej nie może być wspierana. Zamiast tego wydaje się, że po nabyciu mionukleia utrzymują się nawet wtedy, gdy mięsień zanika lub inicjuje śmierć komórki.
wkład autora
autor potwierdza, że jest jedynym współautorem tej pracy i zatwierdził ją do publikacji.
finansowanie
prace nad tą publikacją były wspierane przez fundusze z Fundacji Eugene M. i Ronnie Isenberg Professorship. Autorowi nie udzielono wsparcia korporacyjnego i nie wymieniono ani nie zatwierdzono żadnych produktów komercyjnych.
Oświadczenie o konflikcie interesów
autor oświadcza, że badanie zostało przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
podziękowania
autor chciałby podziękować Pani Christine Brown za pomoc w przygotowaniu tego manuskryptu i Eugene M. i Ronnie Isenberg Professorship Endowment za wsparcie.
Aagaard, P. (2004). Wzmocnienie mięśni: ćwiczenia, odżywianie, leki. J. Musculoszkielet. Neuronal. Interakcja. 4, 165–174.
PubMed Abstract/Google Scholar
Abreu, P., Mendes, S. V., Ceccatto, V. M., and Hirabara, S. M. (2017). Aktywacja komórek satelitarnych indukowana przez adaptację mięśni tlenowych w odpowiedzi na ćwiczenia wytrzymałościowe u ludzi i gryzoni. Life Sci. 170, 33–40. doi: 10.1016 / j.lfs.2016.11.016
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Ali, S., and Garcia, J. M. (2014). Sarkopenia, wyniszczenie i starzenie się: diagnoza, mechanizmy i możliwości terapeutyczne-mini-przegląd. Gerontologia 60, 294-305 doi: 10.1159/000356760
PubMed Streszczenie | CrossRef Pełny tekst/Google Scholar
Alway, S. E., Martyn, J. K., Ouyang, J., Chaudhrai, A., and Murlasits, Z. S. (2003). Id2 expression during apoptosis and satellite cell activation in unloaded and loaded quail skeletal muscles. Am. J. Physiol. Regul. Integr. Comp. Physiol. 284, R540–R549. doi: 10.1152/ajpregu.00550.2002
PubMed Abstract | CrossRef Full Text | Google Scholar
Andrianjafiniony, T., Dupre-Aucouturier, S., Letexier, D., Couchoux, H., and Desplanches, D. (2010). Oxidative stress, apoptosis, and proteolysis in skeletal muscle repair after unloading. Am. J. Phys. Cell Physiol. 299, C307–C315. doi: 10.1152/ajpcell.00069.2010
PubMed Streszczenie | CrossRef Pełny tekst/Google Scholar
Aravamudan, B., Mantilla, C. B., Zhan, W. Z., and Sieck, G. C. (2006). Wpływ denerwacji na wielkość domeny miojądrowej włókien przepony szczura. J. Appl. Physiol. 100, 1617–1622. doi: 10.1152 / jappphysiol.01277.2005
CrossRef Pełny tekst | Google Scholar
Bachman, J. F., Klose, A., Liu, W., Paris, N. D., Blanc, R. S., Schmalz, M., et al. (2018). Wzrost mięśni szkieletowych w okresie przedpiersia wymaga ekspresji Pax 7-komórkowego wkładu miojądrzastego pochodzącego z komórek satelitarnych. / Align = „left” / 167197
Google Scholar
Barnes, B. T., Confides, A. L., Rich, M. M., and Dupont-Versteegden, E. E. (2015). Odrębne ścieżki apoptotyczne mięśni są aktywowane w mięśniach o różnych typach włókien w szczurzym modelu miopatii choroby krytycznej. J. Muscle Res. Cell Motil. 36, 243–253. doi: 10.1007 / s10974-015-9410-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Beaulaton, J., and Lockshin, R. A. (1977). Badanie ultrastrukturalne normalnego zwyrodnienia mięśni międzygatunkowych Anthereae polyphemus i Manduca sexta (insecta, lepidoptera) ze szczególnym uwzględnieniem autofagii komórkowej. J. Morphol. 154, 39–57. doi: 10.1002 / jmor.1051540104
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Bentzinger, C. F., von Maltzahn, J., Dumont, N. A., Stark, D. A., Wang, Y. X., Nhan, K., et al. (2014). Wnt 7A stymuluje ruchliwość i wszczepienie miogennych komórek macierzystych, powodując poprawę siły mięśni. J. Cell Biol. 205, 97–111. doi: 10.1083 / jcb.201310035
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Blau, H. M., Cosgrove, B. D., and Ho, A. T. (2015). Centralna rola komórek macierzystych mięśni w niewydolności regeneracyjnej ze starzeniem się. Nat. Med. 21, 854–862. doi: 10.1038 / nm.3918
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Bonaldo, P., and Sandri, M. (2013). Komórkowe i molekularne mechanizmy zaniku mięśni. Dis. Model. Mech. 6, 25–39. doi: 10.1242 / dmm.010389
CrossRef Pełny tekst | Google Scholar
Brack, A. S., and Rando, T. A. (2012). Komórki macierzyste specyficzne dla tkanek: lekcje z komórki satelitarnej mięśni szkieletowych. Cell Stem Cell 10, 504-514. doi: 10.1016 / j.stem.2012.04.001
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Bruusgaard, J. C., Egner, I. M., Larsen, T. K., Dupre-Aucouturier, S., Desplanches, D., and Gundersen, K. (2012). Brak zmian w liczbie mięśni podczas rozładunku i przeładowania mięśni. J. Appl. Physiol. 113, 290–296. doi: 10.1152 / jappphysiol.00436.2012
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Bruusgaard, J. C., and Gundersen, K. (2008). Mikroskopia poklatkowa in vivo nie ujawnia utraty mysich jąder mionukleinowych podczas tygodni zaniku mięśni. J. Clin. Inwestuj. 118, 1450–1457. Doi: 10.1172/JCI34022
PubMed Streszczenie | CrossRef Pełny tekst/Google Scholar
Bruusgaard, J. C., Johansen, I. B., Egner, I. M., Rana, Z. A., and Gundersen, K. (2010). Mionuclei nabyte przez przeciążenie ćwiczenia poprzedzają przerost i nie są tracone na detraining. Proc. Natl. Acad. Sci. U. S. A. 107, 15111-15116. doi: 10.1073 / pnas.0913935107
CrossRef Full Text | Google Scholar
Bruusgaard, J. C., Liestol, K., Ekmark, M., Kollstad, K., and Gundersen, K. (2003). Liczba i rozkład przestrzenny jąder we włóknach mięśniowych prawidłowych myszy badanych in vivo. J. Fizjol. 551, 467–478. doi: 10.1113 / jphysiol.2003.045328
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Burgess, D. H., Svensson, M., Dandrea, T., Gronlund, K., Hammarquist, F., Orrenius, S., et al. (1999). Cytozole ludzkich mięśni szkieletowych są oporne na zależną od cytochromu C aktywację kaspaz typu II i nie mają APAF-1. Śmierć Komórki Różni Się. 6, 256–261. doi: 10.1038 / sj.cdd.4400489
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Cabric, M., and James, N. T. (1983). Analizy morfometryczne mięśni wyćwiczonych i niewprawnych psów. Am. J. Anat. 166, 359–368. doi: 10.1002 / aja.1001660309
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Cheema, N., Herbst, A., McKenzie, D., and Aiken, J. M. (2015). Apoptoza i martwica pośredniczą w utracie włókien mięśni szkieletowych w indukowanych wiekiem mitochondrialnych zaburzeniach enzymatycznych. Starzejąca Się Komórka 14, 1085-1093. doi: 10.1111 / acel.12399
PubMed Abstract / CrossRef Full Text / Google Scholar
Rozwojowa śmierć komórki: różnorodność morfologiczna i wiele mechanizmów. Anat. Embriol. 181, 195–213.
Google Scholar
Cohen, S., Nathan, J. A., and Goldberg, A. L. (2015). Zanik mięśni w chorobie: mechanizmy molekularne i obiecujące terapie. Nat. Ks. Lek Discov. 14, 58–74. doi: 10.1038/nrd4467
PubMed Streszczenie | CrossRef Pełny tekst/Google Scholar
Duddy, W. J., Cohen, T., Duguez, S., and Partridge, T. A. (2011). Wyizolowane włókno mięśniowe jako model atrofii nieużywanej: charakterystyka przy użyciu PhAct, metody oznaczania ilościowego f-aktyny. Exp. Cela Res. 317, 1979-1993. doi: 10.1016 / j.yexcr.2011.05.013
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Dumont, N. A., Wang, Y. X., and Rudnicki, M. A. (2015). Wewnętrzne i zewnętrzne mechanizmy regulujące funkcjonowanie komórek satelitarnych. Rozwój 142, 1572-1581. doi: 10.1242 / dev.114223
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Egner, I. M., Bruusgaard, J. C., Eftestol, E., and Gundersen, K. (2013). Mechanizm pamięci komórkowej wspomaga przerost przeciążenia w mięśniach długo po epizodycznej ekspozycji na sterydy anaboliczne. J. Fizjol. 591, 6221–6230. doi: 10.1113 / jphysiol.2013.264457
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Egner, I. M., Bruusgaard, J. C., and Gundersen, K. (2016). Ubytek komórek satelitarnych zapobiega przerostowi włókien w mięśniach szkieletowych. Development 143, 2898-2906. doi: 10.1242 / dev.134411
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Fitts, R. H., Metzger, J. M., Riley, D. A., and Unsworth, B. R. (1986). Modele nieużywania: porównanie zawieszenia tylnego i unieruchomienia. J. Appl. Physiol. 60, 1946–1953.
Google Scholar
Ginet, V., Pittet, M. P., Rummel, C., Osterheld, M. C., Meuli, R., Clarke, P. G., et al. (2014). Umierające neurony we wzgórzach uduszonych noworodków i szczurów są autofagiczne. Ann. Neurol. 76, 695–711. doi: 10.1002 / ana.24257
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Goh, Q., and Millay, D. P. (2017). Wymaganie fuzji komórek macierzystych za pośrednictwem miomakera w celu przerostu mięśni szkieletowych. elife 6. doi: 10.7554 / eLife.20007
PubMed Abstract / CrossRef Full Text / Google Scholar
Grzegorz, T. R. (2001). Zbieg okoliczności, koewolucja czy związek przyczynowy? Zawartość DNA, wielkość komórki i enigma wartości C. Biol. Ks. Camb. Philos. Soc. 76, 65–101. doi: 10.1017/s1464793100005595
PubMed Streszczenie | CrossRef Pełny tekst/Google Scholar
Guerci, A., Lahoute, C., Hebrard, S., Collard, L., Graindorge, D., Favier, M., et al. (2012). Zależne od Srf sygnały parakryny wytwarzane przez włókna mięśniowe kontrolują przerost mięśni szkieletowych za pośrednictwem komórek satelitarnych. Cell Metab. 15, 25–37. doi: 10.1016 / j.cmet.2011.12.001
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Gundersen, K. (2016). Pamięć mięśniowa i nowy model komórkowy zaniku i przerostu mięśni. J. Exp. Biol. 219, 235–242. doi: 10.1242 / jeb.124495
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Gundersen, K., and Bruusgaard, J. C. (2008). Domeny jądrowe podczas zaniku mięśni: utracone jądra czy utracone paradygmaty? J. Fizjol. 586, 2675–2681. doi: 10.1113 / jphysiol.2008.154369
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Guo, B. S., Cheung, K. K., Yeung, S. S., Zhang, B. T., and Yeung, E. W. (2012). Stymulacja elektryczna wpływa na proliferację komórek satelitarnych i apoptozę w atrofii mięśni wywołanej rozładunkiem u myszy. PLoS One 7: e30348. doi: 10.1371 / dziennik.pone.0053523
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Jackson, J. R., Mula, J., Kirby, T. J., Fry, C. S., Lee, J. D., Ubele, M. F., et al. (2012). Ubytek komórek satelitarnych nie hamuje odrastania mięśni szkieletowych dorosłych po zaniku wywołanym rozładunkiem. Am. J. Phys. Fizjol Komórkowy. 303, C854-C861. doi: 10.1152 / ajpcell.00207.2012
PubMed Abstract | CrossRef Full Text | Google Scholar
Joubert, Y., and Tobin, C. (1995). Leczenie testosteronem powoduje aktywację spoczynkowych komórek satelitarnych i rekrutację do cyklu komórkowego w mięśniu niwelatora szczura. Dev. Biol. 169, 286–294. doi: 10.1006 / dbio.1995.1144
PubMed Abstract / CrossRef Full Text / Google Scholar
Zakończenia włókien nerwowych aferentnych w trzonie mięśniowym żaby. Philos. Trans. R. Soc. Lond. B Biol. Sci. 243, 221–240.
PubMed Abstract/Google Scholar
Kletzien, H., Hare, A. J., Leverson, G., and Connor, N. P. (2018). Związany z wiekiem wpływ śmierci komórki na morfologię włókien i liczbę mięśni języka. Nerw Mięśniowy 57, E29–E37. doi: 10.1002 / mus.25671
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Kole, A. J., Annis, R. P., and Deshmukh, M. (2013). Dojrzałe neurony: przystosowane do przetrwania. Śmierć Komórki Dis. 4: e689. doi: 10.1038 / cddis.2013.220
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Li, T. S., Shi, H., Wang, L., and Yan, C. (2016). Wpływ mezenchymalnych komórek macierzystych szpiku kostnego na proliferację komórek satelitarnych i apoptozę w atrofii mięśni wywołanej unieruchomieniem u szczurów. Med. Sci. Monit. 22, 4651–4660. doi: 10.12659 / MSM.898137
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Lockshin, R. A., and Williams, C. M. (1965). Programowana śmierć komórki – I. cytologia zwyrodnienia w mięśniach międzysegmentalnych jedwabiu Pernyi. J. Insect Physiol. 11, 123–133. doi: 10.1016/0022-1910(65)90099-5
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Longtine, M. S., Barton, A., Chen, B., and Nelson, D. M. (2012). Obrazowanie żywych komórek pokazuje, że apoptoza inicjuje się lokalnie i propaguje jako fala przez syncytiotrophoblasty w pierwotnych kulturach ludzkich łożyskowych trofoblastów. Łożysko 33, 971-976. doi: 10.1016 / j.łożysko.2012.09.013
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Mauro, A. (1961). Komórka satelitarna włókien mięśni szkieletowych. J. Biophys. Biochem. Cytol. 9, 493–495.
Google Scholar
Mayhew, T. M., Leach, L., McGee, R., Ismail, W. W., Myklebust, R., and Lammiman, M. J. (1999). Proliferacja, różnicowanie i apoptoza w trofoblastach kosmkowatych w 13-41 tygodniu ciąży (w tym obserwacje lameli pierścieniowych i kompleksów porów jądrowych). Placenta 20, 407-422. doi: 10.1053 / plac.1999.0399.
PubMed Streszczenie | CrossRef Pełny tekst/Google Scholar
McCall, G. E., Allen, D. L., Linderman, J. K., Grindeland, R. E., Roy, R. R., Mukku, V. R., et al. (1998). Utrzymanie wielkości domeny miojądrowej w soleusie szczura po przeciążeniu i leczeniu hormonem wzrostu/IGF-I. J. Appl. Physiol. 84, 1407–1412.
Google Scholar
McClung, J. M., Kavazis, A. N., DeRuisseau, K. C., Falk, D. J., Deering, M. A., Lee, Y., et al. (2007). Kaspaza-3 regulacja domeny miojądrowej przepony podczas atrofii wywołanej wentylacją mechaniczną. Am. J. Respir. Hematokryt. Care Med. 175, 150–159. 10.1164/rccm.200601-142oc
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Metter, E. J., Talbot, L. A., Schrager, M., and Conwit, R. (2002). Siła mięśni szkieletowych jako czynnik przewidujący śmiertelność wszystkich przyczyn u zdrowych mężczyzn. J. Gerontol. Biol. Sci. Med. Sci. 57, B359-B365. doi: 10.1093 / gerona / 57.10.B359
PubMed Streszczenie | CrossRef Pełny tekst / Google Scholar
Minnaard, R., Drost, M. R., Wagenmakers, A. J., van Kranenburg, G. P., Kuipers, H., and Hesselink, M. K. (2005). Zanik mięśni szkieletowych i kurczliwość u szczurów septycznych. Nerw Mięśniowy 31, 339-348. doi: 10.1002 / mus.20268
PubMed Abstrakt | CrossRef Pełny tekst | Google Scholar
(1968). Zależność między wymiarami włókien a liczbą jąder podczas normalnego wzrostu mięśni szkieletowych u ptactwa domowego. Am. J. Anat. 122, 555–563. doi: 10.1002 / aja.1001220308
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Murach, K. A., Englund, D. A., Dupont-Versteegden, E. E., McCarthy, J. J., and Peterson, C. A. (2018). Elastyczność domeny miojądrowej podważa sztywne założenia dotyczące wkładu komórek satelitarnych w przerost włókien mięśni szkieletowych. Przód. Physiol. 9:635. doi: 10.3389 / fphys.2018.00635
CrossRef Pełny tekst/Google Scholar
Nevalainen, M., Kaakinen, M., and Metsikko, K. (2013). Dystrybucja transkryptów mRNA i aktywności translacyjnej w włóknistach szkieletowych. Cell Tissue Res. 353, 539-548. doi: 10.1007 / s00441-013-1659-x
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
O ’ Leary, M. F., Vainshtein, A., Carter, H. N., Zhang, Y., and Hood, D. A. (2012). Dysfunkcja mitochondrialna i autofagia wywołane denerwacją w mięśniach szkieletowych zwierząt z niedoborem apoptozy. Am. J. Phys. Fizjol Komórkowy. 303, C447-C454. doi: 10.1152/ajpcell.00451.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Palumbo, C., Rovesta, C., and Ferretti, M. (2012). Striated muscle fiber apoptosis after experimental tendon lesion in a rat model. J. Anat. 221, 358–363. doi: 10.1111/j.1469-7580.2012.01554.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Qaisar, R., and Larsson, L. (2014). What determines myonuclear domain size? Indian J. Physiol. Pharmacol. 58, 1–12.
PubMed Abstract | Google Scholar
Ross, J. A., Levy, Y., Svensson, K., Philp, A., Schenk, S., and Ochala, J. (2018). SIRT1 reguluje liczbę jądrową i rozmiar domeny we włóknach mięśni szkieletowych. J. Cell. Physiol. 233, 7157–7163. doi: 10.1002 / jcp.26542
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Schiaffino, S., Dyar, K. A., Ciciliot, S., Blaauw, B., and Sandri, M. (2013). Mechanizmy regulujące wzrost i zanik mięśni szkieletowych. FEBS J. 280, 4294-4314. doi: 10.1111 / febs.12253
PubMed Abstract | CrossRef Full Text | Google Scholar
Schmalbruch, H., and Hellhammer, U. (1977). Liczba jąder w mięśniach dorosłych szczurów ze szczególnym uwzględnieniem komórek satelitarnych. Anat. Rec. 189, 169–175. doi: 10.1002 / ar.1091890204
PubMed Abstract / CrossRef Full Text / Google Scholar
Zanik i zaprogramowana śmierć komórek mięśni szkieletowych. Śmierć Komórki Różni Się. 15, 1163–1169. doi: 10.1038 / cdd.2008.68
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Schwartz, L. M., Brown, C., McLaughlin, K., Smith, W., and Bigelow, C. (2016). Domena miojądrowa nie jest utrzymywana w mięśniach szkieletowych podczas atrofii lub programowanej śmierci komórki. Am. J. Phys. Fizjol Komórkowy. 311, C607-C615. doi: 10.1152 / ajpcell.00176.2016
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Schwartz, L. M., and Ruff, R. L. (2002). Zmiany w kurczliwych właściwościach mięśni szkieletowych podczas rozwoju zaprogramowanego zaniku i śmierci. Am. J. Phys. Fizjol Komórkowy. 282, C1270–C1277. doi: 10.1152 / ajpcell.01275.2000
CrossRef Full Text | Google Scholar
, and Osborne, B. A. (1993). Czy wszystkie zaprogramowane zgony komórek następują poprzez apoptozę? Proc. Natl. Acad. Sci. U. S. A. 90, 980-984.
Google Scholar
Hormonalna kontrola tempa rozwoju metamorficznego w robaku tytoniowym Manduca sexta. Dev. Biol. 99, 103–114. doi: 10.1016/0012-1606(83)90257-9
PubMed Abstract | CrossRef Full Text / Google Scholar
Peptydowa i steroidowa Regulacja zwyrodnienia mięśni u owada. Nauka 215, 1420-1421. doi: 10.1126 / nauki.6278594
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Smith, H. K., Maxwell, L., Martyn, J. A., and Bass, J. J. (2000). Fragmentacja jądrowego DNA i zmiany morfologiczne w mięśniach szkieletowych dorosłych królików po krótkotrwałym unieruchomieniu. Cell Tissue Res. 302, 235-241. doi: 10.1007/s004410000280
PubMed Streszczenie | CrossRef Pełny tekst/Google Scholar
Smith, M. I., Huang, Y. Y., and Deshmukh, M. (2009). Różnicowanie mięśni szkieletowych wywołuje endogenny XIAP w celu ograniczenia szlaku apoptotycznego. PLoS One 4: e5097. doi: 10.1371/journal.muffinki.0005097
CrossRef pełny tekst/Google Scholar
Staron, R. S., Leonardi, M. J., Karapondo, D. L., Malicky, E. S., Falkel, J. E., Hagerman, F. C., et al. (1991). Siła i mięśnie szkieletowe adaptacyjne in heavy-resistance-trained women after detraining and przekwalifikowanie. J. Appl. Fizjonomia. 70, 631-640.
Naukowiec Google
Strassburger, E. (1893). Jest to zakres jąder i wielkość komórek. Histol Refundacja. 5, 97-124.
Naukowiec Google
Strasser, H., Tifenthaler, M., Steinlechner, M., Eder, I., Bartsch, G., and Konwalinka, G. (2000). Apoptoza zależna od wieku i utrata komórek rhabdosphincter. J. Urol. 164, 1781–1785. DOI: 10.1016/S0022-5347(05)67106-6
PubMed Streszczenie | CrossRef Pełny tekst/Google Scholar
Tedesco, F. S., Dellavalle, A., Diaz-Manera, J., Messina, G., and Cossu, G. (2010). Naprawa mięśni szkieletowych: potencjał regeneracyjny komórek macierzystych mięśni szkieletowych. J. Clin. Inwestuj. 120, 11–19. doi: 10.1172/JCI40373
PubMed Abstract | CrossRef Full Text/Google Scholar
Wada, K. I., Takahashi, H., Katsuta, S., and Soya, H. (2002). Brak spadku liczby miojądrzastych po długotrwałej denerwacji u dojrzałych myszy. Am. J. Phys. Fizjol Komórkowy. 283, C484-C488. doi: 10.1152 / ajpcell.00025.2002
CrossRef Pełny tekst | Google Scholar
Winje, I. M., Sheng, X., Hansson, K. A., Solbrå, A., Tennøe, S., Saatcioglu, F., et al. (2018a). Wyniszczenie nie powoduje utraty mionuklei ani włókien mięśniowych podczas przeszczepionego raka prostaty u myszy. Acta Physiol. e13204 10.1111 / apha13204
CrossRef Pełny tekst | Google Scholar
Winje, I. M., Bengtsen, M., Eftestol, E., Juvkam, I., Bruusgaard, J. C., and Gundersen, K. (2018b). Specyficzne znakowanie mionuklei przez przeciwciało przeciwko materiałowi okołonerkowemu 1 na odcinkach tkanki mięśni szkieletowych. Acta Physiol. 223: e13034 10.1111 / apha13034
CrossRef Pełny tekst / Google Scholar
Woo, J. (2017). Sarkopenia. Clin. Geriatr. Med. 33, 305–314. doi: 10.1016 / j.c.2010.02.012
CrossRef Pełny tekst | Google Scholar
Xiao, R., Ferry, A. L., and Dupont-Versteegden, E. E. (2011). Oporność na śmierć komórkową zróżnicowanych miotub wiąże się z silniejszymi mechanizmami anty-apoptotycznymi w porównaniu z mioblastami. Apoptoza 16, 221-234. doi: 10.1007 / s10495-010-0566-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, D., Morris, S. F., and Sigurdson, L. (1998). The Sartorius muscle: anatomic considerations for reconstructive surgeons. Surg.Radiol. Anat. 20, 307–310. doi: 10.1007
PubMed Streszczenie | CrossRef Pełny tekst/Google Scholar
Zhong, H., Roy, R. R., Siengthai, B., and Edgerton, V. R. (2005). Wpływ bezczynności na wielkość włókien i liczbę jąder w mięśniu Solus szczura. J. Appl. Physiol. 99, 1494–1499. doi: 10.1152 / jappphysiol.00394.2005
CrossRef Pełny tekst | Google Scholar
Zhou, X., Wang, J. L., Lu, J., Song, Y., Kwak, K. S., Jiao, Q., et al. (2010). Odwrócenie wyniszczenia nowotworowego i zaniku mięśni przez antagonizm Act RIIB prowadzi do wydłużenia przeżycia. Kom. 142, 531-543. doi: 10.1016 / j.cell.2010.07.011
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Ziaaldini, M. M., Marzetti, E., Picca, A., and Murlasits, Z. (2017). Biochemical pathways of sarkopenia and their modulation by physical exercise: a narrative review. Przód. Med. 4:167. doi: 10.3389 / fmed.2017.00167
CrossRef Pełny tekst / Google Scholar