- wstęp
- materiały i metody
- szczepy
- ekstrakcja DNA
- Amplifikacje STX1 i STX2 PCR
- sekwencjonowanie DNA
- Microplate Vero Cells Preparations
- bezkomórkowe preparaty bakteryjne
- Test cytotoksyczny i oznaczanie LD50
- Test blokady i neutralizacji toksyn
- pobieranie OMVs i ekstrakcja DNA z OMVs
- wyniki
- Amplifikacje PCR genów stx1 i stx2
- sekwencjonowanie DNA
- Test cytotoksyczności i oznaczanie LD50
- neutralizacja toksyn
- Amplifikacje PCR genu stx1 z OMVs
- dyskusja
- wkład autora
- Funding
- Oświadczenie o konflikcie interesów
- podziękowania
- skróty
wstęp
od kilku lat znaczenie Aeromonas spp., jako czynnik powodujący biegunkę u ludzi był kontrowersyjny; kilka badań wykazało, że patogenny mechanizm Aeromonas jest wieloczynnikowy, ponieważ bierze udział wiele czynników wirulencji, w tym produkcja cytotoksyn (Castro-Escarpulli et al., 2002, 2003). Toksyny te mogą powodować biegunkę lub krwotoczne zapalenie jelita grubego i mogą odgrywać główną rolę w zespole hemolityczno-mocznicowym (HUS) i rozwoju TTP (Bogdanović et al., 1991; Fang et al., 1999; Monforte-Cirac et al., 2010).
cytotoksyny zaangażowane w te choroby obejmują toksyny Shiga i blisko spokrewnione Stx. Warianty Stx są wyrażone w gatunkach bakterii Shigella, Enterobacter, Citrobacter, Acinetobacter, Campylobacter i Hamiltonella (Mauro and Koudelka, 2011). Alperi i Figueras (2010) opisali obecność Stx1 i Stx2 w izolatach klinicznych Aeromonas spp., związane z zapaleniem żołądka i jelit, krwotocznym zapaleniem jelita grubego i HUS. Geny kodujące te toksyny znajdują się w różnych bakteriofagach lambdoidalnych, które lizogenizują ten szczep. Ponadto rodzaj Aeromonas ma system zerowej sekrecji o nazwie OMVs. OMVs może być środkiem, za pomocą którego niektóre białka, RNA, Elementy przestrzeni peryplazmatycznej i inne składniki związane z zjadliwością mogą być przenoszone poziomo na inne rodzaje; dlatego uważa się, że OMVs odgrywają ważną rolę w patogenności (Guerrero-Mandujano et al.,2015a, b).
z tego powodu celem pracy była ocena uszkodzeń spowodowanych wytwarzaniem Stx przez szczepy wyizolowane od dzieci z Mexico City w kulturach komórkowych Vero.
materiały i metody
szczepy
badanie to obejmowało 66 izolatów klinicznych z INP, 54 uzyskane z jelit i 12 z infekcji pozajelitowych. Szczepy zostały wyizolowane z próbek uzyskanych do rutynowych badań we wspomnianym szpitalu, dlatego nie była wymagana świadoma zgoda rodziców lub prawnych opiekunów dzieci. Wszystkie szczepy zostały genetycznie zidentyfikowane przez 16S rDNA-RFLP(Hernández-Cortez et al., 2011). Typowy szczep Escherichia coli O157: H7 CECT 4076 został użyty jako kontrola pozytywna, a szczep E. coli K12 (5512 ENCB) z kolekcji medycznego laboratorium bakteriologicznego (Escuela Nacional de Ciencias Biologicas, IPN) został użyty jako kontrola negatywna produkcji toksyn. Szczepy utrzymywano przez krótki czas w temperaturze pokojowej na skosach na bazie agaru we krwi; w celu dłuższego przechowywania zamrożono je w temperaturze -70°C w 20% (w/v) bulionie glicerolowo-Todd-Hewitt (Oxoid, Meksyk) lub liofilizowano w 7.5% końskiej surowicy glukozy.
ekstrakcja DNA
wszystkie kultury hodowano na tryptycznym agarze sojowym w temperaturze 30°C przez 18 godzin. genomowy DNA każdego szczepu uzyskano za pomocą matrycy InstaGene (BioRad®, Meksyk) zgodnie z instrukcją dostarczoną przez producenta. Czystość i ilość DNA określono za pomocą spektrofotometru Ampli Quant AQ-07. DNA przechowywano w temperaturze -20°C do czasu użycia.
Amplifikacje STX1 i STX2 PCR
obecność stx1 i stx2 z DNA OMVs i genomowego DNA wykryto w pojedynczych reakcjach PCR przy użyciu starterów STX1F/STX1R i STXF/STXR z produktem odpowiednio 144 i 217 bp, te startery zaprojektowano w oparciu o sekwencję podjednostki A. startery, reakcja i warunki amplifikacji zostały przetworzone jak wcześniej opisane przez Hernándeza-Corteza i in.. (2013), z kontrolą dodatnią (E. coli O157:H7) i ujemną (E. coli K12).
sekwencjonowanie DNA
produkty reakcji łańcuchowej polimerazy oczyszczono przy użyciu zestawu do szybkiej ekstrakcji żelu PureLink (Invitrogen®, Meksyk) zgodnie z instrukcjami producenta. Produkty zostały zsekwencjonowane bezpośrednio na analizatorze genetycznym ABI-PRISM 310 (Applied Biosystems, Foster City, CA, USA) przy użyciu starterów do przodu i do tyłu stosowanych do PCR, zgodnie z instrukcjami producenta. Sekwencjonowanie przeprowadzono w Instituto de Biología, UNAM (Meksyk). Analiza sekwencji została przeprowadzona za pomocą podstawowego narzędzia wyszukiwania lokalnego wyrównania (BLAST) dostarczonego przez Narodowe Centrum Informacji biotechnologicznej (NCBI).
Microplate Vero Cells Preparations
zabieg ten przeprowadzono w 96-studzienkowych mikropłytkach z monowarstwą komórkową Vero (ATCC CCL81) z 80% konfluencją, z dodatkiem minimum essential medium (mem; Invitro®, Meksyk) uzupełnionego 10% v/v płodowej surowicy bydlęcej (FBS; Invitro®, Meksyk).
zawiesinę komórek homogenizowano i dostosowano do 105-106 komórek/mL za pomocą komory Neubauera. Po regulacji zawiesinę osadzano w studni 200 µL. Mikropłytki inkubowano w temperaturze 37°C poniżej 5% CO2 przez 24 godziny (Inkubator CO2, VWR Scientific, USA) (Giono-Cerezo et al., 1994).
bezkomórkowe preparaty bakteryjne
pięć kolonii z każdej płytki agaru krwi zaszczepiono do 3 mL pożywki Craiga (0,4% ekstraktu drożdżowego, 3% kwasów kazaminowych, 0,05% K2HPO4). Inkubowano je przez 24 godziny w temperaturze 37°C, a gęstość optyczna użytej hodowli bakteryjnej wynosiła 0,25 przy 600 nm. Preparaty bezkomórkowe wytwarzano przez odwirowanie kultur w temperaturze 14 000 g przez 10 minut w temperaturze 4°C, a następnie filtrację supernatantu przez filtr membranowy (wielkość porów 0,45 pm, Sartorius Minisart NML). Supernatanty bezkomórkowe przechowywano w temperaturze -20°C. W ten sposób uzyskano łącznie 66 bezkomórkowych preparatów bakteryjnych; w ten sam sposób uzyskano również kontrolę pozytywną (E. coli O157:H7) i negatywną (E. coli K12) (Giono-Cerezo i wsp., 1994).
Test cytotoksyczny i oznaczanie LD50
filtrat wolny od komórek (20 µL) zaszczepiono do studzienek zawierających komórki i odpowiednie podłoże wzrostowe bez antybiotyków. Zaszczepione komórki inkubowano przez 96 godzin w 37°C z 5% CO2 i obserwowano co 24 godziny w odwróconym mikroskopie. Spodziewano się, że efekt cytotoksyczny pojawi się w postaci zaokrąglenia i kurczenia się komórek o grubej granulacji, a wreszcie postępującego i nieodwracalnego niszczenia monowarstwy. Wszystkie testy przeprowadzono w dwóch egzemplarzach; przeprowadzono również kontrolę żywotności z mem i medium Craiga(Giono-Cerezo et al., 1994).
oznaczono LD50 w szczepach Aeromonas wykrytych jako pozytywne w powodowaniu uszkodzeń cytotoksycznych w komórkach Vero. Standardową 96-studzienkową mikropłytkę z komórkami Vero przygotowano, jak wskazano w 2.6, ale podłoże zmieniono na 100 µL MEM z 1% BFS. Preparat ten wystawiono na działanie 100 µL bezkomórkowego preparatu bakteryjnego i przeprowadzono szeregowe rozcieńczenia na całym rzędzie płytek. Po 24 godzinach inkubacji w temperaturze 37°C z 5% CO2 oznaczono LD50 pod mikroskopem odwróconym. LD50 przypisano do studni, w której 50% komórek Vero zostało uszkodzonych, a 50% nie-uszkodzonych (Marques et al., 1986).
Test blokady i neutralizacji toksyn
test neutralizacji toksyn przeprowadzono w szczepach, które wywołały uszkodzenia cytotoksyczne w komórkach Vero, ponieważ uszkodzenie to wskazuje na Stx. Do tego testu przygotowano mikropłytkę z komórką Vero wyhodowaną do zbiegu 90-100% z LD50 każdego bezkomórkowego preparatu bakteryjnego. W celu przeprowadzenia testu neutralizacji w celu wykazania uszkodzenia komórek wywołanego działaniem Stx zastosowano dwa przeciwciała monoklonalne (Universidad Nacional Autónoma de México) uzyskane z E. coli O157:H7.
dla każdego Ab przeprowadzono oznaczanie ilości białka Bradforda zgodnie z instrukcją producenta (Biorad), z wynikiem odpowiednio 78,2 i 74,8 µg/µL anty-Stx1 i anty-Stx2 A. stężony Ab badano i dwukrotnie rozcieńczono Ab. Następnie inkubowano 10 µL AB (anty-STX1 lub anty-stx2) z 190 µL supernatantu wolnego od komórek w stężeniu LD50 przez 1 godzinę w 37°C. Następnie 200 µL tego ostatniego zaszczepiono do komórek Vero w 90% zbiegu i inkubowano przez 24 godziny w 37°C z 5% CO2 (Marques i wsp., 1986).
pobieranie OMVs i ekstrakcja DNA z OMVs
zewnętrzne pęcherzyki błonowe uzyskano z Aeromonas hydrophila F-0050. Protokół został wykonany zgodnie z wcześniej opisanym przez Guerrero-Mandujano et al. (2015a).
DNA OMVs uzyskano za pomocą matrycy InstaGene (BioRad®, Meksyk) zgodnie z instrukcjami dostarczonymi przez producenta. Następnie DNA OMVs oczyszczono techniką ekstrakcji DNA fenolowo-chloroformową (Guerrero-Mandujano et al.,2015b).
wyniki
Amplifikacje PCR genów stx1 i stx2
badania przesiewowe reakcji łańcuchowej polimerazy 66 klinicznych szczepów Aeromonas wykazały, że 22/66 (33,3%) szczepów zawierały Gen stx1, 42/66 (63,6%) szczepy zawierały oba geny, żadne szczepy nie zawierały tylko genu stx2, a 2/66 (3%) szczepów było ujemne dla obu genów.
sekwencjonowanie DNA
analiza BLASTn wykazała 79 do 99% podobieństwa i oczekiwaną wartość 3E-16/2e-97 pomiędzy genami stx-1 / stx-2 E. coli O157:H7 i amplikonem z Aeromonas spp., szczepy.
Test cytotoksyczności i oznaczanie LD50
test cytotoksyczności przeprowadzony w hodowlach komórek Vero wykazał, że 17/66 (25,7%) bezkomórkowych preparatów bakteryjnych powodowało uszkodzenia cytotoksyczne, co sugeruje wytwarzanie aktywnego Stx (Fig.1), objawiające się charakterystycznymi uszkodzeniami spowodowanymi przez Stx.
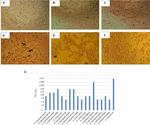
rysunek 1. Badanie cytotoksyczności i oznaczanie LD50 w hodowlach komórek Vero. A) hodowla komórek Vero z minimalnym podstawowym pożywką (Test żywotności). B) hodowla komórek Vero z pożywką Craiga (Test żywotności). C) Kontrola negatywna za pomocą E. coli K12. D) kontrola pozytywna z E. coli O157: H7, uszkodzenie cytotoksyczne jest pokazane (strzałki) przez zniszczenie monowarstwy komórki i efekt „starej koronki”. E) uszkodzenie cytotoksyczne szczepu A. hydrophila f-0050. F) uszkodzenie cytotoksyczne szczepu A. caviae 421423. G) graficzne przedstawienie miana LD50 wszystkich szczepów.
wyniki oznaczania miana LD50 były następujące: 6/17 (35,2%) bezkomórkowych preparatów bakteryjnych miało miana 1:16; 5/17 (29,4%) bezkomórkowych preparatów bakteryjnych miało miana 1:8; 3/17 (17,6%) bezkomórkowych preparatów bakteryjnych miało miana 1:64; 2/17 (11,7%) bezkomórkowych preparatów bakteryjnych o mianie 1:16; 32; oraz 1/17 (5,8%) BEZKOMÓRKOWYCH preparatów bakteryjnych o mianie 1:256 (fig.
neutralizacja toksyn
zastosowanie anty-Stx1 Ab w 11/17 (64.7%) szczepy uszkodzenie komórek w supernatancie zostało całkowicie zahamowane przy stężeniu Ab 39,1 µg/µL; w 4/17 (23,5%) bezkomórkowych preparatach bakteryjnych zaobserwowano zmniejszenie uszkodzenia komórek przy tym samym stężeniu; a w 2/17 (11,7%) bezkomórkowych preparatach bakteryjnych uszkodzenie komórek zostało całkowicie zahamowane przy stężeniu 78,2 µg/µL. Zastosowanie AB anty-STX2 wykazało, że w 9/17 (52,9%) bezkomórkowych preparatach bakteryjnych uszkodzenie komórek było całkowicie hamowane przy 37,4 µg/µL, a 6/17 (35,2%) bezkomórkowych preparatach bakteryjnych wykazało zmniejszone uszkodzenie komórek przy tym samym stężeniu; oraz w 2/17 (11.7%) bezkomórkowych preparatów bakteryjnych, uszkodzenie komórek zostało całkowicie zahamowane przy stężeniu Ab wynoszącym 74,8 µg / µL (fig. 2 i 3).

rysunek 2. Hamowanie działania cytotoksycznego indukowanego w hodowli komórek Vero przez bezkomórkowe preparaty bakteryjne Aeromonas spp. szczepy posiadające Gen stx1 lub stx2.
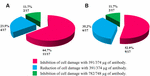
Rysunek 3. Procent szczepów wykazujących zahamowanie lub zmniejszenie uszkodzenia komórek. A) neutralizacja za pomocą anty-Stx1 Ab. B) neutralizacja za pomocą anty-Stx2 Ab.
Amplifikacje PCR genu stx1 z OMVs
łańcuchowa reakcja polimerazy DNA OMVs A. hydrophila F-0050 ujawniła, że OMVs zawierały gen stx1; stąd OMVs mogą być potencjalnym nośnikiem poziomego transferu genów zjadliwości (ryc. 4).
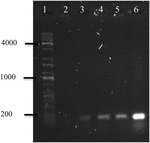
rysunek 4. Elektroferogram amplifikacji genu stx1 z dna OMVs. (1) drabina uniwersalna Kapa, (2) Kontrola negatywna, (3) OMVs A. hydrophila F-0050, (4) A. hydrophila F-0050, (5) OMVs E. coli O157:H7 oraz (6) E. coli O157:H7.
dyskusja
rodzaj Aeromonas, jako producent Stx, może być emergentnym patogenem, który powoduje biegunkę głównie u pacjentów pediatrycznych (Hernández-Cortez et al., 2011; Figueras i Baez-Hidalgo, 2014). Niemniej jednak ten rodzaj stał się bardziej istotny w dziedzinie medycyny, ponieważ jest to patogen powodujący HUS (San Joaquín and Pickett, 1988;Bogdanović et al., 1991; Robson et al., 1992; Fang et al., 1999; Monforte-Cirac et al., 2010).
w tym badaniu odkryliśmy, poprzez amplifikację PCR genów stx1 i stx2, że 22/66 (33.3%) szczepów aeromonad zawierało Gen stx1, 42/66 (63,6%) szczepów zawierało oba geny i nie było szczepów zawierających sam stx2. Może to prowadzić do sugerowania, że gen ten jest szeroko rozpowszechniony w szczepach Aeromonas wyizolowanych od pacjentów pediatrycznych i że ci pacjenci mogą być narażeni na rozwój HUS.
jest tylko jeden poprzedni raport, w którym geny stx były badane w szczepach Aeromonas wyizolowanych z różnych szpitali w Hiszpanii; uzyskane wyniki wykazały, że 19/80 (23,7%) szczepów miało Gen stx1, a tylko 1/80 (1.25%) szczep był dodatni dla obu genów (Alperi i Figueras, 2010). Wyniki te pokazują, że istnieje większa Dystrybucja genu w meksykańskich szczepach; jednak powinniśmy wziąć pod uwagę, że w Hiszpanii Rodzaj Aeromonas jest znanym patogenem żołądkowo-jelitowym izolowanym rutynowo u pacjentów z profilem żołądkowo-jelitowym, w związku z tym podaje się odpowiednie leczenie w celu skonfrontowania tego rodzaju.
w Meksyku rodzaj ten nie znajduje się na liście patogenów powodujących biegunkę i nie jest rutynowo izolowany; w rezultacie trudno jest zapewnić pacjentom jakiekolwiek leczenie i dobrą jakość życia; ponadto nie ma statystyk dotyczących jego występowania. Ponadto rodzaj staje się bardziej istotny ze względu na warunki socjoekonomiczne populacji meksykańskiej, w tym niedobór wody; ułatwia to jego przenoszenie i zwiększa prawdopodobieństwo, że HUS stanie się problemem zdrowia publicznego.
przeprowadzono sekwencjonowanie amplikonów i przeprowadzono poszukiwania blastów, które wykazały 79-99% podobieństwo i wartość oczekiwaną 3E-16/2e-97 między genami stx1/stx2 w porównaniu do E. coli O157:H7.
oznaczono LD50 w celu oceny uszkodzeń cytotoksycznych w hodowli komórek Vero; z tym parametrem i na podstawie Marques i wsp. (1986), szczepy mogą być zgrupowane w niskiej (2 × 101 do 6 × 102), umiarkowanej (103-104) i wysokiej (105-108) produkcji (rysunek 1g). Marques et al. (1986) przeprowadzili badanie, w którym wykonali podobny test do obecnego badania, ale z różnymi szczepami STEC uzyskali, że 262/400 (63%) szczepów zostało zgrupowanych jako producenci o niskiej zawartości Stx, a 48% powodowało uszkodzenia cytotoksyczne; niemniej jednak u 40% tych szczepów uszkodzenie cytotoksyczne hamowano za pomocą przeciwciał anty-Stx.
w niniejszym badaniu, 25,7% preparatów wolnych od bakterii powodowało uszkodzenia cytotoksyczne charakterystyczne dla Stx w komórkach Vero, co sugeruje wytwarzanie aktywnego Stx, wszystkie szczepy Aeromonas zostały zgrupowane jako niskie producenci STX; jednak w 50-70% supernatantów wolnych od komórek uszkodzenie komórek zostało zahamowane, a w 20-30% supernatantów wolnych od komórek uszkodzenie komórek zostało zmniejszone (ryc. 3). Wolne od komórek supernatanty, w których zmniejszono uszkodzenia komórkowe, mogły to być spowodowane dwoma wariantami toksyny obecnej w supernatancie, w związku z tym, ponieważ różnią się one immunologicznie, Stx nie mógł być całkowicie zahamowany ,a uszkodzenia komórkowe pozostały (Marques et al., 1986).
dwa wcześniejsze badania (Haque et al., 1996; Alperi i Figueras, 2010) uzyskali odpowiednio 10,2% i 10,53% szczepów Aeromonas wytwarzających Stx1. Przyczyną wyższego odsetka szczepów Aeromonas wytwarzających aktywny Stx może być wysoka dostępność bakteriofagu Stx wewnątrz kultury, ponieważ niektóre szczepy Stec nośniki bakteriofagu Stx zostały wyizolowane ze ścieków miejskich z oczyszczalni, ścieków z ubojni i stolców bydła (García-Aljaro et al., 2004, 2009). Podobnie przeprowadzono badania transdukcji in vivo z fagami Stx z E. coli, które mogą infekować bakterie mikrobioty jelitowej, nadając właściwość toksykologiczną szczepom, które wcześniej nie były zakażone (Acheson et al., 1998; Schmidt et al., 1999; Gamage et al., 2003). To samo może się zdarzyć w przypadku rodzaju Aeromonas, gdy indukuje się profil przewodu pokarmowego, a następnie fakt, że rodzaj Aeromonas ma zdolność do wychwytywania i integrowania czynników zjadliwości w swoim genomie, a jednym z nich jest gen kodujący Stx.
reszta szczepów spowodowała uszkodzenie cytotoniczne w komórce, prawdopodobnie sugerując produkcję różnych toksyn innych niż Stx, ponieważ Aeromonas jest rodzajem zdolnym do wytwarzania dwóch cytotonicznych enterotoksyn, termostabilnych (AST) i termolabilnych (ALT) (Figueras and Baez-Hidalgo, 2014), które mogą powodować uszkodzenie cytotoniczne w komórkach Vero; inną możliwością jest to, że szczepy Aeromonas mają więcej niż jeden bakteriofag wstawiony do swojego genomu, ponieważ wykazano, że szczepy STEC z podwójną lizogeną są w stanie regulować bakteriofagi w celu zahamowania zdolności indukcji cyklu litycznego, co powoduje zmniejszenie produkcji Stx, ale bez utraty genu (García-Aljaro et al., 2004; Imamovic i Muniesa, 2011). Dlatego konieczne jest ustalenie, ile bakteriofagów zawierają szczepy Aeromonas, w tym w niniejszym badaniu, aby móc korelować obecność bakteriofagów Stx z ilością wytwarzanego Stx.
z drugiej strony, obecność bakteriofagów Stx w Indukowalnych Aeromonas reprezentuje poziomy mechanizm przenoszenia genu stx, ale nie jest on jedyny. W nowszych badaniach ustalono, że Aeromonas są zdolne do wytwarzania OMV(Guerrero-Mandujano et al., 2015a) i te OMV są zdolne do transportu zintegrowanego DNA (Guerrero-Mandujano et al.,2015b). W niniejszym badaniu wzmocniliśmy Gen stx1 z DNA wyekstrahowanego z OMV jednego szczepu A. hydrophila pochodzenia klinicznego, który wywołał uszkodzenie cytotoksyczne w komórkach Vero, a uszkodzenie to zostało zahamowane za pomocą przeciwciał anty-STX. Oznacza to, że bakteriofag Stx jest mechanizmem transportowym genu stx; ponadto OMV i niedawno nazwany System transportowy typu 0 są zdolne do rozprzestrzeniania genu stx międzygatunkowo lub wewnątrzgatunkowo. Niemniej jednak wymagane jest potwierdzenie, czy Gen zawarty w OMVs jest kompletny. Wyniki uzyskane w tym badaniu potwierdzają hipotezę, że Gen stx jest kolejnym przypuszczalnym czynnikiem zjadliwości Aeromonas, który może być przenoszony przez OMV. Może to stanowić inny mechanizm horyzontalnego transportu genu stx do innych szczepów Aeromonas i / lub innych rodzajów bakterii.
z tego powodu ten rodzaj powinien być włączony jako możliwy czynnik wywołujący zapalenie żołądka i jelit podczas próby identyfikacji czynników przyczynowych i powinien być zgłaszany jako część standardowych procedur nadzoru zdrowotnego.
wkład autora
IP-M I AG-m przeprowadziły eksperymenty, a MR-R przeprowadził analizy bioinformatyczne i sporządził rękopis; CH-c zaprojektował podkład; VB-G i JM-L krytycznie skomentowały i poprawiły rękopis; GC-E pomyślało o badaniu, uczestniczyło w jego projektowaniu i koordynacji, oceniło Dane i sporządziło rękopis. Wszyscy autorzy przeczytali i zatwierdzili ostateczny manuskrypt. Chcielibyśmy podziękować Sofii Marteli Mulia za uprzejme skorygowanie stylu rękopisu.
Funding
GC-E and VB-G received support from zachęty do skuteczności badań and Komisja i zachęcanie do działań akademickich (National Polytechnic Institute) and National Research system (SNI, CONACyT). This study was funded by the research and Graduate Secretariat of National Politechnical Institute (SIP 20160609). The SIP-IPN was not involved in the development of the study design, the collection, analysis, and interpretation of data, in the writing of the report nor in the decision to submit the paper for publication. IP – M I AG-M były stypendystami CONACyT i BEIFI.
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badanie zostało przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
podziękowania
dziękujemy Dr Patricii Arzate Barbosa za dostarczenie izolatów szczepu i dr Armando Navarro za dostarczenie przeciwciał monoklonalnych.
skróty
Ab, przeciwciało; Hus, zespół hemolityczno-mocznicowy; INP, Instituto Nacional de Pediatria Mexico; LD50, średnia dawka śmiertelna; OMVs, Outer membrane vesicles; PCR, Polymerase chain reaction; STEC, Shiga toxin-producing E. coli; Stx, Shiga-like toxin; TTP, Thrombotic thrombocytopenic purpura.
Acheson, D. W., Reidl, J., Zhang, X., Keusch, G. T., Mekalanos, J. J., and Waldor, M. K. (1998). In vivo transduction with shiga toxin 1-encoding phage. Infect. Immun. 66, 4496–4498.
Google Scholar
Alperi, A., and Figueras, M. J. (2010). Ludzkie Izolaty Aeromonas posiadają geny toksyny siei (stx1 i stx2) bardzo podobne do mostkowych zjadliwych wariantów genów Escherichia coli. Kawałek. Mikrobiol. Infect. 16, 1563-1567. doi: 10.1111/j.1469-0691.2010.03203.x
odsyłacz do pełnego tekstu/Google Scholar
Bogdanowicz R., Chobelic M., Markovic M., Nikolic V., Ognianovich M., Saryanovich L. i in. (1991). Zespół hemolityczno-mocznicowy związany z zapaleniem jelit Aeromonas hydrophila. Pediatra. Nefrol. 5, 293-295. doi: 10.1007
CrossRef Full Text/Google Scholar
Castro-Escarpulli, G., Aguilera-Arreola, M. G., Giono-Cherry, S., Hernandez-Rodríguez, C. H., Rodríguez-Chacon, M., Soler, F. L. i in. (2002). Rodzaj Aeromonas > ważny patogen w Meksyku? Enf. Infec. Mikrobus. 22, 206-216.
Google Scholar
Castro-Escarpulli, G., Figueras, M. J., Aguilera-Arreola, M. G., Soler, L., Fernandez-Rendon, E., Aparicio, G. O. i in. (2003). Characterization of Aeromonas spp. wyizolowane z zamrożonych ryb przeznaczonych do spożycia przez ludzi w Meksyku. Int. J. Mikrobiol Spożywczy. 84, 41–49. doi: 10.1016/S0168-1605(02)00393-8
CrossRef Pełny tekst/Google Scholar
Fang, J. S., Chen, J. B., Chen, W. J., and Hsu, K. T. (1999). Zespół hemolityczno-mocznicowy u dorosłego mężczyzny z zapaleniem jelit Aeromonas hydrophila. Nefrol. Wybierz. Przeszczep. 14, 439–440. doi: 10.1093/ndt/14.2.439
CrossRef Full Text/Google Scholar
Figueras, M. J., and Baez-Hidalgo, R. (2014). „Aeromonas,” in Encyclopedia of Food Microbiology, eds C. A. Batt and M. L. Tortorello (Cambridge, MA: Academic Press), 24-30.
Gamage, S. D., Strasser, J. E., Chalk, C. L., and Weiss, A. A. (2003). Nonpathogenic Escherichia coli może przyczynić się do produkcji toksyny shiga. Zarazić. Immun. 71, 3107–3115. doi: 10.1128/IAI.71.6.3107-3115.2003
CrossRef Full Text | Google Scholar
Występowanie genu stx2 w populacjach coli ze środowisk wodnych. Appl. Environ. Mikrobiol. 70, 3535–3540. doi: 10.1128/AEM.70.6.3535-3540.2004
CrossRef Full Text | Google Scholar
Różnorodność genotypowa i fenotypowa wśród indukowanych, przenoszących stx2 bakteriofagów ze środowiskowych szczepów Escherichia coli. Appl. Environ. Mikrobiol. 75, 329–336. doi: 10.1128/AEM.01367-08
CrossRef Full Text/Google Scholar
Giono-wiśnia, S., Rodríguez-Angeles, M. G., Rodríguez-Łańcuchy, M. J., and Valdespino-Gómez, J. L. (1994). Identification of enterotoxins and cytotoxins of Escherichia coli by vero cell culture and solid-phase hybridization (colony blot). Rev. Latynosom. 36, 231-241.
Google Scholar
Guerrero-Manduhano, A., Lopez-Villegas, E. O., Longa-Brisegno, A., and Castro-Escarpulli, G. (2015a). Wytwarzanie pęcherzyków błony zewnętrznej w klinicznym szczepie Aeromonas hydrophila. EC Microbiol. 1, 113–117.
Google Scholar
Guerrero-Mandujano, A., Palma-Martínez, I., and Castro-Escarpulli, G. (2015b). Transport DNA przez zewnętrzne pęcherzyki błonowe Aeromonas hydrophila. EC Microbiol. 2, 354–357.
Google Scholar
Haque, Q. M., Sugiyama, A., Iwade, Y., Midorikawa, Y., and Yamauchi, T. (1996). Izolaty biegunkowe i środowiskowe Aeromonas spp. wytwarzają toksyny podobne do toksyny shiga-like 1. Kerr. Microbiol. 32, 239-245. doi: 10.1007/s002849900043
CrossRef Full Text | Google Scholar
Hernández-Cortez, C., Aguilera-Arreola, M. G. Chavez-Mendes, Y., Arzate-Barbosa, P., Lara-Hernandez, A., and Castro-escarpulli, G. (2011). Identyfikacja genetyczna szczepów Aeromonas spp., wyróżnionych w Narodowym Instytucie Pediatrii.Rev. Enfer. Infecc. 24, 157-165.
Google Scholar
Hernandez-Cortez, S., Mendes-Tenorio, A., Aguilera-Arreola, MG, and Castro-Escarpulli, G. (2013). Projektowanie i standaryzacja czterech multipleksowych reakcji łańcuchowych polimerazy w celu wykrycia bakterii powodujących choroby przewodu pokarmowego. Afr. J. Mikrobiol. Res. 7, 2673-2681. doi: 10.5897/AJMR2013.5452
CrossRef Pełny tekst/Google Scholar
Imamovic, L., and Muniesa, M. (2011). Kwantyfikacja i ocena zakaźności bakteriofagów kodujących toksyny shiga w wołowinie i sałatce. Appl. Environ. Mikrobiol. 77, 3536–3540. doi: 10.1128/AEM.02703-10
CrossRef Full Text | Google Scholar
M., Moore, M. A., Wells, J. G., Wachsmuth, I. K., and O ’ Brien, A. D. (1986). Wytwarzanie toksyn podobnych do shiga przez Escherichia coli. J. Infect. Dis. 154, 338–341. doi: 10.1093/infdis/154.2.338
CrossRef Full Text/Google Scholar
Mauro, S. A., and Koudelka, G. B. (2011). Toksyna Shiga: ekspresja, dystrybucja i jej rola w środowisku. Toksyny 3, 608-625. doi: 10.3390/toxins3060608
CrossRef Full Text/Google Scholar
Monforte-Cirac, M. L., Palacian-Ruiz, M. P., Aisa-Iriarte, M. L., and Spurs-Monge, M. (2010). Zespół hemolityczno-mocznicowy Aeromonas: w przypadku klinicznym.Rev. Clin. Esp. 210, 206-207.doi: 10.1016/j.rce.2009.08.002
CrossRef Full Text | Google Scholar
Robson, W. L. M., Leung, A. K. C., and Trevenen, C. L. (1992). Haemolytic-uraemic syndrome associated with Aeromonas hydrophila enterocolitis. Pediatra. Nefrol. 6, 221-222. doi: 10.1007
CrossRef Full Text / Google Scholar
San Joaquin, V. H., and Pickett, D. A. (1988). Aeromonas-związane z zapaleniem żołądka i jelit u dzieci. Pediatr. Zarazić. Dis. J. 7, 53-57. doi: 10.1097/00006454-198801000-00013
CrossRef Full Text/Google Scholar
Schmidt, H., Bielaszewska, M., and Karch, H. (1999). Transdukcja jelitowych izolatów Escherichia coli pochodną bakteriofagu f3538 kodującego toksynę shiga wyizolowanego z Escherichia coli O157: H7. Appl. Environ. Mikrobiol. 65, 3855–3861.
Google Scholar