choroba przenoszona wektorowo (w szczególności przeniesienie biologiczne, a nie mechaniczne) to taka, w której przeniesienie zakażenia w populacji (populacji gospodarza) następuje tylko przez drugą populację (wektory). Wektorami są zwykle hematofagiczne (krwiożercze) stawonogi, takie jak komary, muchy piaskowe lub kleszcze. Istnieje wiele takich chorób, których dynamika cieszy się dużym zainteresowaniem z punktu widzenia kontrolowania infekcji. Malaria, leiszmanioza, denga i wirus Zachodniego Nilu to tylko niektóre z nich, które mają obecnie ogromny wpływ społeczny na populacje ludzkie.
każdego roku w regionie 225 milionów ludzi jest zarażonych pasożytem malarii, a w 2009 roku Około 781 000 z nich spowodowało śmiertelność wywołaną chorobą. Historia jest podobna do leiszmaniozy, gdzie na całym świecie jest około 12 milionów ludzi, którzy są uważani za zakażonych w danym momencie, a około 80 000 osób umiera rocznie z powodu najpoważniejszej formy, leiszmaniozy trzewnej. Takie choroby są powszechne w krajach rozwijających się; połączenie optymalnego siedliska dla wektorów w regionach tropikalnych i brak pomocy medycznej prowadzi tam do szeroko zakrojonych endemitów.
choroby ludzkie nie są jedynym problemem; jest wiele innych, które infekują inne klasy żywicieli, które również są interesujące, szczególnie z punktu widzenia ochrony zagrożonych gatunków.
typowy przebieg zakażenia przenoszonego przez wektor, ignorując chorobę, żywiciela lub specyfikę wektora, rozpoczyna się od zakażonego wektora (karmiącego lub ssącego dorosłego stawonoga) pobierającego krew od wrażliwego członka populacji gospodarza. Po ugryzieniu gospodarz ma szansę zarazić się chorobą. Na tym etapie, w przypadku zakażenia, gospodarz jest uważany za narażonego, ale suers nie niekorzystne eects z infekcji i nie może przenosić choroby. Czas po zakażeniu, ale przed zakażeniem jest znany jako okres latencji. Gdy pasożyt osiągnie pewien etap w swoim cyklu rozrodczym, gospodarz staje się zakaźny, po czym, jeśli zostanie ugryziony, może przenieść chorobę do podatnego wektora przez jego zainfekowaną krwią pasożyta i zakończyć cykl transmisji (pokazany na rysunku poniżej).
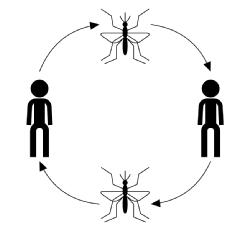
transmisja choroby zwykle charakteryzuje się:
- obfitość i rozprzestrzenienie przestrzenne zarówno gospodarzy, jak i wektorów
- Demografia
- szybkość karmienia lub chęć ugryzienia wektora
- sukces lub porażka transmisji
typowo matematyczne modele chorób przenoszonych wektorami opierają się na modelu si(r) o dwóch populacjach, wykazującym warunki zakażenia „criss-cross”, gdzie I
są siłą infekcji pojęć odpowiednio dla hostów i wektorów:
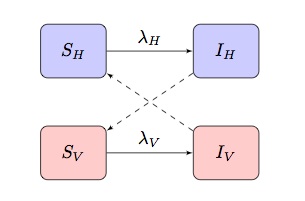
w zależności od choroby i populacji, która jest modelowana, może to być dostosowane do włączenia innych, bardziej specyficznych cech.
Modelowanie dynamiki chorób przenoszonych przez wektory
istnieje wiele różnych typów modeli matematycznych dla przenoszenia chorób przenoszonych przez wektory; najlepiej, aby były one utrzymywane matematycznie tractable i tak proste, jak to możliwe, zachowując ogólną dynamikę systemu biologicznego. Nie dziwi fakt, że modele z zakresu literatury znacznie; od deterministycznych po stochastyczne, endemiczne (w tym wskaźniki urodzeń i zgonów) lub epidemiczne (ognisko o ograniczonym czasie trwania), obejmujące rozprzestrzenianie się przestrzenne, heterogeniczność przestrzenną, okresy opóźnienia, strukturę wiekową, nabycie i utratę odporności, wiele szczepów i wiele innych. Nawet biorąc pod uwagę tylko jedną konkretną chorobę, różnice w chorobie w różnych populacjach mogą prowadzić do zmian nie tylko w parametryzacji, ale także w sposobie, w jaki można chcieć zastosować podejście modelujące.
niektóre prace Kat skupiają się na uproszczeniach, które często są dokonywane w celu zmniejszenia złożoności modeli. Praca ta rozważa skutki stosowania modeli transmisji „tylko dla gospodarza”, takich jak quasi-równowaga założenia na dynamikę choroby, a także wpływ pominięcia okresu latencji na przewidywania epidemii.
leiszmanioza
do uzupełnienia przez Erin
ludzka Afrykańska Trypanosomioza (HAT)
ludzka Afrykańska trypanosomioza (HAT), bardziej potocznie znana jako śpiączka, jest śmiertelną chorobą, która występuje endemicznie na wielu obszarach Afryki Subsaharyjskiej. 70 milionów ludzi żyje na obszarach zagrożonych, obejmujących ponad półtora miliona kilometrów kwadratowych. Chociaż częstość występowania HAT nie jest tak wysoka, jak w przypadku innych chorób przenoszonych przez wektory, takich jak malaria lub denga (odnotowano nieco ponad 7000 przypadków HAT, ale szacowano 207 milionów przypadków malarii w 2012 r.), brak profilaktyki chemicznej, niezwykle nieprzyjemne (i często śmiertelne) leczenie i brak znaczących badań naukowych umieścił HAT na liście zaniedbanych chorób tropikalnych WHO.
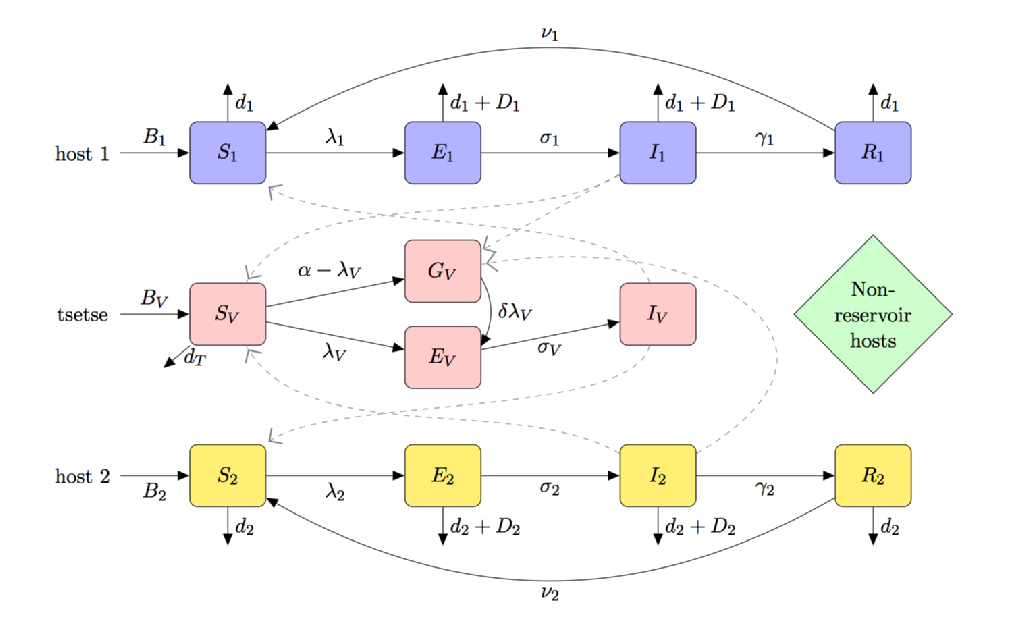
wektorem HAT jest Tse; jego potrzeba pobierania krwi w celu zapobiegania głodowi i unikalna interakcja wektor-pasożyt (powodująca „teneralne zjawisko podatności”) oznaczają, że modelowanie kapelusza jest wyraźnie inne niż inne choroby przenoszone przez wektory, takie jak malaria.
poniższy rysunek jest karykaturą modelu kapelusza, która zawiera:
- (częściowa) podatność na muchy teneralne
- wiele gatunków żywicieli (w tym żywicieli zbiornikowych i niebędących rezerwuarami)
- preferencje żywieniowe tsetse
- głód nieuszkodzonego tsetse
choroba niebieskiego języka (BTV)
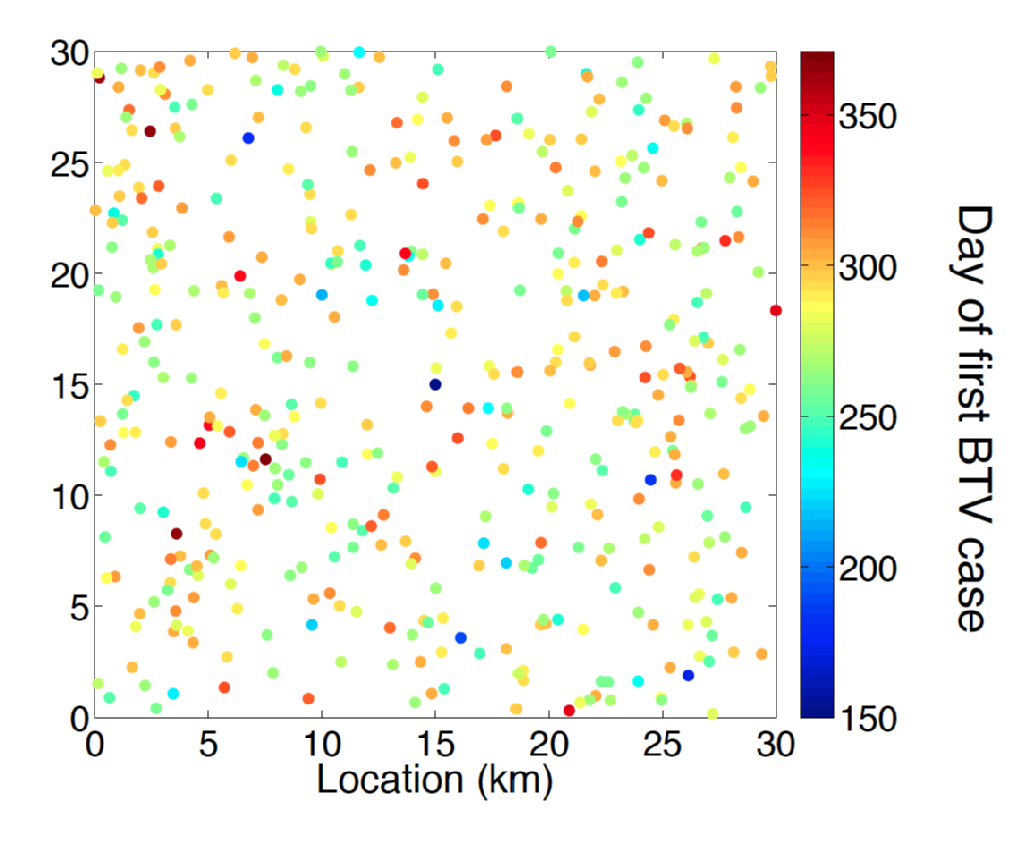
choroba niebieskiego języka jest choroba wirusowa (BTV) przeżuwaczy przenoszona przez różne gatunki gryzących Midge z rodzaju culicoides. Objawy dla zwierząt chorych na BTV obejmowały dyskomfort, wysoką gorączkę i sinicę języka, co daje nazwę chorobie. Wśród owiec choroba BTV ma wysoką śmiertelność. Do końca lat 90. XX wieku Europejski zasięg BTV był w całości związany z Zasięgiem midge vector C. Imicola. Pod koniec lat 90. i na początku XX wieku nastąpiła bezprecedensowa wcześniej ekspansja BTV na obszary Europy, które należą do zasięgu innych gatunków midge, takich jak Kompleks C. Obsoletus i blisko spokrewnione gatunki midge. W szczególności ognisko wywołane w Niderlandach w 2006 r.jest pierwszym odnotowanym przykładem wtargnięcia BTV do 50 stopni szerokości geograficznej północnej. W kolejnych latach odkryto przypadki BTV w Europie Północnej, w tym w Belgii, Niemczech, Wielkiej Brytanii i Danii, wykazując zdolność choroby niebieskiego języka do zimą w środowisku Północnoeuropejskim. Zagadkową cechą serologii północnoeuropejskiej choroby niebieskiego języka jest to, że choroba została wywołana przez odrębny szczep (BTV-8) od osób odpowiedzialnych za wtargnięcie do południowej Europy, tj. Hiszpanii (BTV-4) i Włoch (BTV-2).
Przewidywanie wpływu wtargnięcia BTV i najlepszego projektowania zarządzania zwierzętami gospodarskimi i zwalczania chorób wymaga najnowocześniejszej metodologii modelowania. Wiele jest zrozumiałych na temat epidemiologii BTV, takich jak solidne zrozumienie przewidywanego okresu wiremii u gospodarzy bydła i owiec oraz wpływu temperatury klimatycznej na okres inkubacji choroby niebieskiego języka w obrębie wektora pośredniego. Jednak oszacowanie ryzyka przestrzenno-czasowego stwarzanego przez rozproszenie wektorów od zakażonych zwierząt gospodarzy pozostaje istotnym wyzwaniem. Problem wnioskowania jest tutaj wieloczynnikowy, wymagający nie tylko wnioskowania parametrów, ale także statystycznie zasadniczego wyboru modelu.
Malaria
Malaria podąża za ogólnym cyklem transmisji, jak opisano powyżej; wektorem jest samica komara, która przyjmuje swoją mączkę z krwi jako część procesu reprodukcyjnego; samce tego gatunku są nektascynowe i jako takie nie odgrywają żadnej roli w cyklu transmisji. Częstotliwość karmienia jest określona przez tę potrzebę biologiczną, a więc średnia szybkość karmienia wynosi zwykle około raz na cztery dni i zwykle zakłada się, że nasycenie jednej partii jaj osiąga się w tym jednym posiłku. Istnieje wiele różnych rodzajów malarii, niektóre dotykają ludzi (może to być spowodowane przez jeden z czterech różnych rodzajów Plasmodium), a inne dotykają zwierzęta. Rodzaj Anopheles jest odpowiedzialny za przenoszenie się na ludzi, z których około 30 Z 400 gatunków głównie powoduje rozprzestrzenianie się infekcji.
kluczową cechą wpływającą na malarię jest temperatura; nawet jeśli komar zamieszkuje w danym obszarze, zewnętrzne temperatury poniżej około 16C (dokładny umiarkowany jest zależny od gatunku pasożyta), nie jest wystarczająco ciepły, aby umożliwić rozwój. Ogólnie rzecz biorąc, wraz ze wzrostem temperatury z 16C, tym krótszy jest okres inkubacji z nagłym zatrzymaniem powyżej około 32C, ponieważ pasożyt nie jest w stanie przetrwać powyżej tej temperatury.
Malaria ptaków i Miodojad hawajski
niektóre systemy mogą być jednak znacznie bardziej złożone niż ogólny przykład podany wcześniej. Jednym z takich przykładów jest hawajski Miodojad (Drepanididae); cierpi on nie tylko na niekorzystny wpływ ptasiej malarii (Plasmodium relictum), która jest przenoszona przez komara (Culex quinquefasciatus), ale także na zmiany klimatu i drapieżnictwo. Wzajemne oddziaływanie tych dominujących czynników jest duże, z temperaturami i obfitością drapieżników wpływających na przebieg choroby i zdolność ptaków (lub niezdolność) do oparcia się wyginięciu. Ponadto niektóre gatunki miodojadów wykazują zdolność do nadawania odporności na malarię, nie odczuwając szkodliwych skutków choroby, pozostając jednocześnie zakaźnymi (są one powszechnie określane jako nosiciele i nieumyślnie powodują rezerwuar infekcji, przeżywając normalną średnią długość życia „wolną od choroby”, ale nadal rozprzestrzeniając infekcję.
praca została opublikowana jako:
K. S. Rock et al. „Modeling the Future of the Hawaiian Honeycreeper: an Ecological and Epidemiological Problem”. Modelowanie ekologiczne (czerwiec 2012)