koncepcja otwartej Walencji („Walencja”)
Walencja (lub Walencja) elementu jest miarą jego łączenia mocy z innymi atomami, gdy tworzy związki chemiczne lub cząsteczki. Koncepcja Walencji została opracowana w ostatniej połowie XIX wieku i z powodzeniem wyjaśniła strukturę molekularną wielu związków organicznych. Poszukiwanie przyczyn leżących u podstaw Walencji prowadzi do współczesnych teorii wiązania chemicznego, w tym struktur Lewisa (1916), teorii wiązania walencyjnego (1927), orbitali molekularnych (1928), teorii odpychania par elektronowych powłoki walencyjnej (1958) i wszystkich zaawansowanych metod chemii kwantowej.
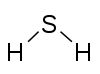
moc łączenia lub powinowactwo atomu pierwiastka było określone przez liczbę atomów wodoru, z którymi się łączył. W metanie węgiel ma wartość 4; w amoniaku azot ma wartość 3; w wodzie tlen ma wartość 2; w chlorowodorze chlor ma wartość 1. Chlor, ponieważ ma wartość jednego, może być zastąpiony Wodorem, więc fosfor ma wartość 5 w pentachlorku fosforu, PCl5. Diagramy walencyjne związku reprezentują łączność elementów, linie między dwoma elementami, czasami nazywane wiązaniami, reprezentują nasyconą walencyjność dla każdego elementu. Przykładami są:-
| Compound | H2 | CH4 | C3H8 | C2H2 | NH3 | NaCN | H2S | H2SO4 | Cl2O7 |
| Diagram |  |
 |
 |
 |
 |
 |
|||
| Valencies | Hydrogen 1 | Carbon 4 Hydrogen 1 |
Carbon 4 Hydrogen 1 |
Carbon 4 Hydrogen 1 |
Nitrogen 3 Hydrogen 1 |
Sodium 1 Carbon 4 Nitrogen 3 |
Sulfur 2 Hydrogen 1 |
Sulfur 6 Oxygen 2 Hydrogen 1 |
Chlorine 7 Oxygen 2 |
Walencja opisuje tylko łączność, nie opisuje geometrii związków molekularnych ani tego, co obecnie znane jest jako związki jonowe lub gigantyczne struktury kowalencyjne. Linia między atomami nie reprezentuje pary elektronów, jak to robi na diagramach Lewisa.
Further Reading
Khan Academy
Valence Electrons
Cliffs Notes
Valence Electrons
Contributors
- Wikipedia