Bestemme visse parametere som størrelse, lengde og vinkel i atomic skala er ikke lett. På grunn av det viktige av disse parametrene har forskere utviklet metoder for å utlede eller beregne parametrene i atomnivå. Bindingsordre og bindingslengde er to slike viktige parametere som indikerer typen og styrken av bindinger mellom et par atomer.
denne artikkelen forklarer,
1. Hva Er Obligasjonsordre og Obligasjonslengde
2. Hvordan Beregne Bond Ordre og Bond Lengde
– Hvordan Beregne Bond Ordre
– Hvordan Beregne Bond Lengde
Hva Er Bond Ordre og Bond Lengde
Bond lengde og bond ordre er to parametere som er forbundet med kovalente obligasjoner. Bindingsordre er antall kjemiske bindinger mellom to atomer og bindingslengden er avstanden mellom to atomkjerner som er kovalent bundet sammen. Denne artikkelen forklarer hvordan du beregner bindingsordre og bindingslengde i et atomnivå.
Hvordan Beregne Bond Order
Bond order er antall kjemiske bindinger mellom to atomer. Det indikerer stabiliteten til et bånd. I kovalente bindinger er bindingsordren antall delte elektroner. For eksempel er bindingsorden av et par atomer bundet av en enkeltbinding en, mens bindingsorden av et par atomer bundet av en dobbeltbinding er to. Nullbindingsordre indikerer at det ikke er noen binding mellom atomer. Stabiliteten til et molekyl øker med økende bindingsordre. Molekylene med resonansbinding trenger ikke å være et heltall. I kovalente forbindelser med to atomer bestemmes bindingsordren mellom et par atomer ved først å tegne Lewis-strukturen, og deretter bestemme typen bindinger mellom atomene-nullbinding, enkelt -, dobbelt-eller trippelbinding. For eksempel bestemmes bindingsordren av hydrogengass som følger.
- Tegn Lewis-strukturen
H: H
- Bestem antall bindinger /par valenselektroner
Ett par elektroner, derfor er bindingsordren 1.
hvis det er mer enn to atomer, bestemmes bindingsordren som følger. Se eksempel: nitrat ion.
- Tegn Lewis-strukturen
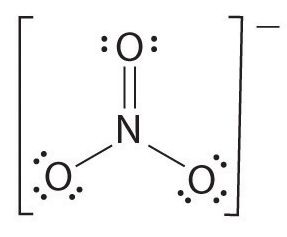
- Telle totalt antall bindinger (i henhold til nitrat ion, dets 4)
- tallet av bindingsgrupper mellom individuelle atomer (i henhold til ammoniakk, dens 3)
- derfor er bindingsordren = totalt antall bindinger/ antall bindingsgrupper
= 4/3
= 1,33
derfor er bindingsordren av nitration 1.33
Hvordan Beregne Bond Lengde
Bond lengde er avstanden mellom to kjerner av atomer som er kovalent bundet sammen. Bond lengde er vanligvis i området fra 0,1 til 0,2 nm. Når to like atomer er bundet sammen, blir halvparten av bindingslengden referert til som kovalent radius. Bindingslengden avhenger av antall bundet elektroner av to atomer eller bindingsordren. Høyere bindingsordren, kortere bindingslengden vil skyldes sterke trekkstyrker av positivt ladede kjerner. Enheten for bindingslengde er picometer. I enkelt -, dobbelt-og trippelbindinger øker bindingslengden i størrelsesorden
trippelbinding<dobbeltbinding <enkeltbinding
Elektronegativitet kan brukes til å beregne bindingslengde mellom to atomer som har forskjellige elektronegativiteter. Følgende empiriske formel ble foreslått Av Shoemaker Og Stevenson å beregne bond lengde.
dA – b = rA + rB-0.09 (xA – xB)
dA-B er bindingsavstand Mellom to atomer A Og B, rA og rB er kovalente radier Av A og B, og
(xA – xB) er elektronegativitetsforskjell Mellom A og B.
En annen metode brukes til å beregne omtrentlig bindingslengde. I denne metoden trekkes Den Første Lewis-strukturen for å bestemme kovalent bindingstype. Deretter bruker du et diagram * laget på studier Utført Av Cordero et al., Og Pyykkö og Atsumi, bestemmes de tilsvarende radiene av bindingene som er laget av hvert atom. Deretter bestemmes bindingslengden ved å ta summen av de to radiene. For eksempel, når man bestemmer bindingslengden av karbondioksid, trekkes Første Lewis-struktur.
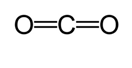
Ifølge diagrammet er kovalent radius av karbon dobbeltbinding 67 pikometer og oksygen dobbeltbinding er 57 pikometer. Derfor er bindingslengden av karbondioksid omtrent 124 pikometer (57 pm+ 67 pm).
*Kovalent diagram er funnet her
Referanse:
Cordero, Beatriz, et al. «Kovalent radii revisited.»Dalton Transaksjoner 21 (2008): 2832-2838 .
Libretexts. «Bond Orden Og Lengder.»Kjemi LibreTexts. Libretexts, 05 Des. 2016. Web. 10 Jan. 2017.Lister, Ted og Janet Renshaw. Forstå Kjemi For Avansert Nivå. N. p.: Nelson Thornes, 2000. Skrive.
Pratiyogita Darpan. «Egenskaper Av Elementer I Forhold til Deres Elektroniske Struktur .»Konkurranse Vitenskap Visjon August. 1998: n. pag. Skrive.
Pyykk, Pekka og Michiko Atsumi. «Molekylære Dobbeltbindings Kovalente Radier For Elementer Li-E112.»Kjemi-Et Europeisk Tidsskrift 15.46 (2009): 12770-12779 .
![]()