hvor mye energi frigjøres I ATP hydrolyse?
Lesermodus
ATP blir ofte referert til som cellens energivaluta. Hundrevis av reaksjoner i cellen fra metabolske transformasjoner til signalhendelser er koblet til hydrolysen (bokstavelig talt betyr «vannløsning») AV ATP med vann . REAKSJONEN ATP + H2O<> ADP + Pi forvandler adenosintrifosfat (ATP) til adenosindifosfat (ADP) og uorganisk fosfat (Pi). Den frie energiendringen forbundet med denne reaksjonen driver en stor brøkdel av cellulære reaksjoner med membranpotensialet og reduserende kraft er de to andre dominerende energikildene. Men nøyaktig hvor mye er denne energivalutaen verdt, og hva avslører den om de kjemiske transaksjonene som kan kjøpes? Selvfølgelig er det ingen svar på dette spørsmålet siden mengden energi frigjort av denne hydrolysereaksjonen avhenger av de intracellulære forholdene, men det er mulig å få en følelse for den omtrentlige «verdien» av denne valutaen ved å benytte seg av noen enkle estimater.

Gibbs fri energiendring (Δ) på GRUNN AV ATP-hydrolyse avhenger av konsentrasjonene av de ulike deltakerne i reaksjonen som vist i Figur 1. Når konsentrasjonene er lengre fra likevektsverdiene, er absoluttverdien av Δ større. Under» standard » betingelser (dvs. konsentrasjoner PÅ 1M for alle reaktanter unntatt vann som tas ved sin karakteristiske konsentrasjon PÅ 55M) Varierer Gibbs fri energi AV ATP-hydrolyse fra -28 til -34 kJ/mol (dvs. ≈12 kBT, BNID 101989) avhengig av konsentrasjonen av kation Mg2+. Avhengigheten Av Mg-ioner oppstår fordi de positivt ladede magnesiumioner bidrar til å stabilisere ATP-molekylet. Men i cellen er forholdene aldri engang nær standardstatverdiene. For eksempel vil en konsentrasjon PÅ 1M ATP bety at massen av løsemiddel ville være lik den for selve vannløsningsmidlet. I figur 1 viser vi den ofte forvirrende avledningen av fysiologisk fri energi (Δ) gitt forholdet mellom konsentrasjoner fra standardverdien (Δ). Divisjonen etter vilkår som kreves for å ta vare på enheter som en logaritme, bør alltid inneholde en unitless term. Det er noen ganger overraskende å tenke at hvis cellen var i likevekt, ville verdien av Δ ha vært null, og det ville ikke være energi å få VED ATP hydrolyse. Heldigvis er dette aldri tilfelle i levende organismer. .
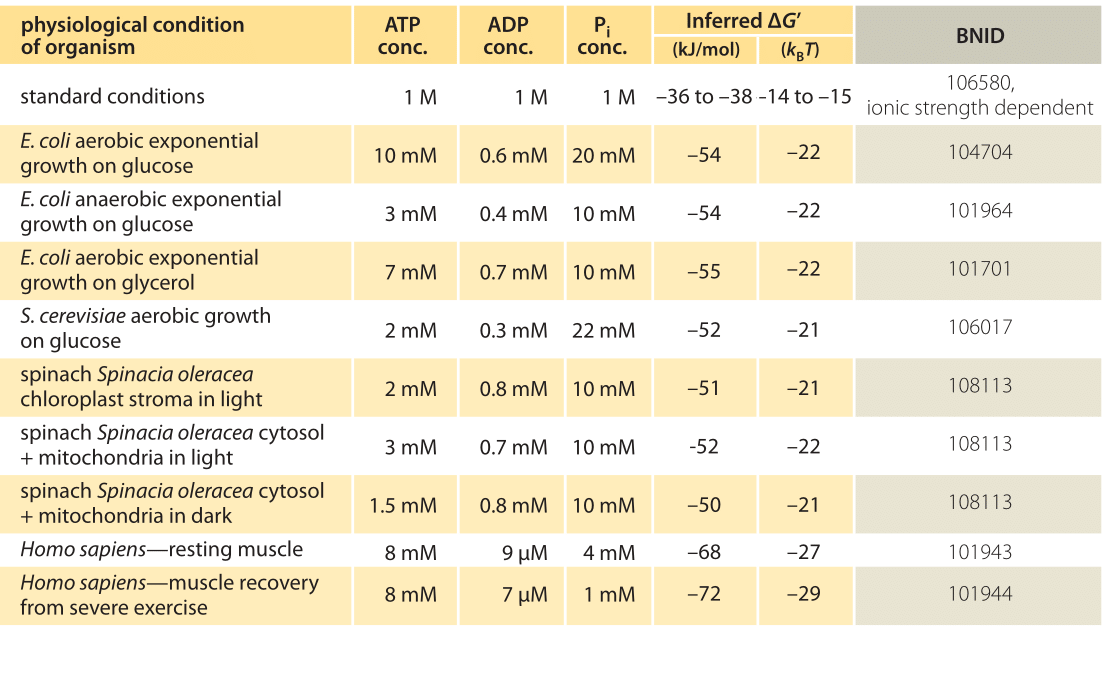
beregningene av Δ krever en nøyaktig måling av relevante intracellulære konsentrasjoner. Slike konsentrasjoner måles in vivo hos mennesker ved bruk av kjernemagnetisk resonans. Den naturlige formen av fosfor (31P) har magnetiske egenskaper, så det er ikke nødvendig å legge til noen ekstern substans. Vevet av interesse som muskel er plassert i et sterkt magnetfelt, og skift i frekvens av radiopulser brukes til å utlede konsentrasjon AV ATP og Pi direkte fra toppene i NMR-spektrene. I E. coli, konsentrasjonene AV ATP kan måles mer direkte med EN ATP bioluminescensanalyse. En prøve av voksende bakterier fjernet fra kulturen kan analyseres ved hjelp av luciferase, et protein fra bakterier som lever i symbiose med squids, men det har nå blitt med i verktøykassen til biologer som molekylær reporter. Luciferase-enzymet bruker ATP i en reaksjon som produserer lys som kan måles ved hjelp av et luminometer, OG ATP-konsentrasjonen kan utledes fra signalstyrken. Så vi har celleinnhold som inngang, luciferase som en «enhet» som forvandler MENGDEN ATP til lysutslipp som tjener som målt utgang. Ved hjelp av verktøy som disse finner MAN AT ATP i» real life » er verdt omtrent dobbelt så mye som under «standard» forhold på grunn av at konsentrasjonene er gunstigere for fremoverreaksjonen.Vi avslutter med å merke Oss at det er et stående spørsmål om hvorfor adeninnukleotid ble utpekt til å tjene som hovedenergivaluta MED GTP og de andre nukleotidene som tjener mye mer mindre roller. Er det et tilfelle av tilfeldig valg som senere ble «frosset ulykke» eller var DET en selektiv fordel FOR ATP over GTP, CTP, UTP og TTP?




