Hvis du noen gang har studert et periodisk bord av elementene (se nedenfor), er du sannsynligvis allerede klar over at denne tabellen avslører mye om de kjemiske egenskapene til atomene som utgjør vår verden.Men du kan ikke innse at hver firkant på det periodiske bordet faktisk representerer en familie av isotoper-atomer som deler samme navn og kjemiske egenskaper, men har forskjellige masser.
For å forstå hva isotoper er og hvordan vi kan bruke dem, må vi se nærmere på det indre av et atom.

Byggeklosser av materie
et atom består av en utrolig tett kjerne (kalt en kjerne) av protoner og nøytroner, omgitt av en diffus sky av elektroner.Du kan tenke på protoner og nøytroner som samme type partikkel med en viktig forskjell: protonene er positivt ladet, mens nøytroner bærer ingen ladning. Dette betyr at protoner kan «føle» elektriske eller magnetiske felt, mens nøytroner ikke kan.elektronene, som er mye lettere enn protoner eller nøytroner, bærer samme ladningsstørrelse som et proton, men med motsatt tegn, noe som betyr at hvert atom som har like mange protoner og elektroner er elektrisk nøytral.
det er elektronene som bestemmer kjemisk oppførsel av et bestemt element.

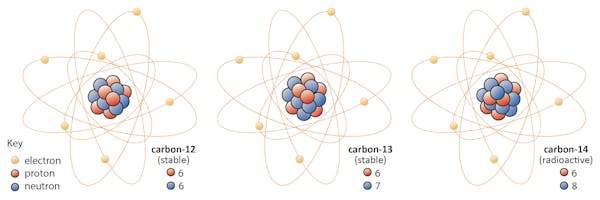
Isotoper av et element deler samme antall protoner, men har forskjellige antall nøytroner. La oss bruke karbon som et eksempel.det finnes tre isotoper av karbon i naturen-karbon-12, karbon-13 og karbon-14. Alle tre har seks protoner, men deres nøytronnummer-henholdsvis 6, 7 og 8-er alle forskjellige. Dette betyr at alle tre isotoper har forskjellige atommasser (karbon-14 er den tyngste), men deler samme atomnummer (Z=6).
Kjemisk er Alle tre uutslettelige, Fordi antall elektroner i hver av disse tre isotoper er det samme.
så forskjellige isotoper av samme grunnstoff er identiske, kjemisk sett. Men noen isotoper har evnen til å omgå denne regelen ved å transformere til et annet element helt.
Marsjerer mot stabilitet
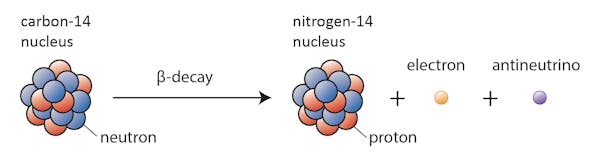
denne transformative evnen noen isotoper har har å gjøre med det faktum At Ikke alle isotoper er stabile, og er det som førte Frederick Soddy til Sin Nobelprisvinnende oppdagelse av isotoper i 1913.noen isotoper-som karbon – 12-vil gjerne fortsette å eksistere som karbon med mindre noe ekstraordinært skjer. Andre-karbon-14, si-vil på et tidspunkt forfalle til en stabil isotop i nærheten.
i dette tilfellet endres en av nøytronene i karbon-14 til en proton som danner nitrogen-14. Under denne prosessen, som er kjent som beta forfall, avgir kjernen stråling i form av et elektron og en antineutrino.
det er mange faktorer som kan føre til at en kjerne forfaller. En av de viktigste er forholdet mellom protoner og nøytroner en bestemt kjerne har. Hvis en kjerne har for mange nøytroner (definisjonen av «for mange» avhenger av hvor tung kjernen er), er det en sjanse for at den vil forfalle mot stabilitet.
det samme gjelder hvis en kjerne har for mange protoner. Dette er en av grunnene til at noen isotoper av et gitt element er radioaktive, mens andre ikke er.
fra stjernens bellies
nå lurer du kanskje på hvordan alle disse isotoper ble opprettet i utgangspunktet. Som det viser seg, er dette spørsmålet et komplekst, men gir noen sannhet til ordtaket om at vi alle er laget av stjernestøv.noen av de lettere isotopene ble dannet veldig tidlig i universets historie, under Big Bang. Andre skyldes prosesser som skjer i stjerner eller som følge av tilfeldige kollisjoner mellom svært energiske kjerner – kjent som kosmiske stråler – i atmosfæren vår.de fleste naturlig eksisterende isotoper er det endelige (stabile eller langlivede) produktet som følge av en lang rekke kjernereaksjoner og henfall.i de fleste av disse tilfellene har lyskjerner måtte knuse sammen med nok energi til å tillate den sterke kraften – en limlignende binding som dannes når protoner og nøytroner kommer nær nok til å berøre – for å overvinne den elektromagnetiske kraften – som skyver protoner fra hverandre. Hvis den sterke kraften vinner ut, binder de kolliderende kjernene sammen, eller smelter, for å danne en tyngre kjerne.
vår sol er et godt eksempel på dette. En av hovedkildene til kraft er en rekke fusjonsreaksjoner og beta-forfallsprosesser som forvandler hydrogen til helium.

Transformere kunnskap til verktøy
siden tidlig på 1900-tallet, da eksistensen av isotoper først ble realisert, har kjernefysikere og kjemikere søkt etter måter å studere hvordan isotoper kan dannes, hvordan de forfaller, og hvordan vi kan bruke dem.som det viser seg, natur isotoper – deres kjemiske ensartethet, deres kjernefysiske særpreg – gjør dem nyttige for et bredt spekter av applikasjoner i felt så forskjellige som medisin, arkeologi, landbruk, kraftproduksjon og gruvedrift.hvis DU noen GANG har hatt EN PET-skanning, har du hatt nytte av et biprodukt av radioaktiv nedbrytning av visse isotoper (ofte kalt medisinske isotoper). Vi produserer disse medisinske isotoper ved hjelp av vår kunnskap om hvordan kjernereaksjoner fortsetter, ved hjelp av atomreaktorer eller akseleratorer kalt syklotroner.
men vi har også funnet måter å gjøre bruk av naturlig forekommende radioaktive isotoper. Karbondatering, for eksempel, gjør bruk av den langlivede isotopen carbon-14 for å bestemme hvor gamle objekter er. under normale omstendigheter produseres karbon-14 i atmosfæren via kosmiske strålereaksjoner med nitrogen-14. Den har en halveringstid på omtrent 5700 år, noe som betyr at halvparten av en mengde karbon-14 vil ha forfallet i den tidsperioden.

Mens en biologisk organisme er i live, tar det inn omtrent en karbon-14 isotop for hver billion stabile karbon-12 isotoper og karbon – 12 til karbon-14 forholdet forblir omtrent det samme mens organismen lever. Når det dør, stopper nytt inntak av karbon.
dette betyr forholdet mellom karbon-14 og karbon-12 endringer i resterne av denne organismen over tid.hvis vi trekker ut karbon ved hjelp av kjemiske metoder fra en prøve, kan vi da bruke en metode som kalles akselerator massespektrometri (AMS) for å skille ut de enkelte karbonisotoper etter vekt.
AMS gjør bruk av det faktum at akselererte partikler med samme ladning, men forskjellige masser følger separate baner gjennom magnetfelt. Ved å gjøre bruk av disse separate baner, vi kan bestemme isotopforhold med utrolig nøyaktighet.
som du kan se fra disse eksemplene, bruker vi vår kunnskap om isotoper på en rekke måter. Vi produserer dem, oppdager dem, trekker dem ut og studerer dem med det dobbelte formål å forstå hvorfor atomkjernen oppfører seg som den gjør, og hvordan vi kan utnytte sin kraft til vår fordel.