Muskelplastisitet
Skjelettmuskulatur er det største vevet i kroppen. Det er svært plast og kan gjennomgå dramatiske ikke-patologiske svingninger i både masse og styrke som svar på et mylder av miljøpåvirkninger. Etter motstandsøvelse eller eksponering for anabole steroider, gjennomgår muskler hypertrofi og øker masse, tverrsnittsareal og styrke (Aagaard, 2004; Schiaffino et al., 2013). Disse samme parametrene kan avta precipitously når musklene initiere atrofi som svar på noen av omfanget av fornærmelser som inkluderer: sult, denervering, immobilisering, sepsis, kreft kakeksi, hjertesvikt, diabetes, nyresvikt, kronisk obstruktiv lungesykdom, og ervervet immunsvikt syndrom (Schiaffino et al ., 2013).
konsekvensene av atrofi har åpenbare implikasjoner for helse. Muskelsvakhet er en viktig bidragsyter til både dødelighet og sykelighet og er forbundet med økt risiko for alle dødsårsaker (Metter et al., 2002). Faktisk redusere muskelatrofi i kreft kakeksi kan betydelig forlenge livet (Zhou et al., 2010). I tillegg lider mange eldre personer av sarkopeni, en langvarig muskelsvinn lidelse som vanligvis begynner etter 50 år og innebærer et tap på ca 1% av muskelmassen per år (Woo, 2017). Dette betyr at i en alder av 80 år har sarkopeniske individer mistet omtrent 40% av muskelmassen, en nøkkelfaktor i fall, svakhet og sykehjemsopptak. Følgelig er forståelse av mekanismene og potensielle terapeutiske responser på atrofi av bred grunnleggende og klinisk interesse (Ali Og Garcia, 2014; Cohen et al., 2015; Jørgen et al., 2017).
Myonukleær Domenehypotese
Skjelettmuskulatur er ganske unik ved at de modne cellene er syncytiale og kan inneholde hundrevis av kjerner. Dette er en nødvendig tilpasning gitt at individuelle muskelfibre kan være enorme, og oppnå lengder på opptil ~600 mm (23 in) (f.eks., 1998) og volumer som kan være mer enn 100.000 ganger større enn en typisk mononukleert celle (Bruusgaard et al., 2003). Bidragene fra flere kjerner kreves for å produsere store mengder mRNA som trengs for å lede den utrolige proteinsyntesen som kreves for å generere og opprettholde kontraktilapparatet (Nevalainen et al., 2013).både muskelens plastiske natur og dens syncytiale organisasjon har gitt opphav til en kontrovers som bare nylig ser ut til å ha blitt løst—»myonukleære domenehypotesen» (Qaisar Og Larsson, 2014; Gundersen, 2016; Schwartz et al., 2016). Denne teorien har sin opprinnelse i begrepet «Wirkungssphä» eller «innflytelsessfære» foreslått Av Strassburger (1893), der han hevdet at en kjerne bare kan støtte et diskret volum cytoplasma, og dermed definere øvre grenser for cellestørrelse. Dette prinsippet ble utdypet videre Av Gregory (2001) som hevdet at cellulær deoksyribonukleinsyreinnhold og volum er tett koblet. Syncytial natur skjelettmuskel hjelper disse cellene overvinne denne begrensningen. Den myonukleære domenehypotesen dikterer at for å opprettholde riktig atom-til-cytoplasmisk forhold, blir nye kjerner tilsatt under hypertrofi og tapt med atrofi.Det er betydelige data som viser at nukleært tall øker med muskelhypertrofi (Moss, 1968; Cabric og James, 1983; Egner et al., 2016), selv om noen kontroverser forblir (Murach et al., 2018). Denne prosessen har vært et område med intens undersøkelse, og noen av de underliggende molekylære mekanismene som regulerer oppkjøpet av nye kjerner under hypertrofi, er nylig definert (Guerci et al., 2012; Bentzinger et al., 2014; Ros et al., 2018). Disse supernumerære kjernene oppnås når stamceller, vanligvis satellittceller, smelter sammen med muskelfibre og bidrar med kjernene (Brack og Rando, 2012; Bachman et al., 2018). Satellittceller ligger under kjellermembranen og støter mot sarcolemma (Katz, 1961; Mauro, 1961). De forblir hvilende til stimulert av enten anabole steroider som testosteron eller ved fokal skade etter motstandsøvelse, på hvilket tidspunkt de gjenopptar cellesyklusen og sprer seg (Joubert Og Tobin, 1995; Abreu et al., 2017). Noen av dattercellene smelter sammen med muskelfiberen og letter både reparasjon og vekst, mens andre arresterer og rekonstituerer satellittbassenget (Dumont et al.(2015; Goh Og Millay, 2017). De resterende overskuddscellene gjennomgår apoptose(Schwartz, 2008).det kontroversielle aspektet av myonukleære domenehypotesen er påstanden om at myonuklei går tapt under atrofi. Det er mange tiltak som induserer atrofi i dyremodeller, inkludert: immobilisering, denervering og sepsis (Fitts et al., 1986; Minnaard et al., 2005; O ‘ Leary et al., 2012). I hvert tilfelle er det et netto tap av både muskeltverrsnittområde (primæranalysen) og utseendet av apoptotiske celler i vevet (McCall et al., 1998; Smith et al., 2000; Strasser et al., 2000; Alway et al., 2003; McClung et al., 2007; Andrianjafiniony et al., 2010; Guo et al., 2012; Palumbo et al., 2012; Barnes et al., 2015; Jørgen et al., 2015; Li et al., 2016; Kletzien et al., 2018). I disse studiene måles apoptose i en rekke metoder, inkludert caspase-aktivering, mitokondriell Endogfrigivelse eller DNA-fragmentering . Disse studiene gir overbevisende data som apoptose øker dramatisk i den tidlige fasen av atrofi. For eksempel, i en nylig omfattende studie (Guo et al.(2012), Guo et al. mus ble utsatt for 14 dager med hindlimb-suspensjon, en behandling som resulterte i en ~69% reduksjon i muskel våtvekt og en ~43,8% reduksjon i tverrsnittsareal i forhold til den umanipulerte kontralaterale muskelen. Forfatterne kvantifiserte også en rekke apoptosemarkører, inkludert TUNELFARGING, caspase-3 spaltning/aktivering og spaltning av poly (adenosindifosfat ribose) polymerase (PARP), et protein involvert i DNA-reparasjon. Hver av disse apoptose tiltakene økte signifikant etter hindlimb suspensjon. Mens hovedfokuset i dette papiret var å evaluere den positive effekten av elektrisk stimulering på å begrense atrofi etter en fornærmelse, tolker de og mange andre forskere slike data som å gi sterk støtte til myonukleære domenehypotesen.
fra et cellebiologisk perspektiv presenterer det presumptive tapet av kjerner i et syncytialt vev som skjelettmuskulatur et stort praktisk problem. Hvordan kan en individuell kjerne bli så kompromittert at dens genom raskt kondenserer og fragmenter mens naboene vedvarer og bidrar til å opprettholde muskelfiberens levedyktighet? Gitt at apoptose vanligvis medieres ved aktivering av klassen av cysteinproteaser kjent som caspases, er det ikke klart hvilken mekanisme som kan tjene til å begrense aktiviteten til en diffusibel protease i en felles cytoplasma.
dette spørsmålet har blitt adressert indirekte i en annen syncytial celletype, den menneskelige syncytiotrophoblast, et vev som omgir moderkaken og inneholder ca 5 × 1010 kjerner (Mayhew et al., 1999). Når apoptose induseres i syncytiotrophoblast, forplantes den som en bølge med en hastighet på omtrent 5 mikron per minutt til hele vevet er involvert (Longtine et al., 2012). Følgelig er det ingen «privilegerte» regioner innenfor syncytial cytoplasma, og alle kjernene blir til slutt ødelagt.En av de viktigste utfordringene med å analysere apoptose i skjelettmuskulatur er at det er et veldig heterogent vev, hvor omtrent halvparten av kjernene ligger utenfor muskelfibre (Schmalbruch og Hellhammer, 1977). Disse mononukleerte cellene inkluderer satellittceller, endotelceller, fibroblaster, pericytter og makrofager (Tedesco et al., 2010). Følgelig er det svært vanskelig å bestemme hvilken side av sarcolemma, en kjerne ligger, og dermed om det er en sann myonukleus.
In Vivo Time-Lapse Imaging Av Merkede Mus Muskelfibre
Til Tross for det store antallet papirer som viser apoptose under muskelatrofi, har flere forfattere stilt spørsmål ved disse resultatene (Wada et al., 2002; Zhong et al., 2005; Aravamudan et al., 2006; Gundersen Og Bruusgaard, 2008; Duddy et al.(2011; Qaisar Og Larsson, 2014). For eksempel, ved bruk av isolerte muskelfibre in vitro, Duddy et al. bemerket at mens muskel fiber volum redusert over tid, reflekterende av en atrofisk prosess, antall myonuklei syntes å være stabil (Duddy et al., 2011).i en rekke elegante eksperimenter injiserte gundersen-laboratoriet individuelle extensor digitorum longus (EDL) eller soleus muskler muskelfibre med fargestoffer som uavhengig merket kjernene og cytoplasma i bedøvede mus (Bruusgaard og Gundersen, 2008; Bruusgaard et al., 2010). Dette tillot dem å identifisere hver kjerne i individuelle muskelfibre in vivo over tid og deretter vurdere sin skjebne. FOR EKSEMPEL BLE EDL muskler indusert til hypertrofi ved ablation av deres store synergister (Bruusgaard et al., 2010). Mellom dag 6 og 11 økte antall myonuklei med om lag 54% og mellom dag 9 og 14 var det en 35% økning i tverrsnittsarealet (Figur 1). Disse dataene er i samsvar med hypotesen om at muskler får supernumerære kjerner i forkant av den store veksten av fiberen under hypertrofi.

Figur 1. Myonuklei er ervervet under hypertrofi, men ikke tapt under atrofi i mus. Mikrographs av SAMME EDL muskel fiber over tid etter induksjon av hypertrofi (øverste rad) og påfølgende induksjon av atrofi (nederste rad). Fluorescerende merkede oligonukleotider ble brukt til å visualisere kjernene in vivo. De stiplede linjene representerer sarcolemma. Skala bar = 50 µ (Tilpasset Fra Bruusgaard et al., 2010. Brukes med tillatelse Fra Proceedings Of National Academy Of Sciences.)
de undersøkte da skjebnen til disse unikt identifiserbare myonukleiene i de samme muskelfibrene da de ble indusert til å gjennomgå atrofi. 50% reduksjon i muskelfibervolum, men ingen tap av myonuklei (Figur 1; Bruusgaard et al., 2010). Unnlatelse av å observere kjernefysisk tap var ikke på grunn av atrofisk stimulus ansatt siden de fikk de samme resultatene når musklene ble indusert til atrofi som svar på tetrodotoxin-indusert nerve blokade, hindlimb suspensjon, kreft kakeksi, eller nedtrening (Bruusgaard og Gundersen, 2008; Bruusgaard et al., 2010; Winje et al.( 2018a). Faktisk undersøkte de i løpet av studiene mer enn 200.000 individuelle myonuklei i atrofiske muskler og observerte bare 4 TUNEL-positive (apoptotiske) kjerner, som representerer et tap på bare ~0,002% av kjernene (Bruusgaard et al., 2012). Disse dataene støtter sterkt hypotesen om at skjelettmuskelatrofi ikke ledsages av myonukleær død.
Insektmuskel Som Modell
så kraftig som disse studiene er, er det noen begrensninger knyttet til bruk av pattedyrsmodeller. For det første stole de alltid på eksperimentelle inngrep som denervering for å indusere muskelatrofi. For det andre brukes den kontralaterale muskelen vanligvis som en intern kontroll, selv om den også er utsatt for noen av de samme miljøsignalene, som stresshormoner (Bonaldo og Sandri, 2013). Til slutt kan skjelettmuskler også gjennomgå programmert celledød (PCD) under utvikling, og disse modellene tar sjelden opp rollen som apoptose i disse cellene.En alternativ modell som ikke lider av noen av disse begrensningene, og tillater studier av muskelkjerner under både atrofi og naturlig forekommende PCD, er den intersegmentale muskelen (ISM) fra tobaks hawkmoth Manduca sexta. Ismene består av ark av gigantiske muskelfibre, hvor hver celle er ca 5 mm lang og opptil 1 mm i diameter (Figur 2a). Ismene fester seg til segmentgrensene i magen og genererer både larvernes krypende oppførsel og eclosion (fremveksten) oppførsel av voksenmoten når den rømmer fra pupal cuticle på slutten av metamorfose.
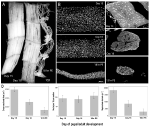
Figur 2. Retensjon av myonuklei under både atrofi og død av de intersegmentale musklene (ISMs) fra moth Manduca sexta. (A) ISMs fra tre stadier av utvikling: homeostatisk (dag 15 av pupal-voksen utvikling; venstre); atrofisk (dag 18; midten); og døende (18 timer etter eclosion; høyre). Skala bar er lik ~1 mm (tilpasset Fra Schwartz et al., 2016). (B) ISMs fra de samme utviklingsstadiene ble ryddet og farget MED kjernefysisk fargestoff DAPI og visualisert via konfokal mikroskopi (tilpasset Fra Schwartz et al., 2016). (C) ISM fiber seksjoner (10 µ) ble farget med kjernefysisk fargestoff DAPI. Legg merke til det dramatiske tapet av muskelprotein (lysegrå område) under atrofi og død, men oppbevaring av kjerner i alle stadier(tilpasset Fra Schwartz et al., 2016). (D) Kvantifisering AV ISM fiber volum (venstre), atomnummer (midten), og myonuclear domene størrelse (høyre) under homeostase, atrofi, og død. (Gjennomsnittlig ± standardfeil.) (Tilpasset Fra Schwartz et al., 2016).
på dag 15 av de normale 18 dagene med pupal-voksen utvikling, Starter Ismene et hormonelt utløst program av atrofi som resulterer i et 40% tap av masse ved eclosion 3 dager senere (Figur 2a; Schwartz og Truman, 1983). Dette dramatiske tapet av muskelmasse tilsvarer det som ses hos 80 år gamle personer med sarkopeni, men foregår over 3 dager i stedet for 30 år. Mens Ismene mister masse, beholder de normale fysiologiske egenskaper som hvilepotensial og kraft / tverrsnittsareal (Schwartz og Ruff, 2002). Ismene brukes til å generere eklosjonsadferd på slutten av dag 18 og deretter starte PCD, som begge utløses av et peptidhormon (Schwartz og Truman, 1982, 1983). .I motsetning til pattedyrsmuskler inneholder Ikke Ismene kapillærer, satellittceller, endotelceller eller pericytter, noe som betyr at nesten alle kjernene i vevet ligger i muskelfibrene selv (Beaulaton og Lockshin, 1977). Vi brukte to uavhengige metoder for å overvåke kjernefysisk skjebne under både atrofi og død i denne modellen (Schwartz et al., 2016). Den første var en standard anatomisk tilnærming. Når Ismene gjennomgår atrofi og død, er det dramatiske reduksjoner i både volum og tverrsnittsareal av fibrene, men grovt var atomnummeret uendret (Figur 2b). Ved bruk av seksjonert vev for kvantitative studier fant vi at det var en ~49% reduksjon i fibertverrsnittområde under atrofi og en ytterligere 30% nedgang i de tidlige stadiene av døden (Figur 2C, D; Schwartz et al ., 2016). Imidlertid endret antall kjerner ikke i samme periode, noe som betyr at det var funksjonelt en 84% reduksjon i myonukleære domenet.den andre metoden vi brukte var å måle DNA-innholdet i individuelle muskelfibre fra dyr på dag 13, når musklene er homeostatiske, til 18 timer etter eclosion, når musklene er sterkt degenererte (Schwartz et al., 2016). VI kvantifiserte DNA-innholdet i 420 individuelle celler og fant at det ikke var noe signifikant tap under utviklingen. Disse biokjemiske analysene stemmer godt overens med anatomiske data og tyder på at den relative konsentrasjonen av både kjerner OG genomisk DNA funksjonelt økt som musklene atrophied og døde. Følgelig antyder data fra både mus og møll at muskelkjerner ikke gjennomgår apoptose under atrofi (ELLER PCD) og fører til konklusjonen om at myonukleære domenehypotesen bør avvises.
Konklusjoner
disse observasjonene har en rekke implikasjoner for både å forstå grunnleggende biologi av muskel og for å utvikle potensielle terapeutiske intervensjoner. Mens det er betydelige data som rapporterer tilstedeværelsen av apoptotiske kjerner i vevet etter atrofiske fornærmelser, tyder nyere data på at disse ikke er sanne myonuklei, men heller fordømte mononukleære celler som ligger utenfor muskelfiberen. Den primære årsaken til denne uoverensstemmelsen er at de tradisjonelle verktøyene som brukes til å oppdage apoptose, mangler oppløsningen som kreves for å bestemme hvilken side av sarcolemma en døende celle ligger. Metoder som merker myonuklei spesifikt, enten via in vivo injeksjoner av fluorescerende fargestoffer (Bruusgaard og Gundersen, 2008) eller via genetiske manipulasjoner for å uttrykke markørproteiner (Duddy et al., 2011), avslører få om noen apoptotiske kjerner i de merkede fibrene. Den siste demonstrasjonen at antistoffer rettet mot Protein Pericentriolar Materiale 1 (PCM1) etiketten bare autentisk myonuclei tilbyr et lovende verktøy som kan brukes på de tradisjonelle histologiske materialer som rutinemessig analyseres i feltet (Winje et al .( 2018b).
manglende skjelettmuskulatur til å ansette apoptose som en mekanisme for å eliminere myonuklei er ikke overraskende. Det ser ut til at moden skjelettmuskulatur i stor grad er utelukket fra å starte apoptose ved at den oppregulerer ekspresjonen av potente overlevelsesproteiner som X-bundet inhibitor av apoptoseprotein (XIAP) (Smith et al ., 2009) og apoptose repressor med caspase recruitment domain (ARC) (Xiao et al., 2011), samtidig som man uttrykker lave nivåer av apoptosemediatorer som apoptotisk proteaseaktiverende faktor 1 (Apaf-1) (Burgess et al., 1999). Dette er fornuftig teleologisk siden muskler er utsatt for ekstreme forstyrrelser, inkludert forstyrrelse av sarcolemma etter intens trening, så det ville være katastrofalt hvis de utløste celledød i stedet for initiert vevsreparasjon og muligens hypertrofi. Som andre terminalt differensierte celler, har muskler en tendens til å benytte ikke-apoptotiske mekanismer, spesielt autofagisk PCD (også kjent Som TYPE II degenerasjon) (Clarke, 1990; Schwartz et al., 1993; Kole et al., 2013; Ginet et al., 2014) når de dør under utvikling.
Selv om det var en mekanisme hvor muskler kunne selektivt målrette individuelle kjerner, er det ikke klart at dette ville være gunstig. Faktisk gir retensjonen av» overskudd » kjerner under atrofi en klar fordel for individet siden skjelettmuskler ofte gjennomgår sykluser av atrofi og hypertrofi som følge av miljøforhold som mattilgjengelighet. Evnen til å gjenopprette raskt ved å utnytte eksisterende myonuklei kan tjene en viktig rolle i tilpasning (Jackson et al., 2012) og bidra til å forklare fenomenet » muskelminne «(Staron Et al.( 1991; Gundersen, 2016). Det er godt dokumentert innen treningsfysiologi at det er langt lettere å skaffe seg et visst nivå av muskelfitness gjennom trening enn det var å oppnå det første stedet, selv om det har vært en lang mellomliggende periode med nedtrening. Med andre ord kan uttrykket «bruk det eller miste det» være mer nøyaktig formulert som » bruk det eller miste det, til du jobber med det igjen.»Dette har blitt demonstrert direkte av et annet eksperiment Fra gundersen lab som viste at når en muskel har fått nye kjerner, beholder den dem lenge etter at den hypertrofiske stimulansen er fjernet. De induserte muskelhypertrofi hos kvinnelige mus ved å behandle dem i 2 uker med testosteron og deretter undersøkt musklene 3 uker etter steroiduttak (Egner et al., 2013). Muskelvolumet hadde returnert til baseline, men de nyoppkjøpte kjernene fortsatte selv 3 måneder senere. Når musklene ble utsatt for overbelastning for å gjenoppta hypertrofi, gjennomgikk de steroidbehandlede seg raskt en 36% økning i fibervolum mens kontrollmuskler bare vokste med 6%. Disse dataene tyder på at «overskudd» kjernene kan mobiliseres raskt for å lette omskoling.
disse observasjonene har potensielle implikasjoner for folkehelsepolitikken. Det har vist seg at muskelvekst, fysiologisk funksjon og regenerativ kapasitet alle avtar med alderen, hovedsakelig på grunn av redusert satellittcelleproliferasjon (Blau et al., 2015). Derfor kan trening i ungdomsårene, når muskelvekst forsterkes av hormoner, ernæring og et robust satellittbasseng, fungere funksjonelt for å tillate enkeltpersoner å» bank » myonuklei som kan trekkes på senere i livet for å bremse effekten av aldring og muligens forhindre sarkopeni.
i tillegg har disse dataene implikasjoner innen konkurranseidrett. Bruk av anabole steroider er en potent stimulans for muskel hypertrofi og tillegg av nye myonuklei (Egner et al., 2013). Siden disse kjernene vedvarer lenge etter at steroidbruken slutter, oppnår idrettsutovere sannsynligvis fordelene med ulovlig narkotikabruk uten risiko for deteksjon.oppsummert, mens tilsetningen av nye kjerner med muskelvekst i stor grad er akseptert, kan det apoptotiske tapet av kjerner med atrofi ikke støttes, noe som tyder på at streng tolkning av myonukleære domenehypotesen ikke kan støttes. I stedet ser det ut til at når det er oppnådd, fortsetter myonuklei selv når en muskel blir atrofisk eller initierer celledød.
Forfatterbidrag
forfatteren bekrefter å være den eneste bidragsyteren til dette arbeidet og har godkjent det for publisering.
Finansiering
arbeidet for denne publikasjonen ble støttet av midler Fra Eugene M. Og Ronnie Isenberg Professorskap Legat. Ingen bedriftsstøtte ble gitt til forfatteren, og ingen kommersielle produkter er nevnt eller godkjent.
Interessekonflikt
forfatteren erklærer at forskningen ble utført i fravær av kommersielle eller økonomiske forhold som kan tolkes som en potensiell interessekonflikt.
Takk
forfatteren vil gjerne takke Ms. Christine Brown for hjelp i utarbeidelsen av dette manuskriptet og Eugene M. Og Ronnie Isenberg Professorat Legat for støtte.
Aagaard, P. (2004). Å gjøre muskler «sterkere»: trening, ernæring, narkotika. J. Muskelskjelett. Neuronal. Samhandle. 4, 165–174.
PubMed Abstract/Google Scholar
Abreu, P., Mendes, S. V., Ceccatto, V. M., Og Hirabara, S. M. (2017). Satellittcelleaktivering indusert av aerob muskeltilpasning som respons på utholdenhetstrening hos mennesker og gnagere. Livet Sci. 170, 33–40. doi: 10.1016 / j. aku.2016.11.016
PubMed Abstract | CrossRef Full Text/Google Scholar
Ali, S., Og Garcia, Jm (2014). Sarkopeni, kakeksi og aldring: diagnose, mekanismer og terapeutiske alternativer-en mini-gjennomgang. Gerontologi 60, 294-305. doi: 10.1159/000356760
PubMed Abstract | CrossRef Full Text | Google Scholar
Alway, S. E., Martyn, J. K., Ouyang, J., Chaudhrai, A., Og Murlasits, Z. S. (2003). Id2 expression during apoptosis and satellite cell activation in unloaded and loaded quail skeletal muscles. Am. J. Physiol. Regul. Integr. Comp. Physiol. 284, R540–R549. doi: 10.1152/ajpregu.00550.2002
PubMed Abstract | CrossRef Full Text | Google Scholar
Andrianjafiniony, T., Dupre-Aucouturier, S., Letexier, D., Couchoux, H., and Desplanches, D. (2010). Oxidative stress, apoptosis, and proteolysis in skeletal muscle repair after unloading. Am. J. Phys. Cell Physiol. 299, C307–C315. doi: 10.1152/ajpcell.00069.2010
PubMed Abstract | CrossRef Full Text/Google Scholar
Aravamudan, B., Mantilla, C. B., Zhan, W. Z., Og Sieck, G. C. (2006). Denervering effekter på myonukleære domene størrelsen på rotte membran fibre. J. Appl. Physiol. 100, 1617–1622. doi: 10.1152 / japplfysiol.01277.2005
CrossRef Full Text/Google Scholar
Bachman, Jf, Klose, A., Liu, W., Paris, Nd, Blanc, Rs, Schmalz, M., et al. (2018). Prepubertal skjelettmuskulatur vekst krever Pax 7-uttrykke satellitt celle-avledet myonukleære bidrag. Utvikling 145: 167197.
Google Scholar
Barnes, B. T., Confides, Al, Rich, Mm, Og Dupont-Versteegden, E. E. (2015). Distinkte muskel apoptotiske veier aktiveres i muskler med forskjellige fibertyper i en rottemodell av kritisk sykdom myopati. J. Muskel Res. Celle Motil. 36, 243–253. doi: 10.1007 / s10974-015-9410-8
PubMed Abstract | CrossRef Full Text/Google Scholar
Beaulaton, J., Og Lockshin, R. A. (1977). Ultrastructural studie av normal degenerasjon av intersegmentale muskler Av Anthereae polyphemus Og Manduca sexta (insecta, lepidoptera) med særlig henvisning til cellulær autofagi. J. Morphol. 154, 39–57. doi: 10.1002 / jmor.1051540104
PubMed Abstract | CrossRef Full Text/Google Scholar
Bentzinger, C. F., von Maltzahn, J., Dumont, N. A., Stark, D. A., Wang, Y. X., Nhan, K., et al. (2014). Wnt 7a stimulerer myogen stamcellemotilitet og engraftment som resulterer i forbedret muskelstyrke. J. Cell Biol. 205, 97–111. doi: 10.1083 / jcb.201310035
PubMed Abstract / CrossRef Full Text/Google Scholar
Blau, Hm, Cosgrove, Bd, Og Ho, At (2015). Den sentrale rollen til muskelstamceller i regenerativ svikt med aldring. Nat. Med. 21, 854–862. doi: 10.1038 / nm.3918
PubMed Abstract | CrossRef Full Text/Google Scholar
Bonaldo, P., Og Sandri, M. (2013). Cellulære og molekylære mekanismer for muskelatrofi. Dis. Modell. Robot. 6, 25–39. doi: 10.1242 / dmm.010389
CrossRef Full Text/Google Scholar
Brack, As, Og Rando, T. A. (2012). Tissue-spesifikke stamceller: leksjoner fra skjelettmuskulatur satellittcelle. Celle Stamcelle 10, 504-514. doi: 10.1016 / j.stamme.2012.04.001
PubMed Abstract | CrossRef Full Text/Google Scholar
Bruusgaard, J. C., Egner, I. M., Larsen, T. K., Dupre-Aucouturier, S., Desplanches, D., Og Gundersen, K. (2012). Ingen endring i myonukleære tall under muskel lossing og omlasting. J. Appl. Physiol. 113, 290–296. doi: 10.1152 / japplfysiol.00436.2012
PubMed Abstract | CrossRef Full Text/Google Scholar
Bruusgaard, J. C., og Gundersen, K. (2008). In vivo time-lapse mikroskopi avslører ingen tap av murine myonuclei i løpet av uker med muskelatrofi. J. Clin. Investere. 118, 1450–1457. doi: 10.1172/JCI34022
PubMed Abstract | CrossRef Full Text | Google Scholar
Bruusgaard, J. C., Johansen, I. B., Egner, I. M., Rana, Z. A. og Gundersen, K. (2010). Myonuklei ervervet ved overbelastning trening forut hypertrofi og er ikke tapt på nedtrening. Proc. Natl. Acad. Sci. U. S. A. 107, 15111-15116. doi: 10.1073 / pnas.0913935107
CrossRef Full Text / Google Scholar
Bruusgaard, J. C., Liestol, K., Ekmark, M., Kollstad, K., Og Gundersen, K. (2003). Antall og romlig fordeling av kjerner i muskelfibrene i normale mus studert in vivo. J. Physiol. 551, 467–478. doi: 10.1113 / jfysiol.2003.045328
PubMed Abstract | CrossRef Full Text/Google Scholar
Burgess, D. H., Svensson, M., Dandrea, T., Gronlund, K., Hammarquist, F., Orrenius, S., Et al. (1999). Cytosoler i skjelettmuskulatur hos mennesker er refraktære mot cytokrom c-avhengig aktivering av type II caspaser og mangler APAF-1. Celledød Er Forskjellig. 6, 256–261. doi: 10.1038 / sj.cdd.4400489
PubMed Abstract / CrossRef Full Text / Google Scholar
Cabric, M., Og James, N. T. (1983). Morfometriske analyser av musklene til trente og utrente hunder. Er. J. Anat. 166, 359–368. doi: 10.1002 / aja.1001660309
PubMed Abstract | CrossRef Full Text/Google Scholar
Cheema, N., Herbst, A., McKenzie, D., og Aiken, Jm (2015). Apoptose og nekrose medierer skjelettmuskelfibertap i aldersinduserte mitokondrielle enzymatiske abnormiteter. Aldrende Celle 14, 1085-1093. doi: 10.1111 / acel.12399
PubMed Abstract | CrossRef Full Text/Google Scholar
Clarke, P. G. (1990). Utviklingsmessig celledød: morfologisk mangfold og flere mekanismer. Anat. Embryol. 181, 195–213.
Google Scholar
Cohen, S., Nathan, J. A. og Goldberg, Al (2015). Muskelavfall i sykdom: molekylære mekanismer og lovende terapier. Nat. Rev. Narkotika Discov. 14, 58–74. doi: 10.1038/nrd4467
PubMed Abstract | CrossRef Full Text | Google Scholar
Duddy, Wj, Cohen, T., Duguez, S., And Partridge, T. A. (2011). Den isolerte muskelfibre som en modell av stillstand atrofi: karakterisering ved Hjelp Av PhAct, en metode for å kvantifisere f-actin. Exp. Celle Res. 317, 1979-1993. doi: 10.1016 / j.yexcr.2011.05.013
PubMed Abstract | CrossRef Full Text/Google Scholar
Dumont, Na, Wang, Yx, Og Rudnicki, Ma (2015). Indre og ytre mekanismer som regulerer satellittcellefunksjonen. Utvikling 142, 1572-1581. doi: 10.1242 / dev.114223
PubMed Abstract / CrossRef Full Text / Google Scholar
Egner, I. M., Bruusgaard, J. c., Eftestol, E., og Gundersen, K. (2013). En cellulær minnemekanisme hjelper overbelastning hypertrofi i muskel lenge etter en episodisk eksponering for anabole steroider. J. Physiol. 591, 6221–6230. doi: 10.1113 / jfysiol.2013.264457
PubMed Abstract / CrossRef Full Text / Google Scholar
Egner, I. M., Bruusgaard, J. C., og Gundersen, K. (2016). Satellittcelleutarmning forhindrer fiberhypertrofi i skjelettmuskulatur. Utvikling 143, 2898-2906. doi: 10.1242 / dev.134411
PubMed Abstract | CrossRef Full Text/Google Scholar
Fitts, R. H., Metzger, J. M., Riley, Da, Og Unsworth, B. R. (1986). Modeller av stillstand: en sammenligning av hindlimb suspensjon og immobilisering. J. Appl. Physiol. 60, 1946–1953.Ginet, V., Pittet, M. P., Rummel, C., Osterheld, M. C., Meuli, R., Clarke, P. G., Et al. (2014). Døende nevroner i thalamus av kvælte sikt nyfødte og rotter er autofagiske. Anne. Neurol. 76, 695–711. doi: 10.1002 / ana.24257
PubMed Abstract / CrossRef Full Text / Google Scholar
Goh, Q., Og Millay, D. P. (2017). Krav til myomaker-mediert stamcellefusjon for skjelettmuskelhypertrofi. elife 6. doi: 10.7554 / eLife.20007
PubMed Abstract | CrossRef Full Text/Google Scholar
Gregory, T. R. (2001). Tilfeldighet, coevolution, eller årsakssammenheng? DNA-innhold, cellestørrelse og C-verdien enigma. Biol. Pastor Camb. Philos. Soc. 76, 65–101. doi: 10.1017/s1464793100005595
PubMed Abstract | CrossRef Full Text | Google Scholar
Guerci, A., Lahoute, C., Hebrard, S., Collard, L., Graindorge, D., Favier, M., Et al. (2012). Srf-avhengige parakrinsignaler produsert av myofibre kontrollerer satellittcellemediert skjelettmuskelhypertrofi. Celle Metab. 15, 25–37. doi: 10.1016 / j.cmet.2011.12.001
PubMed Abstract / CrossRef Full Text / Google Scholar
Gundersen, K. (2016). Muskelminne og en ny mobilmodell for muskelatrofi og hypertrofi. J. Exp. Biol. 219, 235–242. doi: 10.1242 / jeb.124495
PubMed Abstract / CrossRef Full Text/Google Scholar
Gundersen, K., Og Bruusgaard, J. C. (2008). Nuclear domener under muskelatrofi: kjerner tapt eller paradigme tapt? J. Physiol. 586, 2675–2681. doi: 10.1113 / jfysiol.2008.154369
PubMed Abstract | CrossRef Full Text/Google Scholar
Guo, Bs, Cheung, Kk, Yeung, Ss, Zhang, Bt, Og Yeung, Ew (2012). Elektrisk stimulering påvirker satellittcelleproliferasjon og apoptose ved lossing-indusert muskelatrofi hos mus. PLoS One 7: e30348. doi: 10.1371 / tidsskrift.pone.0053523
PubMed Abstract | CrossRef Full Text/Google Scholar
Jackson, J. R., Mula, J., Kirby, T. J., Fry, C. S., Lee, J. D., Ubele, M. F., et al. (2012). Satellittcelledeplesjon hemmer ikke gjenvekst av skjelettmuskler hos voksne etter lossingsindusert atrofi. Er. J. Phys. Cellefysiol. 303, C854-C861. doi: 10.1152 / ajpcell.00207.2012
PubMed Abstract / CrossRef Full Text / Google Scholar
Joubert, Y., Og Tobin, C. (1995). Testosteronbehandling resulterer i hvilende satellittceller blir aktivert og rekruttert i cellesyklus i rotte levator ani muskel. Dev. Biol. 169, 286–294. doi: 10.1006 / dbio.1995.1144
PubMed Abstract | CrossRef Full Text/Google Scholar
Katz, B. (1961). Avslutninger av afferent nerve fiber i muskel spindel av frosken. Philos. Trans. R. Soc. Lond. B Biol. Sci. 243, 221–240.
PubMed Abstract / Google Scholar
Kletzien, H., Hare, A. J., Leverson, G., Og Connor, N. P. (2018). Aldersrelatert effekt av celledød på fibermorfologi og antall i tunge muskler. Muskel Nerve 57, E29-E37. doi: 10.1002 / mus.25671
PubMed Abstract / CrossRef Full Text / Google Scholar
Kole, A. J., Annis, Rp, Og Deshmukh, M. (2013). Eldre nevroner: utstyrt for overlevelse. Celledød Dis. 4: e689. doi: 10.1038 / cddis.2013.220
PubMed Abstract | CrossRef Full Text/Google Scholar
Li, Ts, Shi, H., Wang, L., Og Yan, C. (2016). Effekt av benmargs mesenkymale stamceller på satellittcelleproliferasjon og apoptose ved immobiliseringsindusert muskelatrofi hos rotter. Med. Sci. Monit. 22, 4651–4660. doi: 10.12659 / MSM.898137
PubMed Abstract / CrossRef Full Text/Google Scholar
Lockshin, R. A., Og Williams, C. M. (1965). Programmert celledød – I. Cytologi av degenerasjon I intersegmental muskler Av Pernyi silkmoth. J. Insekt Physiol. 11, 123–133. doi: 10.1016/0022-1910(65)90099-5
PubMed Abstract | CrossRef Full Text/Google Scholar
Longtine, Ms, Barton, A., Chen, B., Og Nelson, D. M. (2012). Levende celleavbildning viser apoptose initierer lokalt og forplanter seg som en bølge gjennom syncytiotrophoblast i primære kulturer av humane placenta villøse trofoblast. Placenta 33, 971-976. doi: 10.1016 / j.placenta.2012.09.013
PubMed Abstract | CrossRef Full Text/Google Scholar
Mauro, A. (1961). Satellittcelle av skjelettmuskelfibre. J. Biophys. Biochem. Cytol. 9, 493–495.I 1999 ble Det opprettet En egen organisasjon, Og Det ble opprettet en egen organisasjon. Proliferasjon, differensiering og apoptose i villøs trofoblast ved 13-41 ukers svangerskap (inkludert observasjoner på annulere lameller og nukleare porekomplekser). Placenta 20, 407-422. doi: 10.1053 / plass.1999.0399.
PubMed Abstract | CrossRef Full Text/Google Scholar
McCall, G. E., Allen, D. L., Linderman, J. K., Grindeland, R. E., Roy, R. R., Mukku, V. R., Et al. (1998). Vedlikehold av myonukleær domenestørrelse i rotte soleus etter overbelastning og veksthormon / IGF-i-behandling. J. Appl. Physiol. 84, 1407–1412.
Google Scholar
McClung, J. M., Kavazis, A. N., Deruisseau, K. C., Falk, D. J., Deering, M. A., Lee, Y., Et al. (2007). Caspase-3 regulering av membran myonukleære domene under mekanisk ventilasjon-indusert atrofi. Er. J. Respir. Crit. Care Med. 175, 150–159. doi: 10.1164 / rccm.200601-142OC
PubMed Abstract | CrossRef Full Text/Google Scholar
Metter, E. J., Talbot, L. A., Schrager, M. Og Conwit, R. (2002). Skjelettmuskelstyrke som en prediktor for all-årsak dødelighet hos friske menn. J. Gerontol. En Biol. Sci. Med. Sci. 57, B359-B365. doi: 10.1093/gerona / 57.10.B359
PubMed Abstract | CrossRef Full Text/Google Scholar
Minnaard, R., Drost, M. R., Wagenmakers, A. J., van Kranenburg, G. P., Kuipers, H., and hesselink, M. K. (2005). Skjelettmuskulatur sløse og kontraktile ytelse i septisk rotter. Muskel Nerve 31, 339-348. doi: 10.1002 / mus.20268
PubMed Abstract / CrossRef Full Text / Google Scholar
Moss, F. P. (1968). Forholdet mellom dimensjonene av fibrene og antall kjerner under normal vekst av skjelettmuskulatur i husdyr. Er. J. Anat. 122, 555–563. doi: 10.1002 / aja.1001220308
PubMed Abstract | CrossRef Full Text/Google Scholar
Murach, Ka, Englund, Da, Dupont-Versteegden, E. E., McCarthy, J. J., Og Peterson, Ca (2018). Myonukleær domenefleksibilitet utfordrer stive forutsetninger om satellittcellebidrag til skjelettmuskulaturfiberhypertrofi. Front. Physiol. 9:635. doi: 10.3389 / fphys.2018.00635
CrossRef Full Text | Google Scholar
Nevalainen, M., Kaakinen, M., Og Metsikko, K. (2013). Fordeling av mrna transkripsjoner og oversettelse aktivitet i skjelett myofibers. Cellevev Res. 353, 539-548. doi: 10.1007 / s00441-013-1659-X
PubMed Abstract | CrossRef Full Text | Google Scholar
O ‘ Leary, M. F., Vainshtein, A., Carter, H. N., Zhang, Y., Og Hood, Da (2012). Denervering-indusert mitokondriell dysfunksjon og autofagi i skjelettmuskulatur hos apoptose-mangelfulle dyr. Er. J. Phys. Cellefysiol. 303, C447-C454. doi: 10.1152/ajpcell.00451.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Palumbo, C., Rovesta, C., and Ferretti, M. (2012). Striated muscle fiber apoptosis after experimental tendon lesion in a rat model. J. Anat. 221, 358–363. doi: 10.1111/j.1469-7580.2012.01554.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Qaisar, R., and Larsson, L. (2014). What determines myonuclear domain size? Indian J. Physiol. Pharmacol. 58, 1–12.
PubMed Abstract | Google Scholar
Ross, J. A., Levy, Y., Svensson, K., Philp, A., Schenk, S., og Ochala, J. (2018). SIRT1 regulerer atomnummer og domenestørrelse i skjelettmuskulaturfibre. J. Cell. Physiol. 233, 7157–7163. doi: 10.1002 / jcp.26542
PubMed Abstract | CrossRef Full Text/Google Scholar
Schiaffino, S., Dyar, Ka, Ciciliot, S., Blaauw, B. og Sandri, M. (2013). Mekanismer som regulerer skjelettmuskelvekst og atrofi. FEBS J. 280, 4294-4314. doi: 10.1111 / febs.12253
PubMed Abstract / CrossRef Full Text / Google Scholar
Schmalbruch, H., Og Hellhammer, U. (1977). Antall kjerner i voksne rottemuskler med spesiell henvisning til satellittceller. Anat. Rec. 189, 169–175. doi: 10.1002 / ar.1091890204
PubMed Abstract | CrossRef Full Text/Google Scholar
Schwartz, L. M. (2008). Atrofi og programmert celledød av skjelettmuskulatur. Celledød Er Forskjellig. 15, 1163–1169. doi: 10.1038 / cdd.2008.68
PubMed Abstract | CrossRef Full Text/Google Scholar
Schwartz, Lm, Brown, C., McLaughlin, K., Smith, W., Og Bigelow, C. (2016). Det myonukleære domenet opprettholdes ikke i skjelettmuskulatur under enten atrofi eller programmert celledød. Er. J. Phys. Cellefysiol. 311, C607-C615. doi: 10.1152 / ajpcell.00176.2016
PubMed Abstract / CrossRef Full Text / Google Scholar
Schwartz, L. M., Og Ruff, R. L. (2002). Endringer i kontraktile egenskaper av skjelettmuskulatur under utviklingsmessig programmert atrofi og død. Er. J. Phys. Cellefysiol. 282, C1270-C1277. doi: 10.1152 / ajpcell.01275.2000
CrossRef Full Text | Google Scholar
Schwartz, L. M., Smith, S. W., Jones, M. E. Osborne, B. A. (1993). Skjer alle programmerte celledød via apoptose? Proc. Natl. Acad. Sci. Usa 90, 980-984.
Google Scholar
Schwartz, L. M., Og Truman, J. W. (1983). Hormonal kontroll av priser av metamorfe utvikling i tobakk hornworm Manduca sexta. Dev. Biol. 99, 103–114. doi: 10.1016/0012-1606(83)90257-9
PubMed Abstract | CrossRef Full Text/Google Scholar
Schwartz, L. M., Og Truman, J. W. (1982). Peptid og steroid regulering av muskel degenerasjon i et insekt. Vitenskap 215, 1420-1421. doi: 10.1126 / vitenskap.6278594
PubMed Abstract | CrossRef Full Text/Google Scholar
Smith, H. K., Maxwell, L., Martyn, J. A., Og Bass, J. J. (2000). Nukleær DNA-fragmentering og morfologiske endringer i skjelettmuskulatur hos voksne kaniner etter kortvarig immobilisering. Cellevev Res. 302, 235-241. doi: 10.1007 / s004410000280
PubMed Abstract / CrossRef Full Text / Google Scholar
Smith, Mi, Huang, Yy, Og Deshmukh, M. (2009). Skjelettmuskulaturdifferensiering fremkaller endogen XIAP for å begrense den apoptotiske banen. PLoS One 4: e5097. doi: 10.1371 / journal.pone.0005097
CrossRef Full Text/Google Scholar
Staron, R. S., Leonardi, M. J., Karapondo, D. L., Malicky, E. S., Falkel, J. E., Hagerman, F. C., Et al. (1991). Styrke og skjelettmuskulaturtilpasninger hos kvinner med tung motstand etter nedtrening og omskoling. J. Appl. Physiol. 70, 631-640.
Google Scholar
Strassburger, E. (1893). Virkningsfeltet av kjernene og cellestørrelsen. Histol Beitr. 5, 97-124.
Google Scholar
Strasser, H., Tiefenthaler, M., Steinlechner, M., Eder, I., Bartsch, G., Og Konwalinka, G. (2000). Alder avhengig apoptose og tap av rhabdosphincter celler. J. Urol. 164, 1781–1785. doi: 10.1016 / S0022-5347 (05)67106-6
PubMed Abstract | CrossRef Full Text/Google Scholar
Tedesco, F. S., Dellavalle, A., Diaz-Manera, J., Messina, G., Og Cossu, G. (2010). Reparasjon av skjelettmuskulatur: regenerativt potensial for skjelettmuskulaturstamceller. J. Clin. Investere. 120, 11–19. doi: 10.1172/JCI40373
PubMed Abstract | CrossRef Full Text | Google Scholar
Wada, K. I., Takahashi, H., Katsuta, S., Og Soya, H. (2002). Ingen reduksjon i myonukleært tall etter langvarig denervering i modne mus. Er. J. Phys. Cellefysiol. 283, C484-C488. doi: 10.1152 / ajpcell.00025.2002
CrossRef Full Text/Google Scholar
Winje, I. M., Sheng, X., Hansson, K. A., Solskinnå, A., Tennø, S., Saatcioglu, F., et al. (2018a). Kakeksi induserer ikke tap av myonuklei eller muskelfibre under xenograft prostatakreft hos mus. Acta Physiol. e13204. doi: 10.1111 / apha.13204
CrossRef Full Text/Google Scholar
Winje, I. M., Bengtsen, M., Eftestol, E., Juvkam, I., Bruusgaard, J. C., og Gundersen, K. (2018b). Spesifikk merking av myonuklei med et antistoff mot pericentriolært materiale 1 på deler av skjelettmuskelvev. Acta Physiol. 223: e13034. doi: 10.1111 / apha.13034
CrossRef Full Tekst/Google Scholar
Woo, J. (2017). Sarkopeni. Clin. Geriatr. Med. 33, 305–314. doi: 10.1016 / j.cger.2010.02.012
CrossRef Full Text/Google Scholar
Xiao, R., Ferry, Al, Og Dupont-Versteegden, E. E. (2011). Celledødsresistens av differensierte myotuber er assosiert med forbedrede anti-apoptotiske mekanismer sammenlignet med myoblaster. Apoptose 16, 221-234. doi: 10.1007 / s10495-010-0566-9
PubMed Abstract | CrossRef Full Text/Google Scholar
Yang, D., Morris, S. F., Og Sigurdson, L. (1998). Sartorius-muskelen: anatomiske hensyn for rekonstruktive kirurger. Surg. Radiol. Anat. 20, 307–310. doi: 10.1007
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhong, H., Roy, Rr, Siengthai, B., Og Edgerton, V. R. (2005). Effekter av inaktivitet på fiberstørrelse og myonukleært antall i rotte soleus muskel. J. Appl. Physiol. 99, 1494–1499. doi: 10.1152 / japplfysiol.00394.2005
CrossRef Full Text/Google Scholar
Zhou, X., Wang, Jl, Lu, J., Song, Y., Kwak, Ks, Jiao, Q., Et al. (2010). Reversering av kreft kakeksi og muskelsvinn Ved Act RIIB antagonisme fører til langvarig overlevelse. Celle 142, 531-543. doi: 10.1016 / j.celle.2010.07.011
PubMed Abstract | CrossRef Full Text/Google Scholar
Ziaaldini, M. M., Marzetti, E., Picca, A., Og Murlasits, Z. (2017). Biokjemiske veier av sarkopeni og deres modulering ved fysisk trening: en fortellende gjennomgang. Front. Med. 4:167. doi: 10.3389 / fmed.2017.00167
CrossRef Full Text/Google Scholar