Normal cellemetabolisme avhenger av vedlikehold av blod pHwithin svært smale grenser (7.35-7.45).selv relativt mildutflukter utenfor dette normale pH-området kan ha skadelige effekter, inkludert redusert oksygentilførsel til vev, elektrolytforstyrrelser og endringer i hjertemuskelkontraktilitet; overlevelse er sjelden hvis blodets pH faller under 6,8 eller stiger over 7,8.
problemetfor kroppen er at normal metabolisme er forbundet medkontinuerlig produksjon av hydrogenioner (H+) og karbondioksid(CO2), som begge har en tendens til å redusere pH. mekanismensom overvinter dette problemet og tjener til å opprettholde normal blod pH(dvs.bevare syre-base homeostase) er en kompleks synergi avhandling som involverer kjemiske buffere i blod, de røde cellene(erytrocytter), som sirkulerer i blod, og funksjonen av treorganer: lunger, nyrer og hjerne.
før du forklarer hvordan disse femelementene bidrar til det generelle vedlikeholdet av blodets pH, detville være nyttig å raskt gjennomgå noen grunnleggende begreper.
- hva er en syre, hva er en base og hva er pH?
- Hva er en buffer? bikarbonatbuffersystemet
- Lungefunksjon, transport AV CO2 og syre-basebalanse
- Nyrer og syrebasebalanse
- FORSTYRRELSER AV SYREBASEBALANSE
- Årsaker til syre-base forstyrrelser
- Respiratorisk acidose – (økt pCO2(a),redusert pH)
- Respiratorisk alkalose – (redusert pco2 (a), økt pH)
- Metabolisk acidose – (reduserthco3 -, redusert pH)
- Metabolsk alkalose – (økthco3 -, økt pH)
- Kompensasjon-en konsekvens av syrebaseforstyrrelse
- Blandede syrebaseforstyrrelser
- Sammendrag
- noen foreslo viderelesing
hva er en syre, hva er en base og hva er pH?
en syre er et stoff som frigjørhydrogenioner (H+) på dissosiasjon i oppløsning.
for eksempel: Saltsyre (HCl) dissosierer til hydrogenioner og kloridioner
HCl ![]() H+ + Cl-
H+ + Cl-
Karbonsyre (H2CO3) dissosierer tilhydrogenioner og bikarbonationer
H2co3 ![]() H+ +hco3–
H+ +hco3–
vi skiller mellom sterke syrer som Saltsyre ogsvake syrer som karbonsyre. Forskjellen er at sterke syrerdissosiere mer enn svake syrer. Følgelig er hydrogenjonenkonsentrasjon av en sterk syre mye høyere enn for en svaksyre.
en base er et stoff som i oppløsning akseptererhydrogenioner.
for eksempel aksepterer basebikarbonatet (HCO3–)hydrogenioner for å danne karbonsyre:
HCO3 – + H + ![]() H2CO3
H2CO3
pH er en skala på 0-14 av surhet og alkalitet. Rent vann har en pH på 7 og er nøytral(verken sur eller alkalisk). pH over 7er alkalisk og under 7 sur. Dermed er pH i blod (7,35-7,45) litt alkalisk, men i klinisk medisin er begrepet alkalosisis, kanskje forvirrende, reservert for blod pH større enn 7.45og begrepet acidose er reservert for blod pH mindre enn 7,35.
pH er et mål på hydrogenionkonsentrasjon (H+).De to er relatert i henhold til følgendeekvasjon:
pH = – log10
hvor er konsentrasjonen av hydrogenioner inmol per liter (mol/L)
fra denne ligningen
pH 7,4 = H+ konsentrasjon på 40 nmol/L
pH 7,0 = H+ konsentrasjon på 100 nmol/L
pH 6,0 = H+ konsentrasjon på 1000 nmol/L
det er klart at:
- de to parametrene endres omvendt; etter hvert som konsentrasjonen av hydrogenioner øker, faller pH
- på grunn av det logaritmiske forholdet, er en stor endring i konsentrasjonen av hydrogenioner faktisk en liten endring i pH. for eksempel, dobling av konsentrasjonen av hydrogenioner fører til at pH faller med bare 0,3
Hva er en buffer? bikarbonatbuffersystemet
Buffere er kjemikalier i løsning som minimerer ph-endring som oppstår når syrer tilsettes ved å moppe opphydrogenioner. En buffer er en løsning av en svak syre og denskonjugatbase. I blod er prinsippet buffersystem det svakesyre, karbonsyre (H2CO3) og dets konjugatbase, bikarbonat (HCO3–). HCl,til bikarbonatbufferen:
syren vil dissosiere, frigjøre hydrogenioner:
HCl ![]() H+ + Cl–
H+ + Cl–
bikarbonatbufferen absorberer deretter hydrogenioner, danner karbonsyre i prosessen.:
HCO3 – + h + ![]() H2CO3 (karbonsyre)
H2CO3 (karbonsyre)
det viktige poenget er at fordi hydrogenioner Fra Hclhar blitt innlemmet i den svake karbonsyre, som ikke dissosierer så lett, det totale antall hydrogenioner i løsningog derfor pH ikke endres så mye som ville ha skjeddi fravær av bufferen.
Selv om en buffer sterkt minimererph-endring, eliminerer den ikke det fordi selv en svak syre (somkarbonsyre) dissosierer til en viss grad. PH av en bufferløsning er en funksjon av de relative konsentrasjonene av de svakesyre og dens konjugatbase.
pH = 6,1 + log (/)
Hvor = konsentrasjon avbikarbonat
= konsentrasjon av karbonsyre
dette forholdet, kjent som Henderson-Hasselbalch-ligningen, viser at pH styres av forholdet mellom base (HCO3–) konsentrasjon til syre (H2CO3) konsentrasjon.
som hydrogenioner blir tilsatt til bikarbonatbufferen:
H + + HCO3 – ![]() H2CO3
H2CO3
bikarbonat (base) forbrukes (konsentrasjon reduseres) ogkarbonsyre produseres (konsentrasjon øker). Hvis hydrogenioner fortsetter å bli tilsatt, vil alt bikarbonat til slutt bli konsumert (omdannet til karbonsyre) og det ville være nobuffering effekt – pH vil da falle kraftig hvis mer syre ble tilsatt.
Men Hvis karbonsyre kontinuerlig kunne fjernes frasystemet og bikarbonatet regenereres konstant, så kunne bufferingskapasitet og derfor pH opprettholdes til tross for fortsatt tilsetning av hydrogenioner.
Som det blir klart med flere detaljer i fysiologien tilsyrebasebalanse, det er faktisk hva som skjer i kroppen. Av karbonsyre (som karbondioksyd) og nyrene sikre kontinuerlig regenerering avbikarbonat.
denne rollen av lungene er avhengig av en singulærkarakteristisk for bikarbonatbuffersystemet, og det er evnen til karbonsyre som skal omdannes til karbondioksid ogvann.
følgende ligning skisserer forholdet mellom allelementer av bikarbonatbuffersystemet som det opererer ikropp
h+ +HCO3– ![]() H2O + CO2
H2O + CO2
Det er viktig å merke seg reaksjonene er reversible.Retning er avhengig av den relative konsentrasjonen av hverelement. Slik at for eksempel en økning i karbondioksidkonsentrasjonskrefter reaksjon til venstre med økt formasjonav karbonsyre og til slutt hydrogenioner.
dette forklarer det sure potensialet av karbondioksid og bringer oss til det viktige bidraget som lungene og røde celler gjør til total syre-basebalanse.
Lungefunksjon, transport AV CO2 og syre-basebalanse
en konstant MENGDE CO2 i blod, avgjørende for normalsyrebasebalanse, reflekterer en balanse mellom det som produseres som et resultat av vevcellemetabolismen og det som utskilles av lungene inexpired luft.
ved å variere hastigheten der karbondioksid erutskilles, regulerer lungene karbondioksidinnholdet i blodet.Sekvensen av hendelser fra karbondioksidproduksjon ivev til eliminering i utløpt luft er beskrevet I Fig. 1.Karbondioksid diffunderer ut av vevsceller til omgivelserkapillært blod (Fig. 1a). En liten andel oppløses i blodplasma og transporteres til lungene uendret.
men de fleste diffuserinn i røde celler hvor det kombinerer med vann for å danne karbonsyre.Syren dissocierer med produksjon av hydrogenioner ogbikarbonat. Hydrogenioner kombineres med deoksygenert hemoglobin (hemoglobin virker som en buffer her), forhindrer farligfall i cellulær pH, og bikarbonat diffunderer langs en konsentrasjongradient fra røde blodlegemer til plasma.
dermed mesteparten av karbondioksidetprodusert i vevet transporteres til lungene som bikarbonati blodplasma.
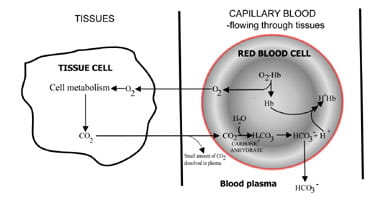
Fig. 1a. CO2 produsert i vevkonvertert til bikarbonat for transport til lungene.
|
|
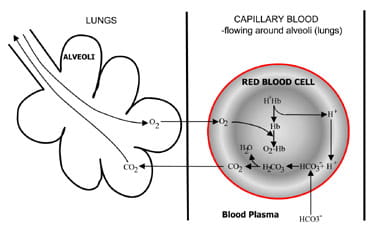
Fig. 1b. At the lungs bicarbonate convertedback to CO2 and eliminated by the lungs.
ved alveolene i lungene reverseres prosessen (Fig. 1b).Hydrogenioner er fordrevet fra hemoglobin da det tar opp oksygenfra inspirert luft. Hydrogenioner er nå bufret av bikarbonat som diffunderer fra plasma tilbake til røde blodlegemer, og karbonsyre dannes. Når konsentrasjonen av dette stiger, er detomvendt til vann og karbondioksid. Til slutt, karbon dioksiddiffuses ned en konsentrasjonsgradient fra røde blodlegemer til alveoler forutskillelse i utløpt luft.
Respiratoriske kjemoreceptorer i hjernestammen reagerer på endringeri konsentrasjonen av karbondioksid i blodet, forårsaker øktventilasjon (puste) hvis karbondioksidkonsentrasjonen stiger ogredusert ventilasjon hvis karbondioksid faller.
Nyrer og syrebasebalanse
Normal cellulær metabolisme resulterer i kontinuerlig produksjon av hydrogenioner. Vi har sett det ved å kombinere meddisse hydrogenioner minimerer bikarbonatbufferen i blodderes effekt. Imidlertid er buffering bare nyttig på kort sikt, og til slutt må hydrogenioner fjernes fra kroppen.Videre er det viktig at bikarbonatet som brukes tilbuffer hydrogenioner blir kontinuerlig erstattet.
Disse to oppgavene, eliminering av hydrogenioner og regenerering av bikarbonat, eroppnådd av nyrene. Nyretubulceller er rike påenzymkarbon anhydrase, noe som letter dannelsen av karbonsyre fra karbondioksid og vann. Karbonsyre dissosierer tobikarbonat og hydrogenioner. Bikarbonatet reabsorberes inn iblod og hydrogenioner passerer inn i lumen av tubulen oger eliminert fra kroppen i urinen.
denne urinelimineringen er avhengig av tilstedeværelsen i urin av buffere, hovedsakeligfosfat og ammoniakkioner.
FORSTYRRELSER AV SYREBASEBALANSE
de fleste syrebaseforstyrrelser skyldes
- sykdom eller skade på organer (nyre, lunger, hjerne) hvis normale funksjon er nødvendig for syrebasehomeostase,
- sykdom som forårsaker unormalt økt produksjon av metabolske syrer slik at homeostatiske mekanismer blir overveldet
- medisinsk intervensjon (f. eks. Stoffer)
Arterielle blodgasser er blodprøven som brukes til å identifisere ogovervåke syre-base forstyrrelser. Tre parametere målt underblodgassanalyse, arterielt blod pH (pH), partialtrykk av karbondioksid i arterielt blod(pCO2 (a)) ogkonsentrasjon av bikarbonat(HCO3 – – er av avgjørende betydning (Se Tabell i for referanse (normalt) område).Resultatene av disse tre tillate klassifisering av syre-basedforstyrrelser til en av fire etiologiske kategorier:
- Respiratory acidosis
- Respiratory alkalosis
- Metabolic acidosis
- Metabolic alkalosis
|
Adults |
Neonates |
|
|
pH |
7.35-7.45 |
7.30-7.40 |
|
pCO2 (kPa) |
4.7-6.0 |
3.5-5.4 |
|
Bicarbonate |
22-28 |
15-25 |
TABLE I. Omtrentlig referanse (normal)områder
for å forstå hvordan resultatene av pH, pCO2 (a)og bikarbonat brukes til å klassifisere syre-base forstyrrelser i thisway, må vi gå tilbake Til Henderson-Hasselbalch ligningen
pH = 6.1 + log (/)
vi måler pH og bikarbonat, men ikke karbonsyre(H2CO3). Det er imidlertid et forholdmellom pCO2 (a) Og H2co3 Som tillater omarbeiding Av Henderson-Hasselbalch-ligningen mellom de tre parametrene (pH, pco2 (a) ogbikarbonat) målt under blodgassanalyse:
pH = 6,1 + log (/(pCO2 (a) × 0.23))
ved å fjerne alle konstanter fra denne ligningen, kan forholdet mellom de tre målte parametrene være enklere:
pH ∝ /pCO2(a)
dette forholdet, avgjørende for en forståelse av alt som følger med hensyn til syrebaseforstyrrelser, sier at arteriellblod pH er proporsjonal med forholdet mellom bikarbonatkonsentrasjontil pCO2(a). Ph forblir normalt så lenge forholdet: pCO2 (a) forblir normalt
Årsaker til syre-base forstyrrelser
Respiratorisk acidose – (økt pCO2(a),redusert pH)
Respiratorisk acidose er preget av øktpco2 (a) på grunn av utilstrekkelig alveolær ventilasjon(hypoventilering) og følgelig redusert eliminering avco2 fra blodet. Luftveissykdom, sombronkopneumoni, emfysem, astma og kronisk obstruktiv luftveissykdom, kan alle være forbundet med hypoventilering tilstrekkelig tilforårsake respiratorisk acidose.
noen legemidler (f. eks. morfin ogbarbiturater) kan forårsake respiratorisk acidose ved å deprimereluftveiene i hjernen. Skader eller traumer på brystveggenog muskulaturen involvert i respirasjonsmekanikken kanredusere ventilasjonshastigheten. Dette forklarer respiratorisk acidosesom kan komplisere sykdomsforløpet som poliomyelitt,Guillain-Barre syndrom og utvinning fra alvorlig brysttrauma.
Respiratorisk alkalose – (redusert pco2 (a), økt pH)
i motsetning er respiratorisk alkalose preget av redusertpco2 (a) på grunn av overdreven alveolær ventilasjonog resulterer i overdreven eliminering AV CO2 fra blod.Sykdom der, på grunn av redusert oksygen i blodet (hypoksemi), detluftveiene stimuleres kan resultere i respiratorialalkalose.
Eksempler her inkluderer alvorlig anemi, lungeemboliog voksen respiratorisk syndrom. Hyperventilering tilstrekkelig tilforårsaker respiratorisk alkalose kan være en funksjon av angstangrep ogsvar på alvorlig smerte. En av de mindre velkomne egenskapene tilsalicylat (aspirin) er dens stimulerende effekt på respiratoriskesenteret. Denne effekten står for respiratorisk alkalose somoppstår etter overdosering av salicylat. Til slutt, overenthusiastiskmekanisk ventilasjon kan forårsake respiratorisk alkalose.
Metabolisk acidose – (reduserthco3 -, redusert pH)
Redusert bikarbonat er alltid en funksjon av metabolicacidose. Dette skjer av en av to grunner: økt bruk avbikarbonat ved buffering av en unormal syrebelastning eller økt tapav bikarbonat fra kroppen. Diabetisk ketoacidose og laktacidose er to forhold preget av overproduksjon av metaboliske syrer og påfølgende utmattelse av bikarbonat.
i det første tilfellet reflekterer unormalt høye blodkonsentrasjoner av ketosyrer(b-hydroksysmørsyre og acetoeddiksyre) de alvorligemetabolske forstyrrelsene som følge av insulininsuffisiens.
alle celler produserer melkesyre hvis de er mangelfull av oksygen, så økt melkesyreproduksjon og resulterende metabolicacidose oppstå i alle forhold der oksygentilførsel til vev er alvorlig kompromittert.
Eksempler er hjertestans og enhver tilstand forbundet med hypovolemisk sjokk(f. eks. massivfluidtap). Leveren spiller en viktig rolle i å fjerne den lillemengde melkesyre som produseres under normal cellemetabolisme, slik at melkesyreacidose kan være en funksjon av leverfeil.
Unormalt tap av bikarbonat fra kroppen kan forekomme underalvorlig diare. Hvis ukontrollert, kan dette føre til metabolsk acidose.Unnlatelse av å regenerere bikarbonat og skille ut hydrogenionerforklarer metabolsk acidose som oppstår i renalfeil.
Metabolsk alkalose – (økthco3 -, økt pH)
Bikarbonat økes alltid i metabolsk alkalose. Sjelden kan overdreven administrering av bikarbonat eller inntak av bikarbonatinantacidpreparat forårsake metabolsk alkalose, men dette ervanligvis forbigående. Unormalt tap av hydrogenioner fra kroppen kanvære det primære problemet. Bikarbonat som ellers ville bli konsumert i buffering av disse tapte hydrogenioner følgelig akkumuleres i blod. Magesaft er sur og gastriskaspirasjon eller en sykdomsprosess der mageinnhold ertapt fra kroppen representerer et tap av hydrogenioner.
Denprojektil oppkast av magesaft forklarer for eksempelmetabolisk alkalose som kan oppstå hos pasienter med pyloricstenose. Alvorlig kaliumutarmning kan forårsake metabolsk alkalosepå grunn av det gjensidige forholdet mellom hydrogen og kaliumioner.
Kompensasjon-en konsekvens av syrebaseforstyrrelse
det er viktig for livet at pH ikke frafaller for langt fra normalt,og kroppen vil alltid forsøke å returnere en unormal pH motnormal når syrebasebalansen forstyrres. Kompensasjon ernavn gitt til denne livsbevarende prosessen. For å forståkompensasjon, er det viktig å huske at pH styres av theratio: pCO2 ( a). Så lenge forholdet er normalt, vil pH være normalt.
Vurder pasienten med metabolsk acidose hvis pH er lavfordi bikarbonat er lavt. Tocompensate for lav og restaureredet viktige forholdet mot normal pasienten må senke hispCO2 (a). Kjemoreceptorer i luftveiensentrum av hjernen reagerer på en stigende hydrogenionkonsentrasjon (lav pH), noe som forårsaker økt ventilasjon (hyperventilering) ogdermed økt eliminering av karbondioksid; denpco2 (a) faller og forholdet: pCO2 (a) returnerermot normal.
Kompensasjon for metabolsk alkalose som er høy, derimot, innebærerdepresjon av respirasjon og dermed retensjon av karbondioksidslik at pCO2 (a) stiger for å matche økningeni . Men depresjon avåndedrett har den uvelkomne bivirkningen av truende tilstrekkeligoksygenering av vev. Av denne grunn respiratorisk kompensasjon avmetabolisk alkalose er begrenset.
Primære forstyrrelser av pCO2 (a) (respiratoryacidose og alkalose) kompenseres ved renal justering av utskillelse av hydrogenion som resulterer i endringer som kompenserer hensiktsmessig for primær endring i pCO2 (a). Renalkompensasjon for respiratorisk acidose (raisedpCO2(a)) innebærer økt reabsorpsjon av bikarbonat, og renal kompensasjon for respiratorisk alkalose(redusert pCO2(a)) innebærer redusert bikarbonatereabsorpsjon.
begrepet syrebasebalanse under kompensasjonoverføres visuelt I Fig. 2. Tabell II oppsummerer blodgassenresultater som karakteriserer alle fire syrebaseforstyrrelser førog etter kompensasjon.
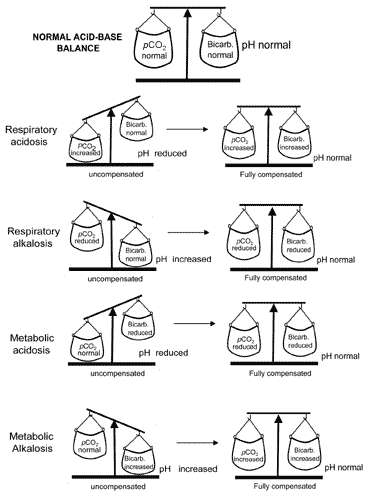
Fig. 2. «Syrebasebalansen» : compensationrestores normal pH
|
Primary disturbance |
||||
|
Respiratory |
Repiratory |
Metabolic |
Metabolic |
|
|
Some |
Emphysema |
Hyper- |
Renal failure |
Bicarbonate Potassium |
|
Compen- |
RENAL |
RENAL |
RESPIRA- |
RESPIRA- |
|
Initial blood |
pH |
pH |
pH |
pH |
|
Blood gas |
ph pCO2 |
pH pco2 |
ph pco2 |
begrenset |
|
Blood gas |
pH normal |
pH normal |
pH normal |
Limited |
Printfriendly versjon av tabellen, pdf.
TABELL II. blodgass resulterer i forstyrrelser avsyrebasebalanse
Respiratorisk kompensasjon for en primær metabolsk forstyrrelseskjer mye raskere enn metabolsk (renal) kompensasjon for aprimær respiratorisk forstyrrelse. I andre tilfelle kompensasjonskjer over dager i stedet for timer.
hvis kompensasjon resulterer iretur av pH til normal, sies pasienten å være fullkompensert. Men i mange tilfeller kompensasjonen returnerer pHtowards normal uten faktisk å oppnå normalitet; i slike tilfellerpasienten sies å være delvis kompensert.
Forgrunner beskrevet ovenfor er metabolsk alkalose svært sjelden fulltkompensert.
Blandede syrebaseforstyrrelser
det kan antas fra ovennevnte diskusjon atalle pasienter med syrebaseforstyrrelser lider av bare en avfire kategorier av syrebasebalanse. Dette kan godt være tilfelle, men i spesielle tilfeller kan pasienter presentere med mer ennen forstyrrelse.
for eksempel vurdere pasienten med en kronisklungesykdom som emfysem som har en langvarig delviskompensert respiratorisk acidose. Hvis denne pasienten også var adiabetisk som ikke hadde tatt sin normale insulindose og som et resultat var i en tilstand av diabetisk ketoacidose, ville blodgassresultater gjenspeile den kombinerte effekten av både respiratorisk acidose og metabolisk acidose.
slike blandede syrebaseforstyrrelser er ikkehyppige og kan være vanskelige å løse på grunnlag av arterielle blodgassresultater alene.
Sammendrag
vedlikehold av normalt blod pH innebærer flere organsystemerog avhenger av sirkulasjonsintegritet. Det er ikke overraskende daat forstyrrelsen av syrebasebalanse kan komplisere løpet avmye varierte sykdommer samt traumer til mange deler avkroppen. Kroppen har betydelig kraft til å bevare blodets pH, ogforstyrrelser innebærer vanligvis enten alvorlig kronisk sykdom eller akuttkritisk sykdom.
resultatene av arteriell blodgassanalyse kanidentifisere syre-base forstyrrelse og gi verdifull informasjon somtil årsaken.
noen foreslo viderelesing
- Thomson WST, Adams JF, Cowan RA. Klinisk syrebasebalanse. Oxford: Oxford Medisinske Publikasjoner 1997
- Harrison RA. Syrebasebalanse. Respir Care Clin N. Amerika 1995; 1,1: 7-21
- Woodrow P. Arteriell blodgassanalyse. Sykepleie Standard 2004; 18,21: 45-52
- Sirkler AA, Rhodes A, Gounds RM, Bennet ED. Syrebasefysiologi: den ‘tradisjonelle’ og den ‘moderne’ tilnærmingen. Anestesi 2002; 57: 348-56