9.5 Brudd På Oktettregelen
Læringsmål
- Gjenkjenne de tre hovedtyper av brudd på oktettregelen.
så viktig og nyttig som oktettregelen er i kjemisk binding, er det noen kjente brudd. Dette betyr ikke at oktettregelen er ubrukelig-tvert imot. Som med mange regler, er det unntak eller brudd.
det er tre brudd på oktettregelen. Odd-elektronmolekyleret molekyl med et oddetall antall elektroner i valensskallet til et atom. representer det første bruddet på oktettregelen. Selv om de er få, har noen stabile forbindelser et merkelig antall elektroner i deres valensskjell. Med et merkelig antall elektroner må minst ett atom i molekylet bryte oktettregelen. Eksempler på stabile odd-elektronmolekyler ER NO, NO2 og ClO2. Lewis electron dot-diagrammet for NO er som følger:
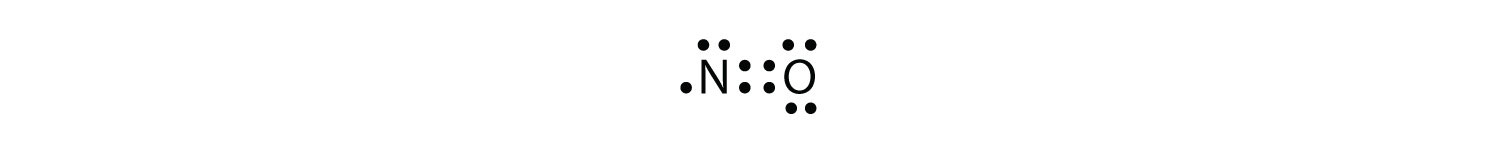
Selv Om o-atomet har en oktett av elektroner, Har N-atomet bare syv elektroner i valensskallet. SELV OM NO er en stabil forbindelse, er DEN svært kjemisk reaktiv, som er de fleste andre odde-elektronforbindelser.
Elektron-mangelfulle molekyleret molekyl med mindre enn åtte elektroner i valensskallet til et atom. representer det andre bruddet på oktettregelen. Disse stabile forbindelsene har mindre enn åtte elektroner rundt et atom i molekylet. De vanligste eksemplene er kovalente forbindelser av beryllium og bor. For eksempel kan beryllium danne to kovalente bindinger, noe som resulterer i bare fire elektroner i valensskallet:
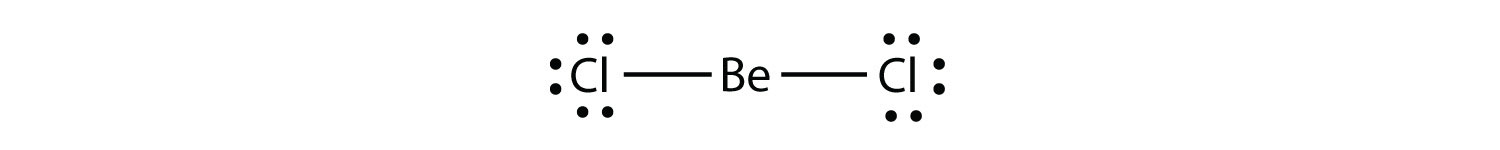
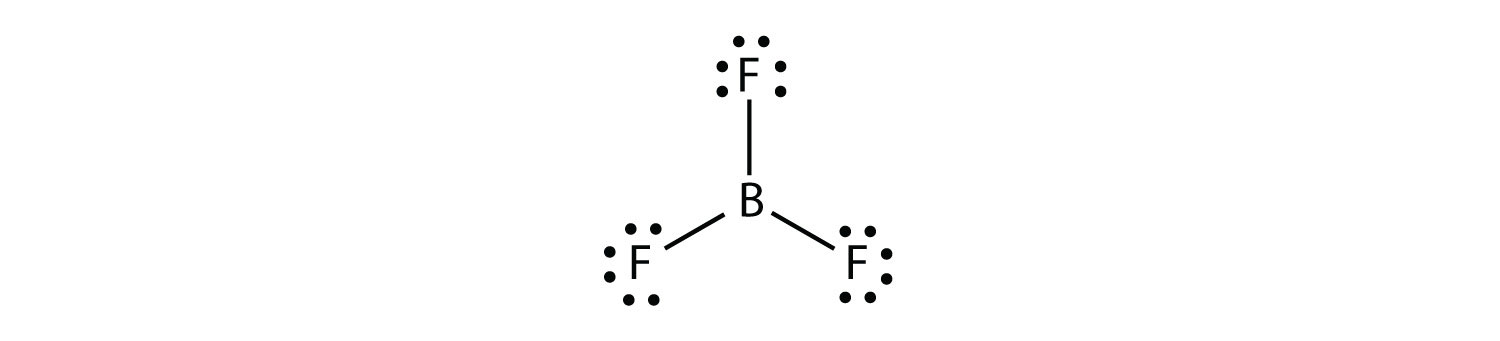
Bor gjør vanligvis bare tre kovalente bindinger, noe som resulterer i bare seks valenselektroner rundt b-atomet. ET velkjent eksempel ER BF3:
det tredje bruddet på oktettregelen er funnet i de forbindelsene med mer enn åtte elektroner tilordnet deres valensskall. Disse kalles utvidede valensskallmolekyleret molekyl med mer enn åtte elektroner i valensskallet til et atom.. Slike forbindelser dannes bare av sentrale atomer i tredje rad i det periodiske bordet eller utover som har tomme d-orbitaler i deres valensskjell som kan delta i kovalent binding. EN slik forbindelse er PF5. Det eneste rimelige Lewis electron dot-diagrammet for denne forbindelsen har p-atomet som gjør fem kovalente bindinger:
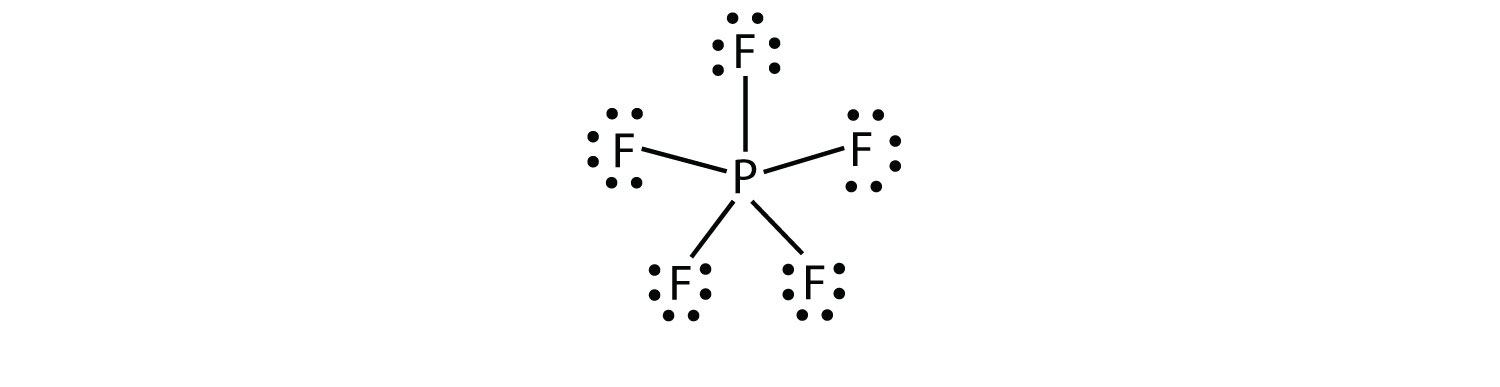
Formelt har p-atomet 10 elektroner i valensskallet.
Eksempel 9
Identifiser hvert brudd på oktettregelen ved å tegne Et Lewis electron dot-diagram.
- CLO
- SF6
Løsning
-
med ett cl-atom og Ett o-atom har dette molekylet 6 + 7 = 13 valenselektroner, så det er et odde-elektronmolekyl. Et Lewis electron dot-diagram for dette molekylet er som følger:

-
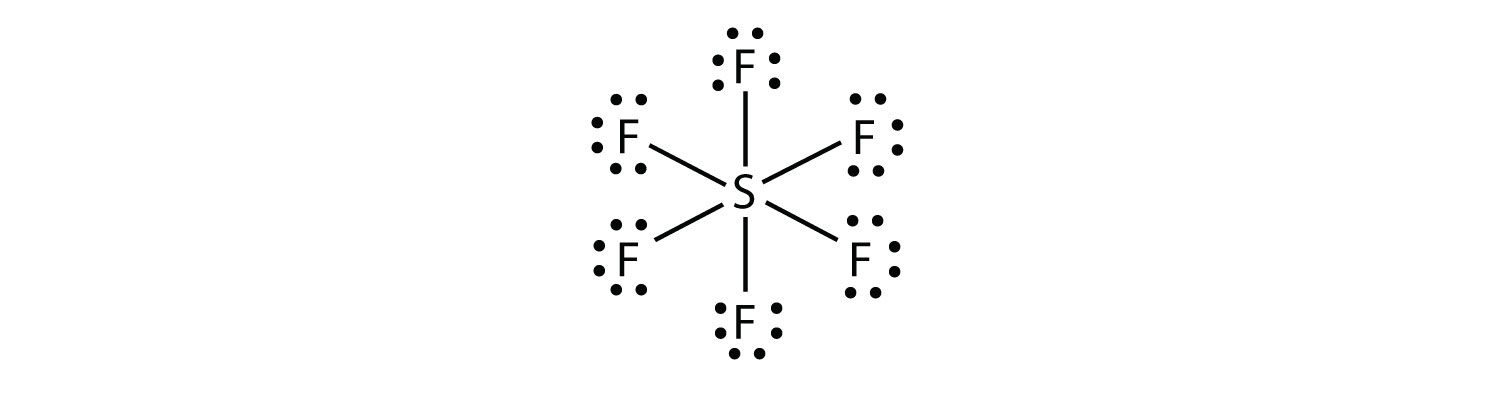
I SF6 lager det sentrale s-atom seks kovalente bindinger til de seks omkringliggende f-atomer, så det er et utvidet valensskallmolekyl. Dens Lewis electron dot diagram er som følger:
Test deg selv
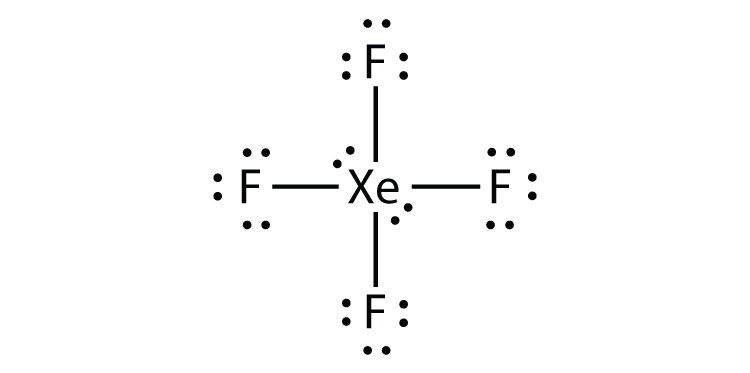
Identifiser brudd på oktettregelen I XeF2 ved å tegne Et Lewis electron dot-diagram.
Svar
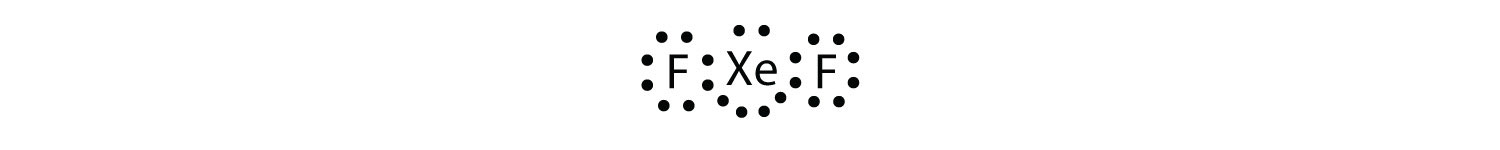
xe-atomet har et utvidet valensskall med mer enn åtte elektroner rundt det.
Nøkkel Takeaway
- det er tre brudd på oktett regelen: odd-elektron molekyler, elektron-mangelfull molekyler og utvidet valens shell molekyler.
Øvelser
-
Hvorfor kan et odd-elektronmolekyl ikke tilfredsstille oktettregelen?
-
Hvorfor kan et atom i den andre raden i det periodiske bordet ikke danne utvidede valensskallmolekyler?
-
Tegn et akseptabelt Lewis electron dot-diagram for disse molekylene som bryter oktettregelen.
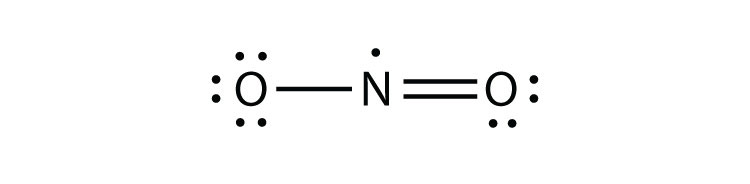
- NO2
- XeF4
-
Tegn et Akseptabelt Lewis electron dot-diagram for disse molekylene som bryter oktettregelen.
- BCl3
- ClO2
-
Tegn et Akseptabelt Lewis electron dot-diagram for disse molekylene som bryter oktettregelen.
- POF3
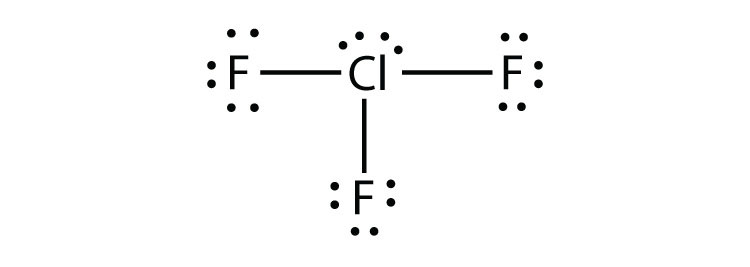
- ClF3
-
Tegn et Akseptabelt Lewis electron dot-diagram for disse molekylene som bryter oktettregelen.
- SF4
- BeH2
Svar
-
det er ingen måte alle elektroner kan sammenkobles hvis det er et oddetall av dem.
-
-
-
-