一般名:terbutaline硫酸塩
適量形態:注入、解決
医学的に見直されるDrugs.com最終更新日は2020年9月1日です。
- 概要
- 副作用
- 投与量
- プロフェッショナル
- 相互作用
- 詳細
皮下注射のための滅菌水溶液
Rxのみ
警告:長期TOCOLYSIS
テルブタリン硫酸は承認されておらず、長期tocolysisのために使用すべきではない(48-72時間を超えて)。 特に、Terbutalineの硫酸塩は外来患者か家の設定で維持のtocolysisに使用されるべきではないです。 重篤な副作用は、死亡を含む、妊娠中の女性への硫酸テルブタリンの投与後に報告されています。 母親では、これらの有害反応には、心拍数の増加、一過性高血糖、低カリウム血症、心臓不整脈、肺水腫および心筋虚血が含まれる。 胎児の心拍数の増加および新生児の低血糖は、母体投与の結果として起こり得る(禁忌を参照:延長されたTocolysis)。
Terbutalineの記述
TERBUTALINEの硫酸塩、USPのTerbutalineの硫酸塩の注入、USPの有効成分は、subcutaneous管理のためにガラスびんの生殖不能、nonpyrogenic、水溶液として利用できるベータadrenergicアゴニストのbronchodilator、です。 解決の各ミリリットルはTerbutalineの硫酸塩の1mg、USP(自由な基盤の0.82mg)、等張性のための塩化ナトリウム、安定の代理店として0.055%のedetateの二ナトリウムの二水和物、および4のターゲットpHに調節のための塩酸を含んでいます。 テルブタリン硫酸は、(±)-a–3,5-ジヒドロキシベンジアルコール硫酸(2:1)(塩)。 分子方式は(C12H19N03)2•H2SO4であり、構造方式は次のとおりです:
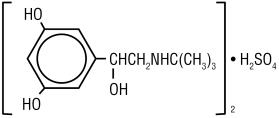
Terbutalineの硫酸塩、uspは灰白色の結晶の粉 それは無臭であるか、または酢酸のかすかな臭気があります。 それは水と0.1N塩酸で溶け、メタノールでわずかに溶け、クロロホルムで不溶解性です。 その分子量は548.65です。
Terbutaline-臨床薬理学
terbutalineの硫酸塩の注入はベータadrenergic受容器のアゴニストです。 In vitroおよびin vivoのpharmacologic調査はTerbutalineがbeta2adrenergic受容器に対する優先効果を出すことを示しました。 Β2-アドレナリン作動性受容体は気管支平滑筋における優勢な受容体であることが認識されているが、データは、10%から50%の間の濃度で存在するヒトの心 これらの受容体の正確な機能は確立されていない(警告を参照)。 テルブタリンを皮下投与された患者における制御された臨床試験では、優先的なβ2-アドレナリン作動性効果は明らかにされていない。
テルブタリンを含むβ-アドレナリン作動薬の薬理学的効果は、少なくとも部分的には、アデノシン三リン酸(ATP)の環状3′,5′-アデノシン一リン酸(cAMP)への変換を触媒する酵素である細胞内アデニルシクラーゼのβ-アドレナリン作動性受容体を介した刺激に起因する。 増加したcAMPレベルは、気管支平滑筋の弛緩および細胞、特に肥満細胞からの即時過敏症のメディエーターの放出の阻害と関連している。
制御された臨床研究では、硫酸テルブタリン注射は、肺流量を有意に増加させる(例えば、FEV1の15%以上の増加)ことにより、急性および慢性閉塞性肺疾患の気管支痙攣を軽減することが示されている。 テルブタリン硫酸注射0.25mgの皮下投与後、呼気流量の測定可能な変化は通常5分以内に起こり、FEV1の臨床的に有意な増加は15分以内に起こる。 最大の効果は通常30-60分以内に起こり、臨床的に有意な気管支拡張剤活性は1.5-4時間続くことがある。 臨床的に有意な改善の持続時間は、エピネフリンの等ミリグラム用量で観察されたものと同等である。
前臨床
実験動物(minipigs、げっ歯類、およびイヌ)における研究では、βアゴニストとメチルキサンチンを同時に投与すると、心臓不整脈および突然死(心筋壊死の組織学的証拠を有する)の発生が実証されている。 これらの所見の臨床的意義は不明である。
薬物動態
0.5mgのテルブタリン硫酸の皮下投与17健康な、成人、男性被験者に9.6(3.6)ng/mLの平均(SD)ピーク血漿テルブタリン濃度をもたらし、投与後0.5(0.08-1.0)時間の中央値(範囲)で観察された。 平均(SD)AUC(0〜48)および総体クリアランス値は、それぞれ29.4(14.2)hr•ng/mLおよび311(112)mL/分であった。 終末半減期は9の17の被験者で決定され、5.7(2.0)時間の平均(SD)を有していた。
二つの男性被験者に硫酸テルブタリンの0.25mgの皮下投与後、5.2と5.3ng/mLのピークテルブタリン血清濃度は、投与後約20分で観察された。
10人の14人の患者における薬物の排除半減期は、皮下投与後約2.9時間であったが、他の4人の患者ではより長い排除半減期(6-14時間)が見られた。 薬物の約90%が皮下投与後96時間で尿中に排泄され、この約60%は未変化の薬物であった。 硫酸塩の共役がTerbutalineの主要な代謝物質であり、尿の排泄物が除去の第一次ルートであることがようです。
Terbutalineのための徴候そして使用法
Terbutalineの硫酸塩の注入、USPは気管支炎および気腫と関連付けられる喘息およびリバーシブルのbronchospasmとの12歳およびより古い患者のbronchospasmの防止そして逆転のために示されます。
禁忌
1. 延長されたTocolysis
Terbutalineの硫酸塩は承認されなかったし、延長されたtocolysisに使用するべきではないです(48-72時間を越えて)。 特に、Terbutalineの硫酸塩は外来患者または家の設定で維持のtocolysisに使用するべきではないです(箱に入れられた警告を見て下さい:延長されたTocolysis)。
2. 過敏症
テルブタリン硫酸注射は、交感神経アミンまたはこの薬物製品のいずれかの成分に過敏であることが知られている患者には禁忌である。
警告
喘息の悪化
喘息は、時間の期間にわたって急性または数日以上にわたって慢性的に悪化することがあります。 患者が通常よりTerbutalineの硫酸塩のより多くの線量を必要とすれば、これは喘息の不安定化のマーカーで、炎症抑制の処置、例えば、副腎皮質ホルモンのための可
抗炎症薬の使用
β-アドレナリン作動薬気管支拡張薬単独の使用は、多くの患者において喘息を制御するのに十分ではない可能性がある。 早期の検討は、抗炎症剤、例えば、コルチコステロイドを添加することに与えられるべきである。
心血管の効果
テルブタリン硫酸塩は、他のすべてのベータadrenergicアゴニストのように、脈拍数、血圧、および/または徴候によって測定されるように何人かの患者の臨床的に重要な心血管の効果を作り出すことができます。 このような効果は、推奨用量でテルブタリン硫酸の投与後にはまれであるが、それらが発生した場合、薬物を中止する必要があるかもしれない。 さらに、β-アゴニストは、T波の平坦化、Qtc間隔の延長、およびSTセグメントの抑制などの心電図(ECG)変化を生じることが報告されている。 これらの所見の臨床的意義は不明である。 従って、Terbutalineの硫酸塩は、すべてのsympathomimeticアミンのように、心血管の無秩序、特に冠状不十分、心臓不整脈および高血圧の患者で注意して使用されるべきです。
発作
テルブタリンを受けている患者では発作のまれな報告がありました。
使用上の注意
一般
テルブタリンは、すべての交感神経アミンと同様に、虚血性心疾患、高血圧、心臓不整脈を含む心血管障害の患者、甲状腺機能亢進症または糖尿病の患者、および交感神経アミンに異常に反応する患者、または痙攣性障害を有する患者には注意して使用する必要があります。 収縮期血圧および拡張期血圧の有意な変化が見られており、β-アドレナリン作動性気管支拡張薬の使用後に一部の患者で起こると予想され得る。
テルブタリン投与後、即時の過敏反応および気管支痙攣の悪化が報告されている。
ベータadrenergicアゴニストの薬物は不利な心血管の効果を作り出す潜在性がある細胞内の分路によって何人かの患者の重要なhypokalemiaを、多分作り出すかもし 減少は通常一過性であり、補充を必要としない。
大量のテルブタリンの静脈内投与は、既存の真性糖尿病およびケトアシドーシスを悪化させることが報告されている。
薬物相互作用
心血管系への複合効果が患者に有害である可能性があるため、他の交感神経作用剤とのテルブタリン硫酸注射の併用はお
モノアミンオキシダーゼ阻害剤または三環系抗うつ薬:テルブタリンは、モノアミンオキシダーゼ阻害剤または三環系抗うつ薬で治療されている患者には細心の注意を払って投与すべきであり、または血管系に対するテルブタリンの作用が増強される可能性があるため、そのような薬剤の中止から2週間以内に投与されるべきである。
ベータ遮断薬: Β-アドレナリン受容体遮断剤は、硫酸テルブタリン注射などのβ-アゴニストの肺効果を遮断するだけでなく、喘息患者に重度の気管支痙攣を生じる可能性がある。 したがって、喘息患者は、通常、β遮断薬で治療すべきではない。 しかしながら、特定の状況下では、例えば、心筋梗塞後の予防として、喘息患者におけるβ−アドレナリン作動性遮断剤の使用に対する許容可能な代 この設定では、心臓選択的β遮断薬を考慮することができますが、注意して投与する必要があります。
利尿薬:非カリウム温存利尿薬(ループまたはチアジド利尿薬など)の投与に起因する可能性のあるECGの変化および/または低カリウム血症は、特にベータアゴニストの推奨用量を超えた場合に、ベータアゴニストによって急激に悪化する可能性がある。 これらの効果の臨床的意義は知られていないが、β-アゴニストと非カリウム温存利尿薬との同時投与には注意が必要である。
発癌、変異誘発、生殖能力の障害
Sprague-Dawleyラットにおける2年間の研究では、硫酸テルブタリンは、50mg/kg以上の食事用量でメソバリウムの良性平滑筋腫の発生率の有意かつ用量関連の増加を引き起こした(成人の最大推奨日皮下(sc)用量の約810倍mg/m2ベース)。 CD-1マウスの21ヶ月の研究では、硫酸テルブタリンは、200mg/kgまでの食事用量で腫瘍形成性の証拠を示さなかった(成人の最大推奨日sc用量の約1,600倍、mg/m2ベース)。 硫酸テルブタリンの変異原性ポテンシャルは決定されていない。
硫酸テルブタリンを用いたラットの生殖研究では、50mg/kgまでの経口用量では生殖能力の障害は示されなかった(成人の最大推奨日sc用量の約810倍、mg/m2ベース)。
妊娠-催奇形性効果
妊娠カテゴリC
妊娠中の女性における硫酸テルブタリンの適切かつ十分に制御された研究はありません。 公表された動物研究は、ラットの子孫が、妊娠および授乳期間の後期にDamsをテルブタリンで皮下に処理したときの細胞増殖および分化の減少を含む行動および脳発達の変化を示すことを示している。 ラットダムにおけるテルブタリン曝露は、成人における一般的なヒト用量の約24-48倍であり、2-4mg/日、mg/m2ベースであった。
terbutaline硫酸塩は承認されておらず、長期間のtocolysis(48-72時間を超えて)に使用すべきではありません。 特に、Terbutalineの硫酸塩は外来患者か家の設定で維持のtocolysisに使用されるべきではないです。 重篤な副作用は、死亡を含む、妊娠中の女性への硫酸テルブタリンの投与後に報告されています。 母親では、これらの有害反応には、心拍数の増加、一過性高血糖、低カリウム血症、心臓不整脈、肺水腫および心筋虚血が含まれる。 胎児の心拍数の増加および新生児の低血糖は、母体投与の結果として生じることがある(箱入りの警告:長期のTocolysisおよび禁忌:長期のTocolysisを参照)。
動物胚性発育研究では、妊娠ラットおよびウサギが50mg/kg/日までの経口用量でテルブタリン硫酸塩をそれぞれ約810および1,600回、mg/m2ベースで成人の最大推奨皮下用量で投与された場合、子孫に催奇形性効果は観察されなかった。
Terbutaline sulfateは、潜在的な利益が胎児への潜在的なリスクを正当化する場合にのみ、妊娠中に使用する必要があります。
労働および配達の使用
子宮のcontractilityのベータアゴニストの干渉のための潜在性のために、労働の間のbronchospasmの救助のためのTerbutalineの硫酸塩の注入の使用は利
テルブタリンは胎盤を横切る。 臨床理由による選択的な帝王切開によって渡された妊娠後期の22人の女性へのTerbutalineの単一の線量IVの管理の後でTerbutalineの臍の血レベルは母性的な血レベルの11%から48%の範囲に見つけられました。
授乳中の母親
この薬が母乳中に排泄されるかどうかは知られていません。 したがって、潜在的な利益が新生児への可能性のあるリスクを正当化する場合にのみ、授乳中にテルブタリン硫酸注射を使用すべきである。
小児用
テルブタリン硫酸注射は、安全性と有効性を確立するための臨床データが不十分であるため、12歳未満の患者には推奨されません。
高齢者の使用
テルブタリン硫酸注射の臨床研究には、65歳以上の被験者が若い被験者とは異なる反応を示すかどうかを判断するのに十分な数が含まれていませんでした。 他の報告された臨床経験は、高齢者と若年患者の間の反応の違いを同定していない。 一般に、高齢の患者のための用量選択は、通常、投与範囲の下限から始まり、肝臓、腎臓、または心機能の低下、および付随する疾患または他の薬物療法の頻度の増加を反映して、慎重でなければならない。
有害反応
硫酸テルブタリン注射で観察される有害反応は、他の交感神経刺激薬で一般的に見られるものと類似しています。 これらの反応はすべて本質的に一過性であり、通常は治療を必要としない。
以下の表は、テルブタリン硫酸注射(0.25mgおよび0.5mg)で治療された患者に見られる有害反応と、エピネフリン注射(0.25mgおよび0.5mg)で治療された患者に見られる有害反応を比較したもので、合計214人の患者を含む二重盲検クロスオーバー研究において行われた。
| Incidence (%) of Adverse Reactions | |||||
| Terbutaline (%) | Epinephrine (%) | ||||
|
0.25 mg |
0.5 mg N = 205 |
0.25 mg N = 153 |
0.5 mg N = 61 |
||
| Reaction Central Nervous System |
|||||
| Tremor | 7.8 | 38.0 | 16.3 | 18.0 | |
| Nervousness | 16.9 | 30.7 | 8.5 | 31.1 | |
| Dizziness | 1.3 | 10.2 | 7.8 | 3.3 | |
| Headache | 7.8 | 8.8 | 3.3 | 9.8 | |
| Drowsiness | 11.7 | 9.8 | 14.4 | 8.2 | |
| Cardiovascular | |||||
| Palpitations | 7.8 | 22.9 | 7.8 | 29.5 | |
| Tachycardia | 1.3 | 1.5 | 2.6 | 0.0 | |
| Respiratory | |||||
| Dyspnea | 0.0 | 2.0 | 2.0 | 0.0 | |
| Chest discomfort | 1.3 | 1.5 | 2.6 | 0.0 | |
| Gastrointestinal | |||||
| Nausea/vomiting | 1.3 | 3.9 | 1.3 | 11.5 | |
| Systemic | |||||
| Weakness | 1.3 | 0.5 | 2.6 | 1.6 | |
| Flushed feeling | 0.0 | 2.4 | 1.3 | 0.0 | |
| Sweating | 0.0 | 2.4 | 0.0 | 0.0 | |
| Pain at injection site | 2.6 | 0.5 | 2.6 | 1.6 | |
注:一部の患者は、複数の用量の強さを受けましたテルブタリン硫酸塩およびエピネフリン。 さらに、不安、筋肉痙攣、口渇の報告がありました(<0.5%)。 肝臓酵素の上昇およびテルブタリン投与による過敏性血管炎のまれな報告があった。
有害反応の疑いを報告するには、Hikma Pharmaceuticals USA Inc.にお問い合わせください。. 1-877-233-2001で、または1-800-FDA-1088のFDAまたはwww.fda.gov/medwatch成熟ラットにおける硫酸テルブタリンのsc致死量の中央値は約165mg/kgであった(成人の最大推奨日sc投与量の約2,700倍mg/m2ベース)。
過剰投与
成熟ラットにおける硫酸テルブタリンのsc致死量の中央値は、約165mg/kgであった(成人の最大推奨日sc投与量の約2,700倍mg/m2ベース)。 若いラットにおけるテルブタリン硫酸塩のsc致死量の中央値は、約2,000mg/kgであった(約32,000mg/m2ベースで成人の最大推奨日sc用量の倍)。
過剰投与で予想される症状は、過剰なβアドレナリン刺激および/または副作用の下に記載されている症状のいずれかの発生または誇張のものであり、例えば、発作、狭心症、高血圧または低血圧、毎分200拍までの頻脈、不整脈、緊張、頭痛、振戦、口渇、動悸、吐き気、めまい、疲労、倦怠感、および不眠症である。 低カリウム血症も発生する可能性があります。 特定の解毒剤はありません。 治療は、適切な対症療法と一緒にテルブタリン硫酸注入の中止からなる。 心臓選択的β受容体遮断薬の賢明な使用は、そのような薬物が気管支痙攣を引き起こす可能性があることを念頭に置いて考慮することができる。 透析がTerbutalineの硫酸塩の注入のoverdosageのために有利であるかどうか定める不十分な証拠があります。
テルブタリンの投与量および投与
バイアルは、皮下投与にのみ使用し、静脈内注入には使用しないでください。
バイアルが投与量および投与量に従って使用されていない場合、無菌性および正確な投与は保証されない。
単一の患者の使用の後で未使用の部分を捨てて下さい。
テルブタリン硫酸注射の通常の皮下投与量は、側方三角筋領域に0.25mg注入される。 重大な臨床改善が15から30分以内に起こらなければ、0.25mgの第2線量は管理されるかもしれません。 患者が別の15から30分以内に答えなければ他の治療上の手段は考慮されるべきです。 4時間以内の総投与量は0.5mgを超えてはならない。
注:非経口医薬品は、溶液および容器が許可するときはいつでも、投与前に粒子状物質および変色について視覚的に検査する必要があります。
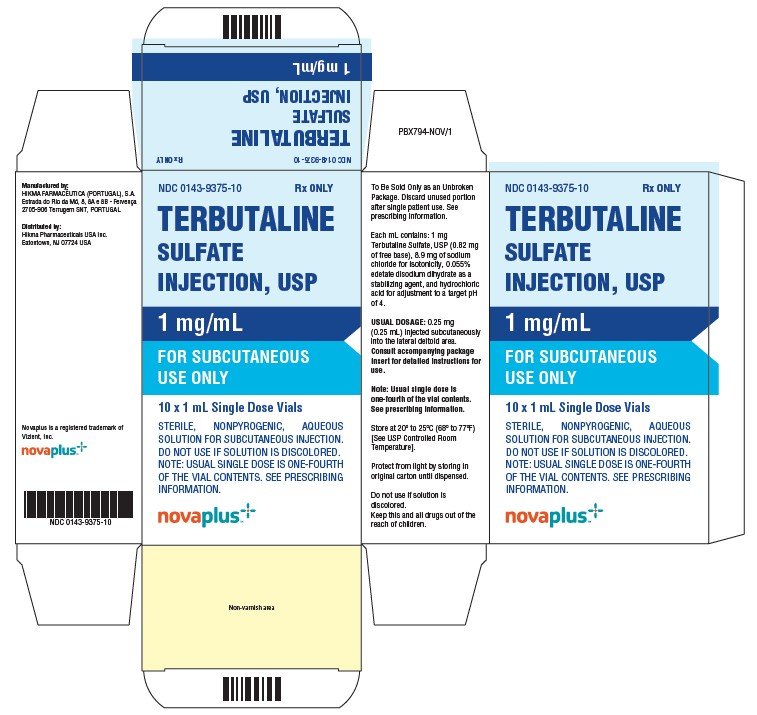
テルブタリンの供給方法
テルブタリン硫酸注射、USP、1mg/mLは、1mLの琥珀色のガラスバイアルに含まれる2mLの容量で供給されます。 各ガラスびんは解決の1つのmLごとのTerbutalineの硫酸塩の1mgを含んでいます;解決の0.25mLは0.25mgの通常の臨床線量を提供します。NDC0143-9375-10 10バイアルのカートン。
20°25°C(68°77°F)で保管してください。
20°25°C(68°77°F)で保管してください。
分配されるまで元のカートンでガラスびんを貯えることによってライトから保護して下さい。
溶液が変色している場合は使用しないでください。
単一の患者の使用の後で未使用の部分を捨てて下さい。 によって製造された
:
HIKMA FARMACÚUTICA(ポルトガル),S.A..
Estrada do Rio da Mó,n º8,8A e8B-Fervença,
2705–906Terrugem SNT,
PORTUGAL
Distributed by:
Hikma Pharmaceuticals USA Inc.
Eatontown,NJ07724USA
NovaplusはVizient,Inc.の登録商標です。
改訂: 2020年10月
PIN552-NOV/2
主な表示パネル
Ndc0143-9375-01Rxのみ
テルブタリン
硫酸塩
注射、USP
皮下用1mg/mL
使用のみ

主な表示パネル
Ndc0143-9375-01Rxのみ
テルブタリン
硫酸塩
注射、USP
皮下用1mg/mL

主な表示パネル
主な表示パネル
パネル
ndc0143-9375-10rxのみ
テルブタリン
硫酸
注射、USP
1mg/ml
皮下用
使用のみ
10X1ml単回投与バイアル
無菌、非pyrogenic、水性
皮下注射用溶液。
溶液が変色している場合は使用しないでください。
注:通常の単回投与量は、バイアル内容物の四分の一です。
SEE PRESCRIBING
INFORMATION.
SERIALIZATION IMAGE
| Terbutaline SULFATE Terbutaline sulfate injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Hikma Pharmaceuticals USA Inc. (001230762)
登録者-HIKMA FARMACEUTICA(PORTUGAL),S.A.(452742943)
テルブタリンについての詳細
- 副作用
- 妊娠中または授乳中
- 投与量情報
- 薬物画像
- 薬物相互作用
- 代替案を比較
- 価格&クーポン
- 英語で
- 11レビュー
- 11レビュー
- 11レビュー
- 11レビュー
- 11レビュー
- 11レビュー
- 10レビュー
- 10レビュー
- 10レビュー
- 10レビュー
- 10レビュー
- 10レビュー
- 10レビュー
- 薬物クラス: アドレナリン作動性気管支拡張薬
- FDAアラート(1)
/li>
消費者リソース
- 患者情報
- テルブタリン(高度な読み取り)
- テルブタリン皮下(高度な読み取り)
プロフェッショナルリソース
- 処方情報
- テルブタリン(専門的な患者のアドバイス)
- テルブタリン(専門的な患者のアドバイス)
- テルブタリン錠(fda)
関連治療ガイド
- 早産
- アレルギー喘息
- 喘息、メンテナンス
- 喘息、急性
医療免責事項