筋可塑性
骨格筋は体内で最大の組織である。 それは非常にプラスチックで、環境の影響の無数に応じて固まりおよび強さ両方の劇的な非病理学の振動を経ることができます。 同化ステロイドホルモンへの抵抗の練習か露出の後で、筋肉は肥大を経、固まり、横断面区域および強さを高めます(Aagaard、2004年; Schiaffino et al., 2013). これらの同じパラメータは、飢餓、脱神経、固定化、敗血症、癌悪液質、心不全、糖尿病、腎不全、慢性閉塞性肺障害、および後天性免疫不全症候群(Schiaffino e t a l., 2013).
萎縮の結果は、健康に明らかな影響を与えます。 筋肉の衰弱は、死亡率および罹患率の両方の主要な要因であり、すべての死因のリスク増加と関連している(Metter et al., 2002). 実際、癌悪液質における筋萎縮を減少させることは、寿命を有意に延長することができる(Zhou e t a l., 2010). 同様に、多くの高齢者は、典型的には50歳の後に始まり、年間筋肉量の約1%の損失を伴う長期にわたる筋肉消耗障害であるサルコペニアに罹患している(Woo、2017)。 これは、80歳までに、筋萎縮性側索硬化症の個人が筋肉量の約40%を失い、転倒、虚弱、および老人ホームの入院の重要な要因となったことを意味します。 その結果、萎縮に対するメカニズムおよび潜在的な治療応答を理解することは、広範な基本的および臨床的関心事である(Ali and Garcia,2014;Cohen et al. ら,2 0 1 5;Ziaaldiniら,2 0 1 5;Smith e t a l., 2017).
筋核ドメイン仮説
骨格筋は、成熟した細胞が合胞体であり、何百もの核を含むことができるという点でかなりユニークです。 これは、個々の筋繊維が巨大であり得、最大〜6 0 0mm(2 3インチ)の長さを達成することを考えると、必要な適応である(例えば、sartorius muscle;Yang e t a l. ら、1 9 9 8)および典型的な単核細胞よりも1 0 0,0 0 0倍以上大きくなり得る体積(Bruusgaard e t a l.,1 9 9 8)を含む。, 2003). 複数の核からの寄与は、収縮装置を生成し維持するのに必要な驚異的なタンパク質合成を指示するのに必要な大量のmRNAを生成するために必要とさ, 2013).
筋肉の塑性的性質とその合胞体組織の両方が、最近解決されたように見える論争を引き起こしている—”myonuclear domain hypothesis”(Qaisar and Larsson、2014;Gundersen、2016;Schwartz et al。, 2016). この理論は、Strassburger(1893)によって提案された「Wirkungssphäre」または「影響の球」の概念に起源を持ち、核は細胞質の離散的な体積しか支持できないと主張し、細胞の大きさの上限を定義している。 この原理は、細胞性デオキシリボ核酸の含有量と体積が密接に結合していると主張したGregory(2001)によってさらに詳しく説明されました。 骨格筋のsyncytial性質はこれらの細胞がこの限定を克服するのを助けます。 筋核ドメイン仮説は、適切な核-細胞質比を維持するために、肥大の間に新しい核が追加され、萎縮とともに失われることを指示する。核数が筋肉肥大とともに増加することを示す実質的なデータがある(Moss、1968;Cabric and James、1983;Egner et al. いくつかの論争が残っているが(Murach et al., 2018). このプロセスは、強烈な調査の領域となっており、肥大の間に新しい核の獲得を調節する基礎となる分子機構のいくつかが最近定義されている(Guerci et al. ら、2 0 1 2;Bentzinger e t a l. ら、2 0 1 4;Ross e t a l., 2018). これらの過剰核は、系統制限された幹細胞、典型的には衛星細胞が筋線維と融合し、それらの核に寄与するときに獲得される(Brack and Rando,2 0 1 2;Bachman e t a l.,2 0 1 2;bachman e t a l.,2 0 1 3;bachman e, 2018). 衛星細胞は基底膜の下に存在し、肉腫に当接する(Katz、1961;Mauro、1961)。 それらは、テストステロンのようなアナボリックステロイドまたは抵抗運動後の局所傷害のいずれかによって刺激されるまで静止したままであり、, 2017). 娘細胞のいくつかは筋線維と融合し、修復および成長の両方を促進し、他の細胞は衛星プールを停止および再構成する(Dumont et al. ることを示した。 残りの余剰細胞はアポトーシスを受ける(Schwartz、2008)。
筋核ドメイン仮説の論争の側面は、筋核が萎縮中に失われるという主張である。 動物モデルにおいて萎縮を誘導する多くの介入があり、これには、固定化、脱神経、および敗血症が含まれる(Fitts et al. ら、1 9 8 6;Minnaard e t a l. ら、2 0 0 5;O’Leary e t a l., 2012). それぞれの場合において、筋肉断面積(一次アッセイ)および組織内のアポトーシス細胞の出現の両方の正味の損失が存在する(Mccall e t a l. ら、1 9 9 8;Smith e t a l. ら,2 0 0 0;Strasser e t a l. ら、2 0 0 0;Alway e t a l. ら、2 0 0 3;Mcclung e t a l. ら、2 0 0 7;Andriangafiniony e t a l. ら,2 0 1 0;Guo e t a l. ら、2 0 1 2;Palumbo e t a l. ら、2 0 1 2;Barnes e t a l. ら,2 0 1 5;Cheemaら,2 0 1 5;Cheemaら, ら,2 0 1 5;Liら,2 0 1 5;Liら, ら、2 0 1 6;Kletzien e t a l., 2018). これらの研究では、アポトーシスは、カスパーゼ活性化、ミトコンドリアEndoGリリース、またはDNA断片化を含む様々な方法で測定されます。 これらの研究は、アポトーシスが萎縮の初期段階で劇的に増加するという説得力のあるデータを提供する。 例えば、最近の包括的研究(Guo e t a l. ら、2 0 1 2)、Guo e t a l. 後肢懸濁液の14日間にマウスを供し、筋肉の湿潤重量の-69%の減少と非操作対側筋に対する断面積の-43.8%の減少をもたらした治療。 著者らはまた、TUNEL染色、カスパーゼ-3切断/活性化、およびポリ(アデノシン二リン酸リボース)ポリメラーゼ(PARP)、DNA修復に関与するタンパク質の切断を含むアポト これらのアポトーシス対策のそれぞれは、後肢懸濁後に有意に増加した。 この論文の主な焦点は、侮辱後の萎縮を制限する上で電気刺激のプラスの影響を評価することであったが、彼らと他の多くの研究者は、筋核ドメイン仮説のための強力なサポートを提供するものとして、これらの種類のデータを解釈します。細胞生物学的観点からは、骨格筋のような合胞体組織内の核の推定損失は、主要な実用的な問題を提示する。
細胞生物学的観点からは、骨格筋のような合胞体組織内の核の推定損失は、 どのように個々の核は、そのゲノムが急速に凝縮し、その隣人が持続し、筋繊維の生存率を維持するのに役立つように妥協することができますか? アポトーシスは典型的にはカスパーゼとして知られているシステインプロテアーゼのクラスの活性化によって媒介されることを考えると、共通の細胞質内の拡散性プロテアーゼの活性を制限するために役立つかもしれないどのようなメカニズムは明らかではない。この質問は、胎盤を取り囲んで約5×1010個の核を含む別の合胞体細胞型、ヒト合胞体栄養芽細胞において間接的に対処されている(Mayhew et al., 1999). アポトーシスが合胞体栄養芽細胞に誘導されると、アポトーシスは、組織全体が関与するまで毎分約5ミクロンの速度で波として伝播する(Longtine e t a l., 2012). その結果、合胞体細胞質内に「特権」領域はなく、すべての核が最終的に破壊される。
骨格筋におけるアポトーシスを分析する際の重要な課題の一つは、それがその核の約半分が筋線維の外側に存在する非常に不均一な組織である これらの単核細胞には、衛星細胞、内皮細胞、線維芽細胞、周囲細胞、およびマクロファージが含まれる(Tedesco e t a l., 2010). その結果、核が存在する筋核のどちら側にあるのかを決定することは非常に困難であり、したがってそれが真の筋核であるかどうかを決定することは非常に困難である。
標識されたマウス筋線維のIn Vivoタイムラプスイメージング
筋萎縮中のアポトーシスを示す多数の論文にもかかわらず、いくつかの著者は、これらの結果に疑問を呈している(Wada et al. ら、2 0 0 2;Zhong e t a l. ら、2 0 0 5;Aravamudan e t a l. ら、2 0 0 6;GundersenおよびBruusgaard、2 0 0 8;Duddy e t a l. ら,2 0 1 1;QaisarおよびLarsson,2 0 1 4)。 例えば、単離された筋線維をin vitroで使用すると、Duddy e t a l. 筋線維量は経時的に減少したが、萎縮過程を反映して、筋核の数は安定しているように見えたことに留意されたい(Duddy et al., 2011).一連のエレガントな実験では、Gundersenラボは、麻酔マウスの核と細胞質を独立して標識した染料で個々の伸筋digitorum longus(EDL)またはヒラメ筋筋線維を注入した(Bruusgaard and Gundersen、2008;Bruusgaard et al., 2010). これにより、時間の経過とともにin vivoで個々の筋線維内の各核を同定し、その運命を評価することができました。 例えば、EDL筋は、それらの主要な相乗剤の切除によって肥大に誘導された(Bruusgaard e t a l., 2010). 6日目から11日目の間には、筋核の数は約54%増加し、9日目から14日目の間には断面積が35%増加した(図1)。 これらのデータは、筋肉が肥大の間に繊維の主要な成長の前に過剰核を獲得するという仮説と一致している。

図1. Myonucleiは肥大の間に得られますが、マウスの萎縮の間に失われません。 肥大の誘導(一番上の行)およびその後の萎縮の誘導(一番下の行)に続いて、時間の経過とともに同じEDL筋線維の顕微鏡写真。 蛍光標識されたオリゴヌクレオチドを用いてinvivoで核を可視化した。 点線はサルコレマを表しています。 スケールバー=50μ m。 (Bruusgaard e t a l., 2010. 国立科学アカデミーの手続の許可によって使用されます。その後、彼らは萎縮を誘発されたときに、同じ筋線維中のこれらの一意に識別可能な筋核の運命を調べた。 脱神経は、筋線維量の約5 0%の減少をもたらしたが、筋核の損失はなかった(図1;Bruusgaard e t a l., 2010). 核喪失を観察する失敗は、テトロドトキシン誘発神経遮断、後肢懸濁、癌悪液質、または低下に応答して筋肉が萎縮に誘導されたときに同じ結果を得たので、用いられた萎縮性刺激によるものではなかった(Bruusgaard and Gundersen,2008;Bruusgaard et al. ら、2 0 1 0;Winje e t a l.、2018a)。 実際、彼らの研究の過程で、彼らは萎縮性筋肉中の200,000以上の個々の筋核を調べ、核のわずか0.002%の損失を表す4つのTUNEL陽性(アポトーシス)核のみを観察した(Bruusgaard et al., 2012). これらのデータは、骨格筋萎縮が筋核死を伴わないという仮説を強く支持する。モデルとしての昆虫筋肉
これらの研究と同じくらい強力な、哺乳動物モデルの使用に固有のいくつかの制限があります。 第一に、彼らは常に筋肉萎縮を誘導するために脱神経などの実験的介入に依存しています。 第二に、対側筋は、ストレスホルモン(Bonaldo and Sandri、2013)のような同じ環境信号のいくつかにさらされていても、典型的には内部統制として使用されます。 最後に、骨格筋はまた開発の間にプログラムされた細胞死(PCD)を経ることができこれらのモデルはまれにこれらの細胞のapoptosisの役割に演説しません。
これらの制限のいずれにも苦しんでおらず、萎縮および天然に発生するPCDの両方の間の筋肉核の研究を可能にする代替モデルは、タバコhawkmoth Manduca sextaの Ismは巨大な筋線維のシートで構成されており、各細胞の長さは約5mm、直径は最大1mmです(図2A)。 Ismは腹部内の分節境界に付着し,変態の終わりにさなぎキューティクルから脱出するときに幼虫のクロール行動と成虫のエクロシオン(出現)行動の両方を生成する。
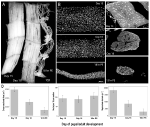
ガのManducaのsextaからのintersegmental筋肉(ISMs)の萎縮そして死の両方の間のmyonucleiの保持。 (A)発達の3段階からのISMs:恒常性(蛹-成人発達の15日目;左);萎縮性(18日目;中); そして死ぬ(18h post-eclosion;右)。 スケールバーは約1mmに等しい(Schwartz et al., 2016). (B)これらの同じ発生段階からのIsmを除去し、核色素DAPIで染色し、共焦点顕微鏡で可視化した(Schwartz e t a l.,nucleic Acids Research,Nucleic Acids Res., 2016). (C)ISM繊維切片(1 0μ m)を核色素DAPIで染色した。 萎縮および死の間の筋肉タンパク質(明るい灰色の領域)の劇的な損失が、すべての段階での核の保持に注意してください(Schwartz et al., 2016). (D)恒常性、萎縮、および死の間のISM繊維体積(左)、核数(中央)、および筋核ドメインサイズ(右)の定量化。 (平均±標準誤差。 Schwartzら(Schwartz e t a l., 2016).
蛹-成体発達の正常な15日目の18日目に、ISMsはホルモン的に誘発された萎縮プログラムを開始し、その結果、40日後の卵食の時間までに3%の質量損失をもたらす(図2A;Schwartz and Truman、1983)。 筋肉固まりのこの劇的な損失はsarcopeniaの80歳の個人で見られるそれと同等ですが3日よりもむしろ30年に起こります。 Ismは質量を失うが、静止電位および力/断面積などの正常な生理学的特性を保持する(Schwartz and Ruff,2 0 0 2)。 Ismを使用して、1 8日目の終わりに回食行動を生成し、次いで、両方がペプチドホルモンによって誘発されるPCDを開始する(SchwartzおよびTruman、1 9 8 2、1 9 8 3)。 .
哺乳類の筋肉とは対照的に、Ismは毛細血管、衛星細胞、内皮細胞、または周皮細胞を含まず、組織内の実質的にすべての核が筋線維自体の中に存在する(Beaulaton and Lockshin、1977)。 本発明者らは、このモデルにおいて萎縮および死の両方の間の核運命を監視するために二つの独立した方法を使用した(Schwartz e t a l., 2016). 最初は標準的な解剖学的アプローチでした。 Ismが萎縮して死に至ると、繊維の体積と断面積の両方に劇的な減少がありますが、核の数は大きく変わりませんでした(図2B)。 定量的研究のために切片化された組織を使用して、我々は、萎縮の間に繊維断面積の〜49%の減少があり、死の初期段階でさらに30%の減少があることを見出した(図2C、D;Schwartz et al., 2016). しかし、核の数は、機能的に筋核ドメインの84%の減少があったことを意味し、この同じ期間中に変更されませんでした。
我々が採用した第二の方法は、筋肉が恒常性である13日目に、筋肉が高度に退化している18時間後まで、動物からの個々の筋線維のDNA含量を測定するこ, 2016). 我々は、420個の個々の細胞のDNA含有量を定量化し、開発中に有意な損失がなかったことがわかった。 これらの生化学的解析は解剖学的データとよく一致し,筋肉が萎縮して死亡するにつれて核とゲノムDNAの相対濃度が機能的に増加することを示唆した。 その結果、マウスと蛾の両方からのデータは、筋核が萎縮(またはPCD)の間にアポトーシスを受けないことを示唆し、筋核ドメイン仮説を拒否すべきである
結論
これらの観察は、筋肉の基礎生物学を理解し、潜在的な治療介入を開発するための両方のための多くの意味を持っています。 萎縮性の侮辱に続くティッシュ内のapoptotic核の存在を報告する相当なデータがある間、最近のデータはこれらが本当のmyonuclei、むしろ、筋繊維の外に存在する非難された単核細胞ではないことを提案する。 この不一致の主な理由は、アポトーシスを検出するために使用される伝統的なツールは、死にかけている細胞が存在する肉腫のどちら側を適切に決定す 蛍光色素のインビボ注射(Bruusgaard and Gundersen,2 0 0 8)を介して、またはマーカータンパク質を発現するための遺伝子操作(Duddy e t a l.,2 0 0 8)を介して、筋核を特異的に標識する方法。,2011),標識された繊維内の任意のアポトーシス核場合はいくつかを明らかにします。. 蛋白質Pericentriolar材料1(PCM1)に対する抗体が本物のmyonucleiだけを標識するという最近の実証は、現場で日常的に分析される伝統的な組織学的材料に適用することが、2018b)。
骨格筋が筋核を排除するためのメカニズムとしてアポトーシスを採用することができないことは驚くべきことではありません。 成熟した骨格筋は、アポトーシスタンパク質のXリンク阻害剤(XIAP)のような強力な生存タンパク質の発現をアップレギュレートするという点で、アポトーシスの開始から主に排除されているようである(Smith et al. ら、2 0 0 9)およびカスパーゼ募集ドメイン(ARC)を有するアポトーシス抑制因子(Xiao e t a l. のような低レベルのアポトーシス媒介因子を同時に発現している(Burgess e t a l.,2 0 1 1)。, 1999). 筋肉は激しい運動後の肉腫の破壊を含む極端な摂動の対象となるため、組織修復を開始し、おそらく肥大を開始するのではなく、細胞死を誘発した場 他の最終分化細胞と同様に、筋肉は非アポトーシス機構、最も顕著にはオートファジー PCD(II型変性としても知られている)を使用する傾向がある(Clarke,1990;Schwartz et al. ら、1 9 9 3;Koleら、1 9 9 4)。 ら、2 0 1 3;Ginet e t a l.、2014)開発中に死亡した場合。筋肉が個々の核を選択的に標的とするメカニズムがあったとしても、これが有益であることは明らかではない。
筋肉が選択的に個々の核を標的とす 実際、萎縮の間の「余剰」核の保持は骨格筋が頻繁に食糧供給のような環境条件に応じて萎縮および肥大の周期を経るので個人のための明瞭な利点 既存の筋核を利用することによって迅速に回復する能力は、適応において重要な役割を果たす可能性がある(Jackson e t a l. ら、2012)および「筋肉記憶」の現象を説明するのに役立つ(Staron e t a l. ることができます。 運動生理学の分野では、たとえそれが最初の場所を達成するよりも、運動を通じて一定のレベルの筋肉のフィットネスを再取得する方がはるかに簡 言い換えれば、”それを使用するか、それを失う”というフレーズは、あなたが再びそれで働くまで、”それを使用するか、それを失う”としてより正確に連結され「これは、筋肉が新しい核を獲得すると、肥大刺激が除去された後も長く保持されることを実証したGundersen labの別の実験によって直接実証されています。 彼らは、テストステロンで2週間のためにそれらを処理することにより、雌マウスの筋肉肥大を誘導し、その後、ステロイド離脱の3週間後に筋肉を調, 2013). 筋肉量はベースラインに戻っていたが、新たに獲得した核は3ヶ月後にも持続した。 筋肉が肥大を再開始するために過負荷に供されたとき、ステロイド処理されたものは急速に繊維量の36%の増加を受け、対照筋肉はわずか6%増加した。 これらのデータは、「余剰」核が再訓練を容易にするために急速に動員される可能性があることを示唆している。
これらの観察は、公衆衛生政策のための潜在的な意味を持っています。 筋肉の成長、生理学的機能、および再生能力はすべて、主に衛星細胞増殖の減少に起因して、年齢とともに低下することが示されている(Blau et al., 2015). その結果、筋肉成長がホルモン、栄養物および強い衛星プールによって高められる青年期の練習は機能的に個人が老化の効果を遅らせ、多分sarcopeniaをforestallために
また、これらのデータは、競争力のあるスポーツの分野で意味を持っています。 蛋白同化ステロイドの使用は、筋肉肥大および新しい筋核の添加のための強力な刺激である(Egner et al., 2013). これらの核はステロイドの使用が終了した後も長く持続するので、運動選手は検出のリスクなしに違法薬物使用の利益を得る可能性が高い。
要約すると、筋肉成長を伴う新しい核の追加は大部分が受け入れられているが、萎縮を伴う核のアポトーシス損失は支持できず、筋核ドメイン仮説の厳密な解釈は支持できないことを示唆している。 その代わりに、筋肉が萎縮したり、細胞死を開始したりしても、一度獲得されると、筋核は持続するように見える。
著者の貢献
著者は、この作品の唯一の貢献者であることを確認し、出版のためにそれを承認しました。
資金調達
この出版物のための仕事は、Eugene M.and Ronnie Isenberg Professorship Endowmentからの資金によってサポートされました。 企業のサポートは著者に提供されておらず、商用製品は言及されていないか、または承認されていません。
利益相反に関する声明
著者は、潜在的な利益相反として解釈される可能性のある商業的または財務的関係がない場合に研究が行われた
謝辞
著者は、この原稿の準備における支援のための氏クリスティン*ブラウンとサポートのためのユージン*M.とロニー*アイゼンバーグ教授のエンダウメントに感謝したいと思います。
Aagaard,P.(2004). 筋肉を”より強く”する:運動、栄養、薬物。 J.マッスルスクレット。 神経細胞 相互作用します。 4, 165–174.
PubMed Abstract|Google Scholar
Abreu,P.,Mendes,S.V.,Ceccatto,V.M.,And Hirabara,S.M.(2017). ヒトおよびげっ歯類における持久力運動に応答して好気性筋肉適応によって誘導される衛星細胞活性化。 ライフサイエンス 170, 33–40. doi:10.1016/j.lfs.2016.11.016
PubMed Abstract|CrossRef Full Text|Google Scholar
Ali,S.,And Garcia,J.M.(2014). サルコペニア、悪液質および老化:診断、メカニズムおよび治療上の選択肢—ミニレビュー。 老年学60,294-305. doi:10.1159/000356760
PubMed Abstract|CrossRef Full Text|Google Scholar
Alway,S.E.,Martyn,J.K.,Ouyang,J.,Chaudhrai,A.,And Murlasits,Z.S. (2003). Id2 expression during apoptosis and satellite cell activation in unloaded and loaded quail skeletal muscles. Am. J. Physiol. Regul. Integr. Comp. Physiol. 284, R540–R549. doi: 10.1152/ajpregu.00550.2002
PubMed Abstract | CrossRef Full Text | Google Scholar
Andrianjafiniony, T., Dupre-Aucouturier, S., Letexier, D., Couchoux, H., and Desplanches, D. (2010). Oxidative stress, apoptosis, and proteolysis in skeletal muscle repair after unloading. Am. J. Phys. Cell Physiol. 299, C307–C315. doi: 10.1152/ajpcell.00069.2010
PubMed Abstract|CrossRef Full Text|Google Scholar
Aravamudan,B.,Mantilla,C.B.,Zhan,W.Z.,Sieck,G.C.(2006). ラット横隔膜線維の筋核ドメインサイズに対する脱神経効果。 J.Appl. フィジオール 100, 1617–1622. 土井:10.1152/01277.2005
CrossRef全文|Google Scholar
Bachman,J.F.,Klose,A.,Liu,W.,Paris,N.D.,Blanc,R.S.,Schmalz,M.,et al. (2018). Prepubertal骨格筋の成長はpax7表現の衛星細胞得られたmyonuclear貢献を要求する。 145:167197
Google Scholar
Barnes,B.T.,Confides,A.L.,Rich,M.M.,And Dupont-Versteegden,E.E.(2015). 重大な病気のミオパチーのラットモデルでは、異なる繊維タイプの筋肉で異なる筋肉アポトーシス経路が活性化される。 J.Muscle Res.Cell Motil. 36, 243–253. ドイ:10.1007/s10974-015-9410-8
PubMed Abstract|CrossRef Full Text|Google Scholar
Beaulaton,J.,And Lockshin,R.A.(1977). 細胞オートファジーを特に参照して、Anthereae polyphemusとManduca sexta(insecta、鱗翅目)のセグメント間筋肉の正常な変性の超微細構造研究。 J.モルフォール 154, 39–57. ドイ:10.1002/jmor.1051540104
PubMed Abstract|CrossRef Full Text|Google Scholar
Bentzinger,C.F.,von Maltzahn,J.,Dumont,N.A.,Stark,D.A.,Wang,Y.X.,Nhan,K.,et al. (2014). Wnt7aは改善された筋肉強さに終ってmyogenic幹細胞の運動性および生着を刺激します。 J.Cell Biol. 205, 97–111. ドイ:10.1083/jcb.201310035
PubMed Abstract|CrossRef Full Text|Google Scholar
Blau,H.M.,Cosgrove,B.D.,And Ho,A.T.(2015). 加齢に伴う再生障害における筋肉幹細胞の中心的な役割。 ナット メッド 21, 854–862. ドイ:10.1038/nm.3918
PubMed Abstract|CrossRef Full Text|Google Scholar
Bonaldo,P.,And Sandri,M.(2013). 筋萎縮の細胞および分子メカニズム。 Dis。 モデル。 メカ 6, 25–39. ドイ:10.1242/dmm.010389
CrossRef全文|Google Scholar
Brack,A.S.,And Rando,T.A.(2012). 組織特異的幹細胞:骨格筋衛星細胞からの教訓。 細胞幹細胞10、504-514。 土井:10.1016/j.stem.2012.04.001
Pubmed Abstract|CrossRef Full Text|Google Scholar
Bruusgaard,J.C.,Egner,I.M.,Larsen,T.K.,Dupre-Aucouturier,S.,Desplanches,D.,And Gundersen,K.(2012). 筋肉のアンロードとリロード中に私の核の数に変化はありません。 J.Appl. フィジオール 113, 290–296. 土井:10.1152/00436.2012
PubMed Abstract|CrossRef Full Text|Google Scholar
Bruusgaard,J.C.,And Gundersen,K. (2008). In vivoのタイムラプスの顕微鏡検査は筋肉萎縮の週の間にマウスのmyonucleiの損失を明らかにしません。 J.Clin. 投資する。 118, 1450–1457. doi:10.1172/JCI34022
Pubmed Abstract|CrossRef Full Text/Google Scholar
Bruusgaard,J.C.,Johansen,I.B.,Egner,I.M.,Rana,Z.A.,And Gundersen,K.(2010). 過負荷運動によって獲得されたMyonucleiは肥大に先行し、低下時に失われることはありません。 プロク… ナトル アカド サイ… 107,15111-15116. ドイ:10.1073/pnas.0913935107
CrossRef全文|Google Scholar
Bruusgaard,J.C.,Liestol,K. ら、ekmark,M.,Kollstad,K.,およびGundersen,K.(2 0 0 3)。 正常マウスの筋線維中の核の数と空間分布をin vivoで研究した。 J.フィジオール。 551, 467–478. 土井:10.1113/jphysiol.2003.045328
Pubmed Abstract|CrossRef Full Text|Google Scholar
Burgess,D.H.,Svensson,M.,Dandrea,T.,Gronlund,K.,Hammarquist,F.,Orrenius,S.,et al. (1999). ヒト骨格筋サイトゾルは、タイプIIカスパーゼのシトクロムc依存的活性化に難治性であり、APAF-1を欠いている。 細胞死は異なる。 6, 256–261. ドイ:10.1038/sj.cdd.4400489
PubMed Abstract|CrossRef Full Text|Google Scholar
Cabric,M.,and James,N.T.(1983). 運動訓練を受けた犬と訓練を受けていない犬の筋肉に関する形態測定分析。 アム… J.アナト 166, 359–368. 土井:10.1002/aja.1001660309
PubMed Abstract|CrossRef Full Text|Google Scholar
Cheema,N.,Herbst,A.,McKenzie,D.,And Aiken,J.M.(2015). アポトーシスと壊死は、年齢誘発ミトコンドリア酵素異常における骨格筋線維の損失を仲介します。 エイジングセル14、1085-1093。 土井:10.1111/acel.12399
PubMed Abstract|CrossRef Full Text|Google Scholar
Clarke,P.G.(1990). 発生細胞死:形態学的多様性と複数のメカニズム。 アナト エンブリオール 181, 195–213.
Google Scholar
Cohen、S.、Nathan、J.A.、およびGoldberg、A.L.(2015)。 疾患における筋消耗:分子メカニズムと有望な治療法。 ナット ドラッグ-ディスコブ… 14, 58–74. doi:10.1038/nrd4467
Pubmed Abstract|CrossRef Full Text|Google Scholar
Duddy,W.J.,Cohen,T.,Duguez,S.,And Partridge,T.A.(2011). 廃用萎縮のモデルとしての単離された筋線維:ファクト、f-アクチンを定量化する方法を用いた特性評価。 経験値 セルRes.317,1979-1993. 土井:10.1016/j.yexcr.2011.05.013
Pubmed Abstract|CrossRef Full Text|Google Scholar
Dumont,N.A.,Wang,Y.X.,And Rudnicki,M.A.(2015). 衛星細胞機能を調節する内因性および外因性のメカニズム。 1572年から1581年までの間に開発された。 ドイ:10.1242/dev.114223
PubMed Abstract|CrossRef Full Text|Google Scholar
Egner,I.M.,Bruusgaard,J.C.,Eftestol,E.,And Gundersen,K.(2013). 蛋白同化ステロイドへの一時的な露出の後の筋肉の細胞記憶メカニズムの援助の積み過ぎの肥大長く。 J.フィジオール。 591, 6221–6230. 土井:10.1113/jphysiol.2013.264457
Pubmed Abstract|CrossRef Full Text|Google Scholar
Egner,I.M.,Bruusgaard,J.C.,And Gundersen,K.(2016). 衛星細胞の枯渇は骨格筋の繊維の肥大を防ぎます。 開発143、2898-2906。 ドイ:10.1242/dev.134411
PubMed Abstract|CrossRef Full Text|Google Scholar
Fitts,R.H.,Metzger,J.M.,Riley,D.A.,And Unsworth,B.R. (1986). 廃用のモデル:後肢の懸濁液と固定化の比較。 J.Appl. フィジオール 60, 1946–1953.
Google Scholar
Ginet,V.,Pittet,M.P.,Rummel,C.,Osterheld,M.C.,Meuli,R.,Clarke,P.G.,et al. (2014). 仮死期新生児およびラットの視床における死にかけているニューロンはオートファジーである。 アン ニューロール 76, 695–711. 土井:10.1002/ana.24257
PubMed Abstract|CrossRef Full Text|Google Scholar
Goh,Q.,And Millay,D.P.(2017). 骨格筋肥大のためのmyomaker媒介幹細胞融合の要件。 elife6. ドイ:10.7554/eLife.20007
PubMed Abstract|CrossRef Full Text|Google Scholar
Gregory,T.R.(2001). 偶然、共進化、または因果関係? DNAの内容、細胞のサイズおよびC価値謎。 バイオル カンブ牧師 フィロス Soc. 76, 65–101. doi:10.1017/s1464793100005595
PubMed Abstract|CrossRef Full Text/Google Scholar
Guerci,A.,Lahoute,C.,Hebrard,S.,Collard,L.,Graindorge,D.,Favier,M.,et al. (2012). 筋線維によって産生されるSrf依存性パラクリン信号は、衛星細胞を介した骨格筋肥大を制御する。 セルメタブ 15, 25–37. 土井:10.1016/j.cmet.2011.12.001
PubMed Abstract|CrossRef Full Text|Google Scholar
Gundersen,K.(2016). 筋萎縮および肥大のための筋肉記憶および新しい細胞モデル。 J.Exp. バイオル 219, 235–242. ドイ:10.1242/jeb.124495
PubMed Abstract|CrossRef Full Text|Google Scholar
Gundersen,K.,And Bruusgaard,J.C.(2008). 筋萎縮時の核ドメイン:核が失われたか、パラダイムが失われたか? J.フィジオール。 586, 2675–2681. 土井:10.1113/jphysiol.2008.154369
PubMed Abstract|CrossRef Full Text|Google Scholar
Guo,B.S.,Cheung,K.K.,Yeung,S.S.,Zhang,B.T.,And Yeung,E.W.(2012). 電気刺激は、マウスのアンロード誘発性筋萎縮における衛星細胞の増殖とアポトーシスに影響を与えます。 PLoS One7:e30348. doi:10.1371/ジャーナル。ポネ0053523
PubMed Abstract|CrossRef Full Text|Google Scholar
Jackson,J.R.,Mula,J.,Kirby,T.J.,Fry,C.S.,Lee,J.D.,Ubele,M.F.,et al. (2012). 衛星細胞の枯渇は、アンロード誘発萎縮後の成人骨格筋の再成長を阻害しない。 アム… J.Phys. セルフィジオール 303件中C854-C861件目を表示しています。 ドイ:10.1152/ajpcell.00207.2012
PubMed Abstract|CrossRef Full Text|Google Scholar
Joubert,Y.,And Tobin,C.(1995). テストステロンの処置はラットのlevator ani筋肉の細胞周期に活動化させ、募集される静止衛星細胞で起因します。 デヴ バイオル 169, 286–294. ドイ:10.1006/dbio.1995.1144
PubMed Abstract|CrossRef Full Text|Google Scholar
Katz,B.(1961). カエルの筋肉紡錘の求心性神経線維の終了。 フィロス トランス R.Soc. ロンド Bバイオル サイ… 243, 221–240.PubMed Abstract/Google Scholar
Kletzien,H.,Hare,A.J.,Leverson,G.,And Connor,N.P.(2018). 舌筋における繊維形態および数に対する細胞死の年齢関連効果。 筋肉神経57、E29-E37。 土井:10.1002/mus.25671
PubMed Abstract|CrossRef Full Text|Google Scholar
Kole,A.J.,Annis,R.P.,And Deshmukh,M.(2013). 成熟したニューロン:生存のために装備されています。 細胞死Dis. 4:e689 土井: 10.10382013.220
Pubmed Abstract|CrossRef Full Text|Google Scholar
Li,T.S.,Shi,H.,Wang,L.,And Yan,C.(2016). ラットにおける固定化誘発性筋萎縮における衛星細胞増殖およびアポトーシスに対する骨髄間葉系幹細胞の影響。 メッド サイ… モニット 22, 4651–4660. doi:10.12659/MSM。898137
PubMed Abstract|CrossRef Full Text|Google Scholar
Lockshin,R.A.,And Williams,C.M.(1965). プログラムされた細胞死–I.Pernyi silkmothのセグメント間筋肉における変性の細胞学。 J. 昆虫フィジオール 11, 123–133. 土井: 10.1016/0022-1910(65)90099-5
PubMed Abstract|CrossRef Full Text|Google Scholar
Longtine,M.S.,Barton,A.,Chen,B.,And Nelson,D.M.(2012). 生細胞イメージングは、アポトーシスが局所的に開始し、ヒト胎盤絨毛栄養膜の初代培養におけるsyncytiotrophoblasts全体の波として伝播を示しています。 33,971-976 土井:10.1016/j.プラセンタ.2012.09.013
PubMed Abstract|CrossRef Full Text|Google Scholar
Mauro,A.(1961). 骨格筋線維の衛星細胞。 J.Biophys. バイオケム Cytol. 9, 493–495.
Google Scholar
Mayhew,T.M.,Leach,L.,McGee,R.,Ismail,W.W.,Myklebust,R.,And Lammiman,M.J.(1999). 妊娠13-41週目の絨毛栄養膜における増殖、分化およびアポトーシス(環状ラメラおよび核細孔複合体の観察を含む)。 プラセンタ20、407-422 ドイ:10.1053/plac.1999.0399.
PubMed Abstract|CrossRef Full Text|Google Scholar
McCall,G.E.,Allen,D.L.,Linderman,J.K.,Grindeland,R.E.,Roy,R.R.,Mukku,V.R.,et al. (1998). 過負荷および成長ホルモン/IGF-i治療後のラットヒラメウスにおける筋核ドメインサイズの維持。 J.Appl. フィジオール 84, 1407–1412.
Google Scholar
McClung,J.M.,Kavazis,A.N.,DeRuisseau,K.C.,Falk,D.J.,Deering,M.A.,Lee,Y.,et al. (2007). 機械的換気誘発性萎縮中の横隔膜筋核ドメインのカスパーゼ-3調節。 アム… J.Respir. クリティカル・クリティカル・ ケアMed. 175, 150–159. ドイ:10.1164/rccm。200601-142OC
PubMed Abstract|CrossRef Full Text|Google Scholar
Metter,E.J.,Talbot,L.A.,Schrager,M. ら(2 0 0 2)。 健康な男性の全原因死亡率の予測因子としての骨格筋の強さ。 J.ジェロントール バイオル サイ… メッド サイ… 57,B359-B365 ドイ:10.1093/ジェロナ/57.10.B359
Pubmed Abstract|CrossRef Full Text/Google Scholar
Minnaard,R.,Drost,M.R.,Wagenmakers,A.J.,van Kranenburg,G.P.,Kuipers,H.,And Hesselink,M.K.(2005). 敗血症性ラットにおける骨格筋消耗および収縮性能。 31,339-348 土井:10.1002/mus.20268
PubMed要約|CrossRef全文|Google Scholar
モス、F.P. (1968). 国内の家禽における骨格筋の正常な成長中の繊維の寸法と核の数との関係。 アム… J.アナト 122, 555–563. 土井:10.1002/aja.1001220308
PubMed Abstract|CrossRef Full Text/Google Scholar
Murach,K.A.,Englund,D.A.,Dupont-Versteegden,E.E.,McCarthy,J.J.,And Peterson,C.A.(2018). 筋核ドメインの柔軟性は、骨格筋線維肥大への衛星細胞の寄与に関する厳格な仮定に挑戦します。 フロント フィジオール 9:635. ドイ:10.3389/fphys.2018.00635
CrossRef全文|Google Scholar
Nevalainen,M.,Kaakinen,M.,And Metsikko,K.(2013). 骨格筋線維におけるmRNA転写物および翻訳活性の分布。 細胞組織Res.353,539-548. ドイ:10.1007/s00441-013-1659-x
Pubmed Abstract|CrossRef Full Text|Google Scholar
O’Leary,M.F.,Vainshtein,A.,Carter,H.N.,Zhang,Y.,And Hood,D.A.(2012). アポトーシス欠損動物の骨格筋における脱神経誘導ミトコンドリア機能不全とオートファジー。 アム… J.Phys. セルフィジオール 303件中C447-C454件目を表示しています。 土井:10.1152/ajpcell.00451.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Palumbo, C., Rovesta, C., and Ferretti, M. (2012). Striated muscle fiber apoptosis after experimental tendon lesion in a rat model. J. Anat. 221, 358–363. doi: 10.1111/j.1469-7580.2012.01554.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Qaisar, R., and Larsson, L. (2014). What determines myonuclear domain size? Indian J. Physiol. Pharmacol. 58, 1–12.
PubMed Abstract | Google Scholar
Ross, J. A., Levy, Y., Svensson, K. とができるようになりました。 SIRT1は、骨格筋線維の核数とドメインサイズを調節します。 J.セル。 フィジオール 233, 7157–7163. doi:10.1002/jcp。26542
PubMed Abstract|CrossRef Full Text|Google Scholar
Schiaffino,S.,Dyar,K.A.,Ciciliot,S.,Blaauw,B.,And Sandri,M.(2013). 骨格筋の成長および萎縮を調節するメカニズム。 FEBS J.280,4294-4314. doi:10.1111/febs。12253
PubMed Abstract|CrossRef Full Text|Google Scholar
Schmalbruch,H.,And Hellhammer,U.(1977). 衛星細胞を特別に参照して成体ラット筋肉の核の数。 アナト Rec. 189, 169–175. 土井:10.1002/ar.1091890204
PubMed Abstract|CrossRef Full Text|Google Scholar
Schwartz,L.M.(2008). 骨格筋の萎縮およびプログラムされた細胞死。 細胞死は異なる。 15, 1163–1169. ドイ:10.1038/cdd.2008.68
PubMed Abstract|CrossRef Full Text|Google Scholar
Schwartz,L.M.,Brown,C.,McLaughlin,K.,Smith,W.,And Bigelow,C.(2016). 筋核ドメインは、萎縮またはプログラムされた細胞死のいずれかの間に骨格筋に維持されない。 アム… J.Phys. セルフィジオール 311件中C607-C615件目を表示しています。 ドイ:10.1152/ajpcell.00176.2016
PubMed Abstract|CrossRef Full Text|Google Scholar
Schwartz,L.M.,And Ruff,R.L.(2002). 発達的にプログラムされた萎縮および死の間の骨格筋の収縮特性の変化。 アム… J.Phys. セルフィジオール 282件中1270-1277件目を表示しています。 ドイ:10.1152/ajpcell.01275.2000
CrossRef全文|Google Scholar
Schwartz,L.M.,Smith,S.W.,Jones,M.E. およびOsborne,B. すべてのプログラムされた細胞の死はapoptosisによって起こるか。 プロク… ナトル アカド サイ… 90,980-984
Google Scholar
Schwartz,L.M.,And Truman,J.W.(1983). タバコのhornworm Manducaのsextaの変成の開発の率のホルモン性制御。 デヴ バイオル 99, 103–114. 土井: 10.1016/0012-1606(83)90257-9
PubMed Abstract|CrossRef Full Text|Google Scholar
Schwartz,L.M.,And Truman,J.W.(1982). 昆虫における筋変性のペプチドおよびステロイド調節。 科学215,1420-1421. 土井:10.1126/6278594
Pubmed Abstract|CrossRef Full Text|Google Scholar
Smith,H.K.,Maxwell,L.,Martyn,J.A.,And Bass,J.J.(2000). 短期固定化後の成体ウサギ骨格筋における核DNA断片化および形態学的変化。 細胞組織Res.302,235-241. doi:10.1007/s004410000280
Pubmed Abstract|CrossRef Full Text/Google Scholar
Smith,M.I.,Huang,Y.Y.,And Deshmukh,M.(2009). 骨格筋の分化は、アポトーシス経路を制限するために内因性XIAPを呼び起こす。 PLoS One4:e5097. 土井: 10.1371/ポネ0005097
CrossRef全文/Google Scholar
Staron,R.S.,Leonardi,M.J.,Karapondo,D.L.,Malicky,E.S.,Falkel,J.E.,Hagerman,F.C.,et al. (1991). 減量と再訓練後の重い抵抗訓練を受けた女性の強さと骨格筋の適応。 J.Appl. フィジオール 70, 631-640.
Google Scholar
Strassburger,E.(1893)。 核の作用範囲と細胞の大きさ。 Histol Beitr. 5, 97-124.
Google Scholar
Strasser,H.,Tiefenthaler,M.,Steinlechner,M.,Eder,I. ら、bartsch,G.,およびKonwalinka,G.(2 0 0 0)。 年齢依存性アポトーシスとラブドスフィンクター細胞の損失。 J.Urol. 164, 1781–1785. doi:10.1016/S0022-5347(05)67106-6
Pubmed Abstract|CrossRef Full Text/Google Scholar
Tedesco,F.S.,Dellavalle,A.,Diaz-Manera,J.,Messina,G.,And Cossu,G.(2010). 骨格筋の修復:骨格筋幹細胞の再生可能性。 J.Clin. 投資する。 120, 11–19. doi:10.1172/JCI40373
PubMed Abstract|CrossRef Full Text|Google Scholar
和田K.I.,高橋H.,勝田S.,宗谷H. (2002). 成熟マウスにおける長期脱神経後のmyonuclear数の減少はなかった。 アム… J.Phys. セルフィジオール 283、C484-C488。 ドイ:10.1152/ajpcell.00025.2002
CrossRef全文|Google Scholar
Winje,I.M.,Sheng,X.,Hansson,K.A.,Solbrå,A.,Tennøe,S.,Saatcioglu,F.,et al. (2018a)。 悪液質は、マウスの異種移植前立腺癌の間に筋核または筋線維の損失を誘導しません。 アクタフィジオール e13204 土井:10.1111/apha.13204
CrossRef全文|Google Scholar
Winje,I.M.,Bengtsen,M.,Eftestol,E.,Juvkam,I. ることを示した。 骨格筋組織切片上の中心周囲材料1に対する抗体による筋核の特異的標識。 アクタフィジオール 223:13034 土井:10.1111/apha.13034
CrossRef全文|Google Scholar
Woo,J.(2017). サルコペニア クリン ジェリアトル メッド 33, 305–314. 土井:10.1016/j.cger.2010.02.012
CrossRef全文|Google Scholar
Xiao,R.,Ferry,A.L.,And Dupont-Versteegden,E.E.(2011). 分化した筋管の細胞死抵抗性は、筋芽細胞と比較して強化された抗アポトーシス機構と関連している。 16件中221-234件を表示しています。 ドイ:10.1007/s10495-010-0566-9
PubMed Abstract|CrossRef Full Text|Google Scholar
Yang,D.,Morris,S.F.,And Sigurdson,L.(1998). Sartorius筋肉:再建の外科医のための解剖考察。 ラジオール手術 アナト 20, 307–310. doi:10.1007
PubMed Abstract|CrossRef Full Text|Google Scholar
Zhong,H.,Roy,R.R.,Siengthai,B.,And Edgerton,V.R.(2005). ラットヒラメ筋における繊維サイズおよび筋核数に対する非活動の影響。 J.Appl. フィジオール 99, 1494–1499. 土井:10.1152/00394.2005
CrossRef全文|Google Scholar
Zhou,X.,Wang,J.L.,Lu,J.,Song,Y.,Kwak,K.S.,Jiao,Q.,et al. (2010). Act RIIB拮抗作用による癌悪液質および筋肉消耗の逆転は、長期生存につながる。 セル142、531-543。 土井:10.1016/j。2010.07.011
Pubmed Abstract|CrossRef Full Text|Google Scholar
Ziaaldini,M.M.,Marzetti,E.,Picca,A.,Murlasits,Z.(2017). サルコペニアの生化学的経路と身体運動によるそれらの調節:物語のレビュー。 フロント メッド 4:167. ドイ:10.3389/fmed.2017.00167
CrossRef全文|Google Scholar