はじめに
肺静脈(PV)の電気的分離は、発作性および持続性心房細動(AF)の両方のためのカテー 無線周波数、cryotherapyおよびレーザーベースのPVの分離(PVI)のような現在利用できるエネルギー様相は、せいぜい、22%から38%まで、1、2 62.5%高い率を報告している他の調査との長期PVの再接続率によって限られている。3組織加熱(無線周波数)または凍結(凍結療法)、最も一般的に使用される二つのアプローチは、組織面を区別することなく、無差別の方法で組織を切除する。 その結果、これらのエネルギー源は、恐ろしい心房-食道瘻を含む横隔神経および食道損傷などの副次的損傷と関連している。 さらに、カテーテルアブレーションは、PV狭窄、蒸気ポップ、および塞栓性脳卒中のリスクなどの他の合併症と関連している可能性があります。4,5これらの安全性の限界は、残念ながら、AF再発のための既知のメカニズムである一貫した病変の透過性の欠如によって悪化している。6このように、非常に効果的であるだけでなく、非常に安全であるablative戦略の緊急の必要性がありました。
パルスフィールドアブレーション(PFA)は、長年にわたって遺伝子電気伝達と固形臓器腫瘍アブレーションの両方に利用されてきた非熱エネルギーモダ7,8さらに最近では、研究者らは、側副組織を温存しながら選択的に心筋細胞を標的とするその能力に関連するユニークな安全性プロファイルと切除有効性を実証している。 これは心臓切除のための新しいエネルギー源としてスポットライトにPFAを推進しました。
PFAの基礎
PFAは、無線周波数エネルギーが利用可能になる前の1980年代に簡単に使用された直流アブレーションの概念に広く基づいています。具体的には、PFAは、間欠的な高強度の電気パルスを迅速に(サブ秒)適用して、細胞膜脂質二重層を横切って電界を生成し、細胞膜にナノスケールの細孔(電気穿孔)を作 可逆的電気穿孔という用語は、標的組織の閾値を超えない低強度の電界が印加される場合の非永久的な細孔形成を指す。 一方、不可逆的なエレクトロポレーションは、電場が標的組織の閾値を超えたときに永久的な細孔の生成を指す。 これらの永久的な気孔は細胞の内容の漏出をもたらし、細胞死で最高潮に達する(図2)。 おそらく、心臓PFAの最も価値のある特徴は、その心筋選択性であり、その結果、すべての組織タイプの中で最も低い電界閾値(400V/cm)を有する心筋細胞4,5
図1
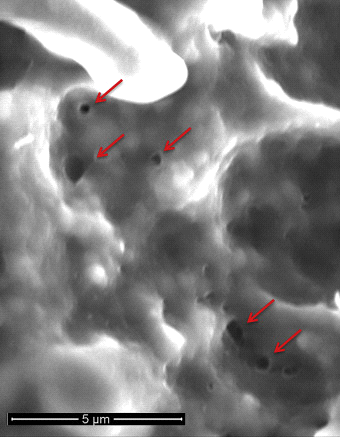
図1

図2
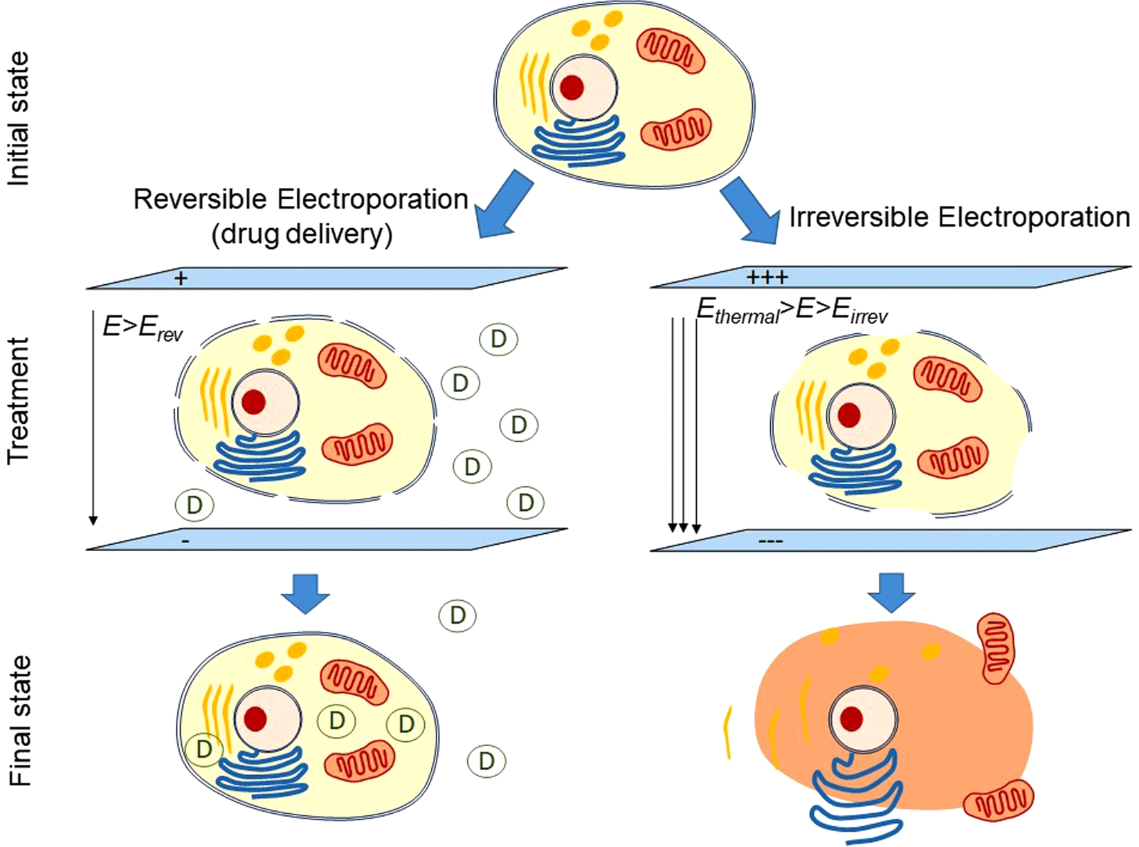
図2

PFA技術
PFAは、パルスおよびカテーテル設計特性のスペクトルを指す包括的な用語です。 これらの特徴は、PFAの有効性および安全性プロファイルと密接に関連しています。 重要な臨床ワークフローの含意があるPFAの特徴の一つは、波形設計です。 単相波形は、典型的には、全身麻酔および神経筋麻痺の使用を義務付け、有意な筋肉活性化を引き起こします。 逆に、二相性PFA波形は骨格筋の関与が限られていることが示されており、麻痺を必要とせずに臨床的に使用することができます。9
前臨床データ
心筋組織の切除療法としてのPFAに関する前臨床実験の実現可能性データは、過去十年間にわたって発生している。心臓組織における4,10-14PFA病変は特徴的に均質であり、組織足場内の細胞外マトリックスを惜しまない。4これは、熱エネルギー源で作成された無差別で破壊的な病変とは対照的です。 PFAおよび心房のティッシュに関して、調査官はintimaおよび伸縮性がある薄層の重要な傷つくか、または拡散なしでブタPVのostiaの200ジュールのmonophasic適用の完11重要なことに、PV自体の中に病変を生じたにもかかわらず、PV直径は影響を受けず、10、11はPFAs独自の非狭窄切除機構を証明した。 心室組織において、PFAは、病変内および病変に隣接する血管系および神経の温存を伴う大きな病変を生じることが示されている。さらに、pfaは、食道へのpfaの意図的な適用にもかかわらず、食道粘膜層および粘膜下層を倹約することが示されている。16,17PFAはまたコースに沿う多数の適用にもかかわらず横隔神経を傷つけないために示されていました。18これらの重要な知見は、PFAが心房組織切除のために非常に魅力的になるユニークな安全プロファイルを有することを示唆している。 上記の前臨床評価はすべて単相PFA波形で行った。 より新しい二相性PFA波形を有するより最近の前臨床データは、連続した、均質な、経壁心房病変を作成し、耐久性のあるPV分離などの関連するエンドポイントを達成することが奨励されている。19重要なことに、各PFA波形は一意のエンティティと見なされるべきであり、詳細な前臨床の安全性および有効性評価が必要です。
臨床データ
Reddy et al. 心内膜および心外膜PFAの両方の初期急性臨床経験を最初に記述した。 彼らは、AF患者におけるPFAのオープンラベル、非ランダム化前向き研究を実施した。5この研究では、カスタムオーバザワイヤマルチスプレインPFAカテーテル(FARAWAVE)は、15人の患者におけるPV antraで心内膜病変を送達するために使用されました。 この心内膜PFAカテーテルは、それぞれ4つの電極を含む5つのスプラインを有し、花またはバスケットのいずれかの構成を想定することがで この設計は円周PVのostialおよびantral適用範囲を可能にする(図3)。 さらに、線形PFAのカテーテルが併用心臓外科の間に7つの付加的な患者の結合されたPVIおよび後部の左心房の分離(箱の損害セット)を達成するのに使 本研究では単相パルス電圧波形をバイポーラ方式で送達したので,すべての手順を全身麻酔下で行った。 心内膜PVIは、3.26±0.5病変/PVと患者あたり<60秒のエネルギー送達時間とすべての15人の患者(100%)で急性に成功しました。 ボックス病変は、6の7患者(86%)の後壁を単離することに成功しました。 急性安全性プロファイルは手続き的合併症なしで優れていた。
図3
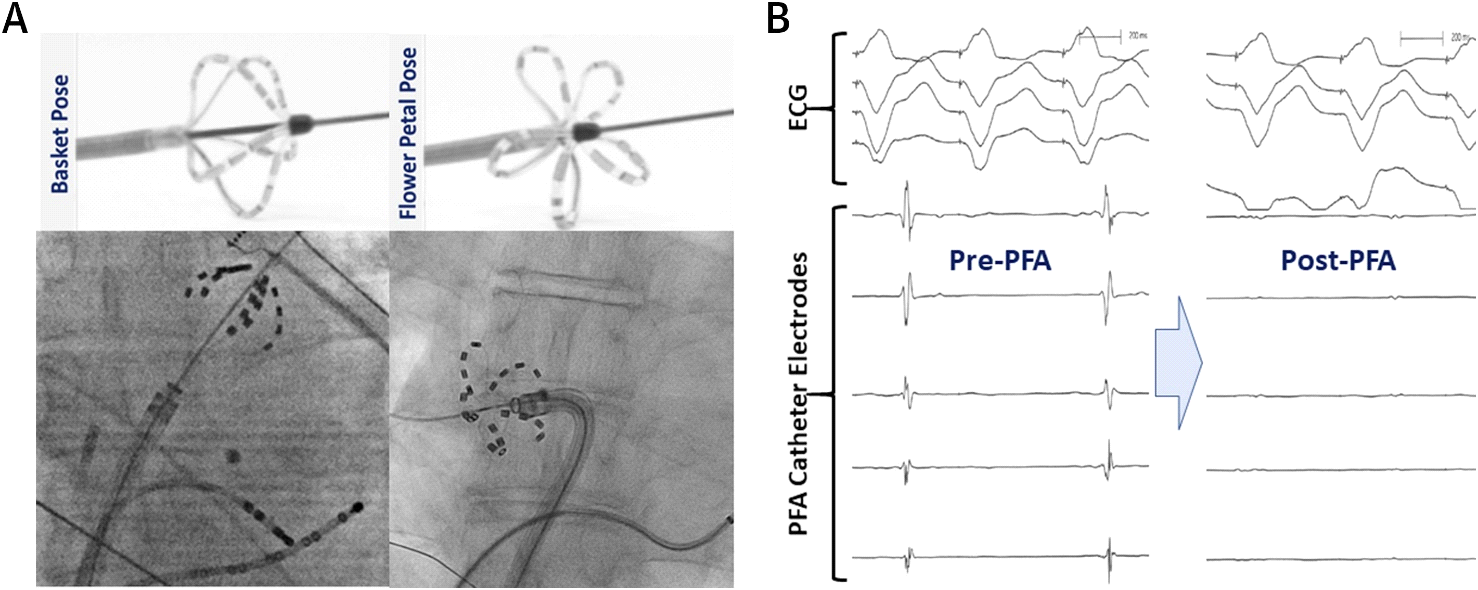
図3

その後、同じグループは最近、発作性AF患者におけるカテーテルベースのPFAの二つの非ランダム化臨床試験からの組み合わせデータを公開しました。20一緒に、これらの試験は、抗不整脈薬に耐性のある症候性発作性AFを有する81人の患者を登録し、左心室駆出画分><5.5cm。 PFAパルスをQRS発症直後に同期させた。 独自のバイポーラPFA波形は、心内膜PFAカテーテル(FARAWAVE)を使用して単相(アプリケーションごとに900-1000V;初期のケース)または二相方法(アプリケーションごとに1800-2000V;ほとん 急性PVIは患者の100%で達成された。 脈拍のミリ秒の性質のために、エネルギーを提供するために必要な時間は92.2±27.4分の皮に皮のプロシージャの時間の3分以下/患者ではなかった。 三ヶ月のPVI耐久性は徐々にこの研究の最後のコホートでより最適化されたバイポーラ波形で18%から100%に初期の単相波形で増加しました。 この研究では12ヶ月での不整脈からの推定自由度は87±5.6%であった。
安全性の観点から、単一の手順に関連する心膜タンポナーデが報告されたが、120日間の追跡期間の中央値にわたって他の有害事象は報告されなかった。 内視鏡検査は、アブレーション後29日の平均で3.4人の患者で行われ、食道病変の証拠は明らかにされなかった。 さらに、8人の患者は、すぐに隣接する左心房壁の強化にもかかわらず、食道の強化が認められなかった後の手順コントラスト強化された心血管磁気 これはさらに、PFAによる食道損傷の欠如を支持する。 このエネルギー源は脈拍配達の直後に急速に解決のマイクロ気泡を発生させる。これらの気泡が毛細血管血流を妨害して臓器虚血および脳微小塞栓を引き起こす理論的な可能性は、この臨床経験では観察されなかった。
Loh et al. また、カスタム14極円形アブレーションカテーテルを使用して発作性または永続的なAFを有する10人の患者の小さいシリーズにおけるpviのエレクトロポ 急性PVIは安全に100%(40PV)患者で達成された2非アーク6ms、単極単相波形を使用してPVあたり200ジュールのアプリケーションの最小値。22このシリーズの安全性およびPVI耐久性の結果はまだ報告されていません。要約すると、PFAは優れた短期安全プロファイルと長期耐久性を備えたPVを迅速に単離することができます。
これは非常に有望であるが、より長いフォローアップのより大きい調査は必要である。
結論
PFAは、現代のAFアブレーション技術の特定の制限を克服する能力を持っている驚くほど有望で新規な非熱アブレーション戦略です。 短い手順時間、担保傷害の欠如、およびPVIの改善された長期耐久性は、このエネルギー源を他のものと区別する。 切除のカテーテルおよび脈拍の設計に安全および効力の含意が両方ある。 これは新しいPFAの技術が臨床王国に方法を作ると同時に心に留めておかれなければならない。
- Hussein A,Das M,Riva S,et al. 耐久性のある肺静脈の分離の高い比率および耐久性がある心房細動の患者の不整脈からの自由の切除の索引導かれた切除の結果の使用。 2018年11月にはe006576が発売されている。
- De Pooter J,Strisciuglio T,El Haddad M,et al. 肺静脈の再接続は単一の肺静脈の分離のプロシージャの後で患者の大半にもはや起こりません。 JACC Clin Electrophysiol2019;5:295-305。
- Das M,Wynn GJ,Saeed Y,et al. 症状に関係なく日常的な戦略としての肺静脈の再分離:圧力無作為化比較試験。 JACC Clin Electrophysiol2017;3:602-11.
- Wittkampf FHM、van Es R、Neven K.エレクトロポレーションと心臓カテーテルアブレーションのためのその関連性。 JACC Clin Electrophysiol2018;4:977-86。
- Reddy VY,Koruth J,Jais P,et al. 脈打った電界の心房細動の切除:心臓切除のための超急速な、ティッシュ選択的な様相。 JACC Clin Electrophysiol2018;4:987-95.
- Darrat Y,Morales G,Di BL,Natale A,Elayi CS. 耐久の肺静脈のAntral分離を達成する方法か。 2014年6月10日に発売された。
- Paiella S,Butturini G,Frigerio I,et al. 局所進行膵癌患者における不可逆的エレクトロポレーション(IRE)の安全性と実現可能性:前向き研究の結果。 2015年(平成32年)9月7日現在の世帯数と人口は以下の通りである。
- ヘラー R、ヘラー LC。 遺伝子エレクトロトランスファー臨床試験。 Adv Genet2015;89:235-62.
- Jais P,Takigawa M,Sacher F,et al. 動物モデルにおける二相性および単相性パルスフィールドアブレーションの比較。 2019年1月28日、fcバルセロナに移籍した。
- Witt CM,Sugrue A,Padmanabhan D,et al. 狭窄のない肺内静脈アブレーション:新しいバルーンベースの直流エレクトロポレーションアプローチ。 J Am Heart Assoc2018;7:e009575.
- van Driel VJ,Neven KG,van Wessel H,et al. カテーテルアブレーション後の肺静脈狭窄:エレクトロポレーション対無線周波数。 2014年7月7日、第734回衆議院議員総選挙に出馬し、初当選。
- 滝川M,Vlachos K,Viswanathan R,et al. 豚モデルにおけるパルス電界アブレーションを用いた上大静脈および肺静脈分離の急性結果。 ハートリズム2018;15:S178-179(abstr).
- Stewart MT,Haines DE,Verma A,et al. 心臓内パルスフィールドアブレーション:慢性ブタモデルにおける実現可能性の証明。 心のリズム2019;16:754-64.
- Neven K,van Driel V,van Wessel H,van Es R,Doevendans PA,Wittkampf F.心外膜電気穿孔カテーテルアブレーション後の心筋病変のサイズ。
- Neven K,van Driel V,van Wessel H,van Es R,Doevendans PA,Wittkampf F.心外膜電気穿孔カテーテルアブレーション後の 2014年7月、728-33歳でプロデビュー。
- 黒木K,Koruth JS,Pare M,et al. ブタにおける心内膜パルスフィールドアブレーションの病理学的所見の最初の報告。 2019年(平成21年)1月16日現在の世帯数と人口は以下の通りである。
- Neven K,van Es R,van Driel V,et al. ブタ食道に対するフルパワーエレクトロポレーションアブレーションの急性および長期的な影響。 2017年10月にはe004672が発売されている。
- McElderry H、Walcott G、Viswanathan R、Long G、Sauter E、Mickelsen S.ブタ食道への直接適用におけるパルス電界アブレーションの安全性。 J Cardiovasc Electrophysiol2018;29:657-78(abstr).
- van Driel VJ,Neven K,van Wessel H,Vink A,Doevendans PA,Wittkampf FH. 電気穿孔法の切除への右の横隔神経の低い脆弱性。 ハートリズム2015;12:1838-44.
- 黒木K,Koruth J,岩澤J,et al. 二相脈打った分野の切除の肺の静脈の分離:潅漑された無線周波数の切除との前臨床比較。 2019年1月28日、fcバルセロナに移籍した。
- Reddy VY,Neuzil P,Koruth JS,et al. 心房細動の肺静脈の分離のための脈打った分野の切除。 J Am Coll Cardiol2019;74:315-26.
- van Es R,Groen MHA,Stehouwer M,Doevendans PA,Wittkampf FHM,Neven K.カテーテルエレクトロポレーションアブレーション中のガス状微小塞栓の起源および特性のin vitro分析。 J Cardiovasc Electrophysiol2019;30:2071-9.
- Loh P,van Es R,Groen MHA,et al. 不可逆的なエレクトロポレーションによる肺静脈の分離:最初の人間の経験。 心のリズム2019;16:579.
- Jourabchi N、Beroukhim K、Tafti BA、Kee ST、Lee EE。 がん治療における不可逆的エレクトロポレーション(NanoKnife)。 2014年3月8日から18日まで放送された。
- López-Alonso B,Hernáez A,Sarnago H,et al. 平行プレート電極と高性能発生器を用いたブタ肝臓におけるエレクトロポレーション後の病理組織学的および超微細構造的変化。 2019年9月、2647人目のレスラーとなった。
臨床トピック: 不整脈および臨床EP、心臓外科、Dyslipidemia、侵略的な心血管の血管造影および介在、非侵襲的なイメージ投射、心膜疾患、EPの基礎科学、SCD/心室の不整脈、心房細動/上室性の不整脈、心臓外科および不整脈、脂質新陳代謝、介在およびイメージ投射、磁気共鳴イメージ投射
キーワード: Atrial Fibrillation, Cardiac Tamponade, Feasibility Studies, Follow-Up Studies, Stroke Volume, Catheter Ablation, Anti-Arrhythmia Agents, Endoscopy, Electroporation, Magnetic Resonance Imaging, Cohort Studies, Phrenic Nerve, Myocytes, Cardiac, Pulmonary Veins, Cicatrix, Microscopy, Electron, Scanning, Feasibility Studies, Prospective Studies, Tissue Scaffolds, Catheter Ablation, Constriction, Pathologic, Heart Atria, Heart Rate, Esophageal Fistula, Cryotherapy, Cardiac Surgical Procedures, Endocardium, Electroporation, Cell Membrane, Electrodes, Extracellular Matrix, Cell Death, Muscle, 骨格、肝臓、麻酔、全身、細胞増殖、脳卒中、膜脂質、新生物
<リストに戻る