新しい水酸化物イオンのほとんどが除去されるため、pHはあまり増加しません。
水素イオンとの反応による水酸化物イオンの除去
エタン酸のイオン化から存在するいくつかの水素イオンがあることを覚えておいてくださ
水酸化物イオンは水を作るためにこれらと結合することができます。
水酸化物イオンは水を作るためにこれらと結合することができます。
水酸化物イオンは水を作るためにこれらと結合することができます。
水酸化物イオンは水を作るためにこれらと結合することができます。
水酸化物イオンは水を作るためにこれらと結合することができます。 これが起こるとすぐに、平衡はそれらを置き換えるためにヒントします。 これは、水酸化物イオンの大部分が除去されるまで起こり続けます。繰り返しますが、平衡が関与しているため、すべての水酸化物イオンが除去されるわけではありません-ほとんどの水酸化物イオンのみが除去されま 形成された水は、いくつかの水素イオンと水酸化物イオンを与えるために非常に小さな程度に再イオン化します。P>
アルカリ緩衝液
アンモニアと塩化アンモニウム溶液の混合物を典型的に取ります。
アンモニアは弱い塩基であり、この平衡の位置は左によくなります:
![]()
![]()
これに塩化アンモニウムを加えると、余分なアンモニウムイオンがたくさん追加されます。 Le Chatelierの原理によれば、それは平衡の位置をさらに左に傾けるでしょう。したがって、溶液には次の重要なものが含まれます。
-
未反応アンモニアがたくさんあります。
-
塩化アンモニウムからのアンモニウムイオンがたくさんあります。
-
溶液をアルカリ性にするのに十分な水酸化物イオンがあります。存在する他のもの(水や塩化物イオンのような)は、議論にとって重要ではありません。
この緩衝液に酸を加える
あなたが加えている水素イオンを取除くことができる2つのプロセスがあります。
アンモニアとの反応による除去
水素イオンが衝突する可能性が最も高い塩基性物質はアンモニア分子です。 それらはアンモニウムイオンを形成するために反応する。

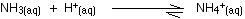
すべてではありませんが、ほとんどの水素イオンが除去されます。 アンモニウムイオンは弱酸性であるため、水素イオンの一部が再び放出されます。
水酸化物イオンと反応することにより、水素イオンの除去
アンモニアと水との間の反応から存在するいくつかの水酸化物イオンがあるこ水素イオンはこれらの水酸化物イオンと結合して水を作ることができます。
水素イオンは水素イオンと結合して水を作ることができます。
水素イオンは水素イオンと結合して水を作ることができます。
水素イオンは水素イオンと結合して水を作ることができます。
水素イオンは水素イオンと結合して水を作ることができます。
水素イオンは水素イオンと結合して水を作ることができます。 これが起こるとすぐに、平衡は水酸化物イオンを置き換えるためにヒントします。 これは、水素イオンのほとんどが除去されるまで起こり続けます。ここでも、平衡が関与しているため、すべての水素イオンが除去されるわけではありません-それらのほとんどだけです。
この緩衝液にアルカリを添加する
アルカリからの水酸化物イオンは、アンモニウムイオンとの簡単な反応によって除去される。p>
形成されたアンモニアは弱い塩基であるため、水と反応することができるので、反応はわずかに可逆的である。

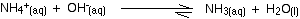
形成されたアンモニアは弱い塩基であるため、水と反応することができる。 これは、再び、水酸化物イオンの大部分(すべてではないが)が溶液から除去されることを意味する。
バッファソリューションを含む計算
これは簡単な紹介に過ぎません。 私の化学計算の本の10ページ以上のいくつかのバリエーションを含むより多くの例があります。
酸性緩衝液
これは、具体的な例で見るのが簡単です。 酸緩衝液は、弱酸とその塩の1つから作ることができることを忘れないでください。
0.10mol dm-3のエタン酸と0を含む緩衝液があったとしましょう。エタノ酸ナトリウムの20mol dm-3。 どのようにそのpHを計算しますか?
弱酸を含む溶液では、イオン化されていない酸とそのイオンとの間に平衡があります。
弱酸を含む溶液では、イオン化されていない酸とそのイ だから、エタン酸のために、あなたは平衡を持っています:

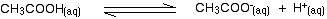
エタノ酸ナトリウムからのエタノ酸イオンの存在は、平衡を左に移動しましたが、平衡はまだ存在します。これは、平衡定数Kaを書くことができることを意味します。
それは、平衡定数Kaを書くことができることを意味します。:

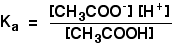
弱酸でこの式を使用して計算を行ったところ、水素イオンとエタノ酸イオンの濃度は同じであると仮定します。 分割されたエタン酸のすべての分子は、各種類のイオンのいずれかを与えます。
それはもはや緩衝液には当てはまりません:

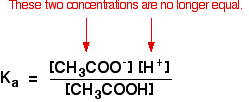
平衡がさらに左に押されている場合、エタン酸から来るエタン酸イオンの数は、エタン酸ナトリウムのものと比較して完全
したがって、エタノ酸イオン濃度は、エタノ酸ナトリウムの濃度と同じであると仮定します-この場合、0.20mol dm-3。弱酸計算では、通常、平衡時の酸の濃度が使用した酸の濃度と同じになるように、酸のほとんどがイオン化していないと仮定します。
弱酸計算では、酸の濃度がイオン化していないと仮定します。
これは、平衡がさらに左に移動した今ではさらに真実です。
だから、我々は緩衝液のために作る仮定は次のとおりです。

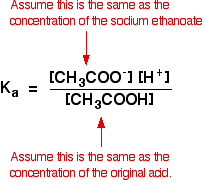
さて、我々はKaの値を知っていれば、我々は水素イオン濃度、したがって、pHを計算することができます。
エタン酸のKaは1.74×10-5mol dm-3です。
0.10mol dm-3のエタン酸と0.20mol dm-3のエタン酸ナトリウムを含む緩衝液のpHを計算したいことを覚えておいてください。

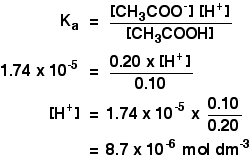
次に、あなたがしなければならないすべては、式を使用してpHを見つけることです
pH=-log10あなたはまだあなたの電卓上の水素イオン濃度の値を持っているので、ログボタンを押して、(pH式のマイナス記号を可能にするために)負の符号を無視します。あなたは5.1から二つの有効数字の答えを得る必要があります。
あなたの濃度は二つの数字にのみ与えられたので、あなたは、これよりも正確にすることはできません。