1960年代初頭には、生物学者は、異なる種シーケンスレベル(Zuckerkandl1962,margoliash1963,doolittle&blombäck1964)。 分析されたタンパク質には、ヘモグロビン(Zuckerkandl&Pauling1962)、シトクロムC(Margoliash1963)、フィブリノペプチド(Doolittle&Blombäck1964)が含まれていた。 これらの初期の研究は、異なる種のタンパク質配列間の差の数が、種の発散からの時間にほぼ比例することが明らかになった(図1)。
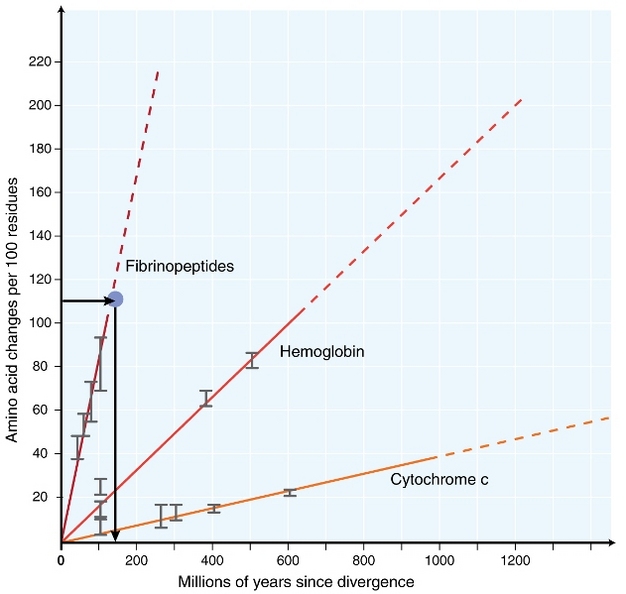
Zuckerkandl&Pauling(1965)は、時間の経過とともにアミノ酸置換が一定に蓄積されることを時計の規則的な”ティック”に例え、”分子進化時計が存在するかもしれない”と述べた。 したがって、”分子時計”という用語は、種の発散以来の時間に比例して起こるアミノ酸の変化を記述するために最初に造語されました。
最初の使用以来、「分子時計」という用語は多くの異なる文脈で使用されてきました。 今日では、与えられた系統のDNAまたはタンパク質の配列に蓄積された変化の数、または”置換”を単に指すために使用されることが多い。 定義された時間単位あたりの置換の数は、分子時計の「速度」として記述することができ、これはこの文脈では「進化速度」に相当する。 初期の含蓄はまだいくつかのケースで保持していることに注意してください。 例えば、人々が”分子時計を仮定した”と述べるとき(特に系統解析では)、置換の数は時間の経過とともに絶えず起こると仮定されたことを意味する。
一定の分子時計の概念は、進化生物学者にとって特別な意味を持っています。 最初に提案された一定の分子時計が本当に存在していれば、進化事象のタイミングを推測することはかなり簡単な問題になるでしょう(図1)。 しかしながら、置換が異なる系統において時間の経過とともに絶えず起こらないことが豊富に明らかになっている(Kumar2005)。 それにもかかわらず、分子時計の概念は、分子進化の分野で非常に影響を与えてきました。 分子時計の概念に触発された最も重要なアイデアの一つは、分子進化の中立理論です。
分子時計と中立性
一定の分子時計のアイデアが最初に現れたとき、アミノ酸やヌクレオチドの置換の根底にある主な進化力は自然選択であると考えられていた。 この考え方に従えば、一定の分子時計は、異なる種における適応置換が時間の経過とともに絶えず起こることを示すであろう。 しかし、このような時計のような方法で適応置換がどのように起こるかを説明することは困難である。 理論的には、適応突然変異の運命は、その突然変異の選択的利点の強さ、有効な集団の大きさ、適応突然変異率などのいくつかの進化的パラメータによって決定される(Kimura1983)。 これらのパラメータは、特定の突然変異およびそれらの環境との相互作用に応じて、種間、および種内でさえ異なる可能性が高い。 代わりに、Kimura(1968,1969)は、分子レベルでのほとんどの変化は機能的な結果がほとんどないか、または「中立」であると提案した。 突然変異が適合性の結果を有さない場合、集団におけるその運命はランダムな偶然によって完全に決定される。 これは、特定の中立突然変異が最終的に集団に固定されるかどうかを予測することができないことを意味します。 しかし、集団において中性置換が起こる速度は、単一のパラメータ、すなわち突然変異率に依存するため予測することができる(Kimura1968)。
一倍体の個体数がN個の集団を想像してみましょう。
これらの新しい変異はすべて中性であるため、それらの運命は偶然によって完全に決定されます。 言い換えれば、すべての突然変異は固定に達する可能性が等しい(これは「置換」につながる)。 置換が発生した場合、それぞれの新しい中性突然変異が固定に達する確率は、単に1/Nである。 置換率は、各世代における新しい突然変異の数(Nu)に、それぞれの新しい突然変異が固定(1/N)に達する確率を乗じたものとして計算され、これはuに等しい。 したがって、ほとんどの突然変異が中立であり(中立理論で提案されているように)、突然変異率が経時的に一定である場合、置換も経時的に絶えず起 次に、分子レベルで時計のような規則的な置換率を観察する必要があります。 木村(1969)はこのように、タンパク質配列における比較的一定の分子時計の観察を、分子進化の中立理論の強力な支持と考えた。
中性分子時計がどのように実行されるかをテスト
中性理論によると、置換率が時間の経過とともに一定であるかどうかの問題は、中性突然変異率が時間の経過とともに一定であるかどうかと同等である。 このため、その後の多くの研究では、中性部位からのデータを分析して、中性突然変異率が実際に一定であるかどうかを判断することに焦点を当てた。 分子時計に関する理論的な議論を議論する前に、これらの研究がどのように実装されているかを簡単にレビューします。 タンパク質分子時計の解析も継続されていますが、タンパク質分子時計の変動を取り巻く議論は中性分子時計に関するものとは大きく異なり、この記事には含まれません。 興味のある読者は、Gillespie(1991)、Kumar(2005)、Kim and Yi(2008)、およびBedford et al. (2008).
中性分子時計の経験的分析のほとんどは、中性突然変異率が中性置換率から推測できるという定理に依存している(Kimura1968,1969)。 実際には、各研究では、ゲノム中の特定のタイプの部位を中性部位として定義し、それらの部位の系統間の置換率を比較する。
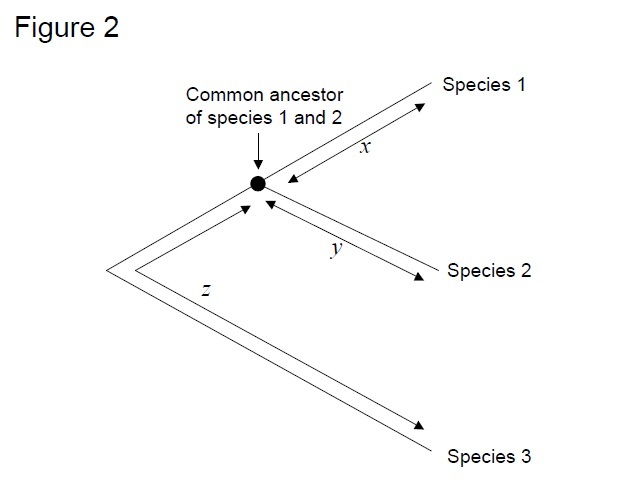
ゲノム内のどの部位が本当に中立であるかを完全に決定することはできませんが、科学者はいくつかの有用なプロキシを考え出しました。 ゲノム配列決定の時代の前に、ほとんどの利用可能な配列データは、タンパク質をコードするDNA配列からのものでした。 研究では、多くの場合、タンパク質コードDNA配列を二つのタイプの部位に分割する(Wu&Li1985)。 第一のタイプの部位には、任意の変化がアミノ酸置換につながる部位、または「非synonymous部位」が含まれる。 第二のタイプの部位、「同義部位」には、コドン表中の「縮重」位置をコードする部位が含まれ、変化はアミノ酸置換をもたらさない。 例えば、TCTおよびTCCは両方ともセリンをコードする。 これらのコドンの第三の位置が変化した場合、それらは依然として同じアミノ酸を産生する。 そのような置換は、自然選択にはあまり見えないであろう。 その結果,同義語部位の分子時計は,非同義語時計よりも中性分子時計に近いはずである。 配列決定技術が進歩するにつれて、いくつかの研究では、成熟したmrnaに組み込まれておらず、したがって中性である可能性が高いため、中性部位のプロキ 2002). 種の分岐のずっと前に挿入された不活性な転置可能な要素の配列もしばしば用いられた(これらはしばしば「先祖の反復」と呼ばれ、例えば、Thomas et al., 2003). 最後に、いくつかの研究では、全ゲノム整列から抽出された非コードDNA配列(タンパク質をコードするDNA配列を除去した後の全配列)を使用して、中性分子時計(Elango e t a l. 2 0 0 6,Huttley e t a l. 2007). 最も一般的に使用されるテストは、いわゆる”相対レートテスト”です(Sarich&Wilson1973)。 当初、単位時間当たりの置換率は、異なる種のタンパク質間の差(置換)の総数を分岐時間で除算することによって推定され、化石記録から推定された(図1)。 しかし、化石記録は多くの比較では利用できず、大きな誤差マージンに関連しています。 相対速度テストは、化石記録の必要性を克服します(図2)。 対象となる2つの系統のアウトグループ配列が存在する限り、分岐の絶対時間を知らなくても、2つの分岐が同じ分子時計に従うのか異なる分子時計に従うのかを判断することができます(図2)。
中性分子時計の決定要因は何ですか?中性分子時計をめぐる議論の中心にあるほとんどすべての論争は、突然変異の主要な原因が何であるかという問題に由来する。
この質問は、進化の変化と遺伝病の究極の原因である突然変異のパターンを理解することに直接関係しています。 さらに、変異率が系統間およびゲノム内でどのように変化するかを理解することは、機能的に重要なゲノム領域を同定するために配列比較を使用 では、中性突然変異率を決定するのは何ですか?
中性分子時計への最も重要な貢献者の一つは、世代時間の系統特異的な変化です。 初期から、一定の中性分子時計のアイデアは、生殖系列変異の分子メカニズムと対立していると認識されていました。 大部分の突然変異は生殖系列におけるDNA複製の誤りから生じると長い間考えられてきた(Haldane1 9 4 7,Muller1 9 5 4)。 突然変異は生殖系列DNAが次の世代のために複製されるときに起こるので、それらは絶対的な時間量ではなく世代数に比例して蓄積するべきである。 したがって、分岐後に二つの系統に蓄積された置換の数を比較すると、より長い世代の系統、より少ないDNA複製イベントを受けた系統は、より短い世代の系統と比較してより少ない置換を保持するであろう。 その結果、分子時計は、より長い生成時間を持つ種でよりゆっくりと実行されるべきである。 このアイデアは、「生成時間効果」と呼ばれます。
実際には、発生時間効果は、分子時計に関する議論の前でさえ、霊長類の研究で最初に観察されました。 当時種の関連性を調査するために免疫学的方法を使用していたMorris Goodmanは、古い世界のサルと比較して、類人猿、特にヒトでは、いくつかのタンパク質が発散する速度が減少しているように見えることを観察した(Goodman1961、1962、1963)。 この効果は、’人類型の速度の減速’と呼ばれています。 人類型は旧世界のサルよりも長い世代時間を持っているので、この観察は世代時間効果によって説明することができます。 Li(1985)は、DNA配列データを使用して生成時間効果仮説を最初にテストしました。 彼らは霊長類とげっ歯類の11の遺伝子からのデータを使用しました。 霊長類はげっ歯類よりもはるかに長い生成時間を持っているので、分子時計は霊長類に比べてげっ歯類で高速でなければなりません。 実際、彼らは、同義語部位では、げっ歯類が霊長類と比較して約2倍の分子進化速度を示すことを見出した(Wu&Li1985)。 しかし、nonsynonymousサイトでは、そのような効果は見出されなかった。 言い換えれば、中性分子時計ではなく、アミノ酸分子時計は、世代時間効果の考えによく合う霊長類の系統に比べてげっ歯類の系統でより速くダニ。
その後の研究は、人類似率の減速に対するさらなる支持を提供した(Li&Tanimura1987、Bailey et al. 1991)およびげっ歯類と霊長類の系統との間の速度差(Gu&Li1992,Huttley et al. 2007). さらに、特に霊長類では、より小さな系統発生スケールで速度差が観察された: 例えば、ヒトの分子時計はチンパンジーの分子時計よりも遅く動く(Elango et al. 新世界のサルの割合は、ヒト科や旧世界のサルの割合よりも速い(Steiper&Young2006)。 これらの研究で観察された分子時計の異なる速度は、生成時間効果と定性的に一致している。 しかし、系統間の実際の差は、生成時間の差と定量的に一致していない。
しかし、系統間の実際の差は、生成時間の差と定量的に一致しない。 例えば、Kumar&Subramanian(2002)は、霊長類とげっ歯類の間の生成時間の差が人間と旧世界のサルの間のそれよりもはるかに大きいにもかかわらず、観測された分子時計の違いは、これら二つの比較において類似していることを示した。 Kumar&Subramanian(2002)は、”異種”置換パターンを示すデータを削除するために特定の統計フィルタを使用したことに注意する価値があります(Yi et al. 2002). それにもかかわらず、霊長類とげっ歯類の分子時計の違いは、Wu&Li(1985)によって最初に提案されたものよりもはるかに少ないようです。 例えば、Huttley e t a l. (2007)は、オポッサムを含むいくつかの種の全ゲノム整列を分析し、ユーテリアン系統とオポッサム系統の間の率差(-30%)は、ヒトとマウス系統の間の率差(-14%)よりもはるかに大きいことを示した。 これらの例は、データセットと統計的方法の違いのために、分子時計の違いの程度が異なる研究間で有意に変化することを示している。 彼らはまた、系統間の速度差は、世代時間の差だけでは完全には説明できないことを示している。 明らかに、中性分子時計への他の貢献者があります。
確かに、世代時間以外の生命史の形質は分子時計と共変化するように見える。 Martin&Palumbi(1993)は、DNA分子時計が小さな体サイズの種でより速く動くことを示しました。 この観察は、代謝率が分子時計の重要な決定要因であるという仮説につながった。 高い代謝率は、変異率を増加させる変異原性酸素ラジカルを大量に生成する(Rand1994)。 代謝率と体の大きさは一般に生成時間とともに共変化するため、これらのうちのどれが分子時計速度の主要な決定要因を構成するかを区別するこ ツァンテス&Steiper(2009)は、霊長類のデータに基づいて、体の大きさではなく、最初の生殖時の年齢が分子時計の主な決定要因であると提案している。 最初の再生時の年齢は生成時間効果を反映しているので,この研究は生成時間効果が分子時計の主な決定要因であるという考えを支持する。 しかし、この研究はまだ限られた数の系統に基づいています(4組の種が使用されました)。 したがって、体の大きさ、生成時間効果、および代謝率を区別することは、中性分子時計を一般化し理解する上で重要な問題として残っている。
さらに、DNAメチル化のような世代時間と同時変化しない因子の重要性がますます高く評価されている。
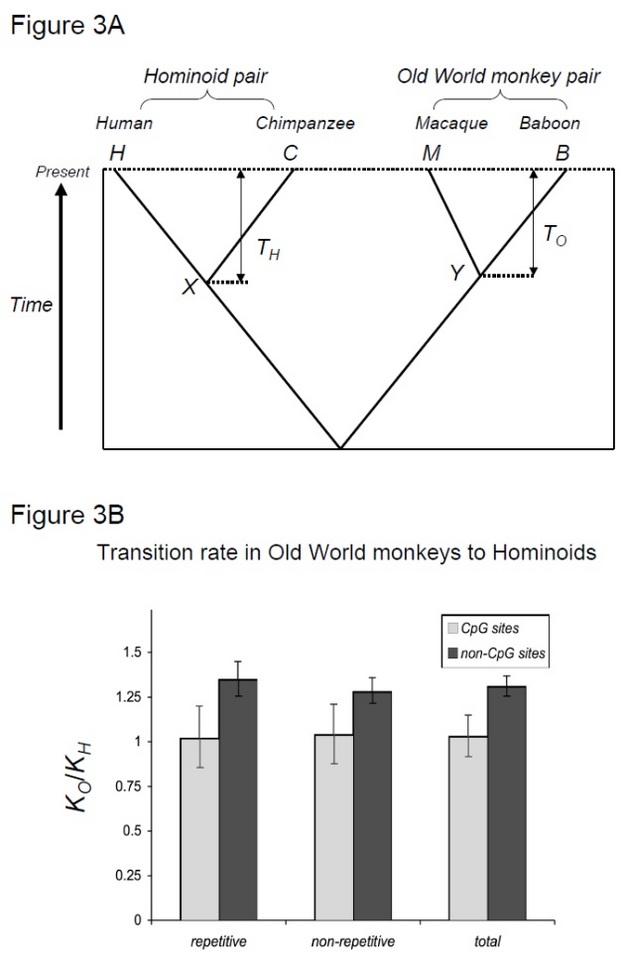
さらに、DNAメチル化のような世代時間と同時変化しない因子の重要性がますます高く評価されている。 DNAメチル化は、多様な分類群に見られるゲノムDNAの化学的修飾である。 動物のゲノムでは、DNAメチル化は、グアニン(いわゆる”CpGの)に続いてシトシンでほぼ独占的に発生します。 メチル化されたシトシンは、化学的不安定性のためにチミンに急速に変異する傾向がある(Bird1980)。 実際、ヒトゲノムにおいて、DNAメチル化によって引き起こされる変異は、他の変異よりも一桁以上頻繁に起こる(Nachman<div id=”E1e6e7 1 7 3a”>Crowell2 0 0 0,Elango e t a l. 2008). DNAメチル化によって引き起こされる変異は、DNA複製とは大きく独立して起こるため、そのような変異は他のものとは異なる分子時計に従う 具体的には、生成時間依存性の代わりに、DNAメチル化によって引き起こされる突然変異は、Zuckerkandl&Paulingによって最初に提案されたものと類似した時間依存性分子時計に従うことができる(Kim et al. 2006)! この仮説を検証するために、Kim et al. (2006)は、ヒト-チンパンジーの発散をマカク-ヒヒの発散と比較した(類似した発散時間を共有するが、世代時間が異なる二つの種のペア)(Steiper et al. 2004). ヒト-チンパンジーのペア(ヒト科のペア)は、マカク-ヒヒのペア(旧世界の猿のペア)に比べてはるかに長い世代の時間を持っています。 この研究は、非CpGサイトのために、旧世界の猿のペアは、前述の人類の速度減速効果によって説明することができ、約30%以上の置換を蓄積したことを示 対照的に、CpGサイトの分子時計は、人類型と旧世界のサルのペアで同様の数の置換を示しました(図3)。 したがって、時間依存性および生成時間依存性の分子時計は、同じゲノム内に共存する。 単一の分子時計が与えられた系統のために存在する可能性があるという仮定は、支配的な変異力がゲノム領域間で異なるため、もはや有効ではない。
結論
一定の分子時計の概念は、限られた量のタンパク質配列データに基づいて最初に提案されました。 その後の研究では、このような観察はアミノ酸の一般的なパターンではないことが示されたが、分子進化の分野、特にDNA配列データの中立的な分子進化論の開発に大きな影響を与えている。 中立理論に続いて、研究は中立突然変異率の変化のパターンを解明することに焦点を当てた。 過去数十年の間に、我々は分子時計が系統間で異なる速度で動くことを観察した。 さらに、変動の程度は、異なるタイプのデータおよび使用される特定の統計的方法に依存して変化し得る。 生成時間効果は定性的レベルで保持し続けているが、系統間の中性突然変異率の定量的変動を説明するには不十分である。 DNAメチル化によって引き起こされるような生命史形質および非複製依存性変異も、ゲノム分子時計の重要な貢献者である。 確かに、異なるタイプの分子時計は、ゲノム内でも観察されます。 したがって、ゲノムごとに単一の中性分子時計を仮定するのではなく、今後の研究では、ゲノムの変異ランドスケープについて学ぶために、ゲノム中性分子時計の変化を明らかにすることを目指すべきである。 このような情報は、分子進化や遺伝病を支配する原料の理解に有用であるだけでなく、機能的ゲノム領域を同定するための比較および機能的ゲノム解析に影響を与える重要な要素を構成している。