タンパク質の一次構造は、それが構成されているアミノ酸の配列と この配列は、タンパク質中の原子の配置、成分アミノ酸残基の化学的性質、およびタンパク質の環境に関する空間的な制限に従って、タンパク質が採用する形状を最終的に決定する。
ポリペプチド中のアミノ酸残基をリンクするペプチド結合は、あるアミノ酸の酸性カルボキシル基と別のアミノ酸の塩基性アミノ基との縮合反応で形成される。 ペプチドの文脈では、アミド基(CO−N H)はペプチド基と呼ばれる。
タンパク質構造の理解に重要なのは、ペプチド結合の構造の知識です。 Linus Paulingは1930年代に、2つのアミノ酸の間に形成されるペプチド結合の性質を調べるためにX線回折を使用しました。 彼はペプチドグループ(CO–NH)が堅い平面構造を持っていることを報告しました。 この構造は、カルボニル基の二重結合の電子とC–N結合の電子との間の相互作用によるものであり(図2)、後者は部分的(約40%)二重結合特性を獲得する。


平面ペプチド結合の二つの可能な立体配座があります: トランスペプチドグループでは、Ca原子はペプチド結合の反対側にあり(図3a)、cisペプチドグループではCa原子はペプチド結合の同じ側にあります(図3b)。
-
ペプチド結合のcisおよびtrans立体配座における原子の空間的配置および近接性を考慮すると、どの立体配座が好まれると思いますか?
-
トランス立体配座は、立体障害を最小限に抑えるので、シス立体配座よりもエネルギー的に有利であろう。
一般的に言えば、ペプチド結合はトランス立体配座にある。 ただし、cisの形態はプロリンの残余に先行するペプチッド結合に起こることができます。 そのような場合、cisの形態はプロリンの側鎖が妨害のより少しを提供するので通常より安定しています。 それにもかかわらず、シスのペプチッド結合はプロリンの残余に先行するペプチッド結合の例のおよそ10%にだけ発生します。
ペプチド基の平面性を念頭に置いて、ポリペプチド鎖は、Ca原子によって連結された一連の剛体平面ペプチド基からなる骨格を有することが見 図4は、trans立体配座に二つの平面ペプチド基を有するポリペプチドの一部を示す。 ペプチド結合の周りの回転は許可されないが、Ca−NおよびCa−C結合の周りの回転の可能性があることに留意されたい。 これらの結合に関するねじり角度と呼ばれる回転角度は、ポリペプチド骨格の立体配座を指定する。 Ca−N結合およびCa−C結合の周りのねじり角は、θ(φ)およびθと呼ばれる。 図4に示されるように、ポリペプチドが拡張された平面立体配座にあるとき、それらはそれぞれ1 8 0°と定義される。
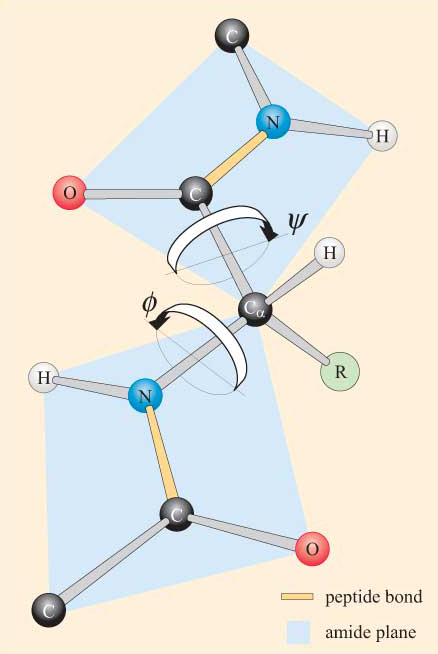
これらの立体的制約の結果として、γおよびγの特定の値、したがってペプチドの立体配座のみが許可される。
ポリペプチドの文脈で所与の残基についてこれらの許容される値を計算することが可能である。
ポリペプチドの文脈で所与の残基につ この計算は、最初にπとπのすべての可能な値で2つの隣接するペプチド基(図4のような)内のすべての非結合原子間の距離を決定することによっ それはちょうど1種類のアミノ酸を含んでいるポリペプチドのために最も容易にされます。 特定の残基に対するσに対するσの立体配座プロットは、(その発明者、G.N.Ramachandranにちなんで)Ramachandranプロットとして知られている。 このようなプロットは、次の基準に従って、立体的に好ましいまたは好ましくない(図5のように)立体的に好ましいまたは好ましくない立体配座を同定することを可能にする。
-
非結合原子のファンデルワールス半径の間に矛盾がない場合、立体配座は”許可される”。 これらの立体配座は、図5の青い領域にあります。
-
許容される極限で原子間距離を必要とする立体配座は、”外側の限界”立体配座として定義されます。 それらは図5の緑の領域にあります。
-
任意の二つの非結合原子がそれらのファンデルワールス半径よりも互いに近いことを必要とする理論的配座は、立体的に”禁止”されている。 これらは、図5の白い領域にあります。
図5のπとπの値は−180πから+180πの範囲であることに注意してください。 ペプチドグループを360ºに回すと、もちろん開始位置に戻り、−180ºと+180ºは同じ位置に対応します。 したがって、図5のプロットの左下隅にある緑色のストリップは、左上隅にあるフィールドと連続しています。

-
図表5かどうか判断するために以下の値のɸとψは立体的に好ましくは不利な(a)ɸ=90°、ψ=90°(b)ɸ=−90°、ψ=90°.
-
(a)好ましくない; (b)有利です。
ラマチャンドランプロットは、20個のアミノ酸のそれぞれのポリマーに対して構築することができます。 多くのアミノ酸残基に対するラマチャンドランのプロットは、一般的に非常に類似しており、良好または許容される立体配座を有する三つの領域のみを有することに注意することは重要である(図5のポリ-l-アラニンのプロットでは1-3とラベル付けされている)。 違いは、しかし、発生します。 例えば、側鎖(図4のR)がCaの近くで分岐している場合、スレオニンの場合のように、それはペプチド骨格に近いより多くのスペースを占有し、隣接するペプ その結果、許容される立体配座(θおよびθ角)は、分岐アミノ酸のポリペプチドに対してより制限される。
-
プロリンは、許容される立体配座の点で他のアミノ酸とは全く異なり、ポリプロリンについては、−85μから−35μまでのσ値のみが許容される。 Prolineの構造について考えると、この比較的狭い範囲の許容されるɸ値をどのように説明できますか?
-
プロリンの側鎖はアミノ基のNに共有結合しているため、ポリプロリンでは、他のアミノ酸よりもCa-N結合に関する回転の自由度が低 その結果、許容されるγ値は、他のアミノ酸と比較して比較的制限される。
-
図6は、ポリペプチド鎖中のグリシン残基のラマチャンドランプロットを示しています。 これらの領域は、図5のように色分けされています。 グリシンが採用する立体配座について何を言うことができますか? グリシンの構造を考えてみましょう。 グリシンはなぜその立体配座に関して他の残基と異なるのですか?
-
グリシンは、立体的に妨げられないため、他のアミノ酸残基よりもはるかに大きな立体配座の自由度を持っています。

図5および図6のRamachandranプロットは、原子のファンデルワールス半径の既知の値から決定された原子間接触の許容距離および外側の限界距離に基づいて、それぞれl-アラニンおよびl-グリシンに対して生成されている(表1)。
表1原子間接触のファンデルワールス距離。
コンタクトタイプ
通常許可されている/Å
外側の制限/Å
H···H
2.0
1.9H···O 2.4 2.2 H···N 2.4 2.2 H···C 2.4 2.2 2.2 2.2 2.2 2.2 2.2 2.2 2.2 2.2 2.2 2.2 2.2 2.2 2.2 2.2 o···o 2.7 2.6 o···n 2.7 2.6 o···c 2.8 2.7 2.7 2.7 2.7 2.7 2.7 2.7 n n n n n n n n n n n n n n n n n n /t>2.7 2.6 n c 2.9 2.8 c···c 3.0 2.9 c···ch2 3.2 c···ch2 3.2 c***ch2 3.2 c***ch2 3.2 c***ch2 3.2 3.2 3.2 3.2 3.2 t>3.0 ch2***ch2 3.2
3.0
したがって、実際の立体配座プロットではなく予測的です。 もちろん、x線回折を使用して、ポリペプチド中の残基に対するγおよびγの「実際の」値を実験的に決定することができる。 図7では、いくつかの異なる構造のすべての残基(グリシンおよびプロリンを除く)のσおよびσ値は、高分解能X線回折によって決定され、ラマチャンドランプロット上にプロットされている。 予測された立体配座と実際の立体配座の間には顕著な対応があることがわかります。 しかし、立体配座が”禁止された”領域にマップするいくつかの残基があることに注意してください。 これらの残基の大部分は、λ=0の周りの「許容される」領域2と3の間の領域にマッピングされる。

-
図4をもう一度見て、θ=0になるように最上位のペプチドグループを180°でねじることができると想像してください。 どのようなグループがこの立体配座で競合する可能性がありますか?
-
隣接するペプチド基のN–H基は互いに衝突し、強制的に近接します。
-
隣接するペプチド基のN-H基は互いに衝突します。
これらの立体配座に関連する競合は、ペプチド結合のわずかなねじれによって対応することができる。 したがって、このような立体配座では、ペプチド基はその通常の平面立体配座からねじれている。特定の残基の限られた数の「禁止された」立体配座は、全体として、採用された立体配座がエネルギー的に有利である場合、ポリペプチドにおいて許容され得る。
ポリペプチドは、それが最も安定な立体配座を採用するように折り畳む傾向があるであろう。 この立体配座では、ポリペプチドはその自由エネルギーを最小化する。 次のセクションでは、このより高いレベルのタンパク質構造を見ていきます。