9.5オクテット規則の違反
学習目的
- オクテット規則の違反の三つの主要なタイプを認識します。
オクテット則が化学結合にあるのと同じくらい重要で有用なので、いくつかのよく知られた違反があります。 これは、オクテット規則が役に立たないことを意味するものではありません—全く逆です。 多くのルールと同様に、例外や違反があります。
オクテット規則には三つの違反があります。 奇数電子分子原子の価電子殻に奇数の電子を持つ分子。 オクテット規則に対する最初の違反を表します。 それらは少数であるが、いくつかの安定な化合物は、それらの原子価殻に奇数の電子を有する。 奇数の電子では、分子内の少なくとも1つの原子がオクテット則に違反しなければならない。 安定な奇数電子分子の例は、NO、NO2、およびClo2である。 NOのルイス電子ドット図は次のとおりです。
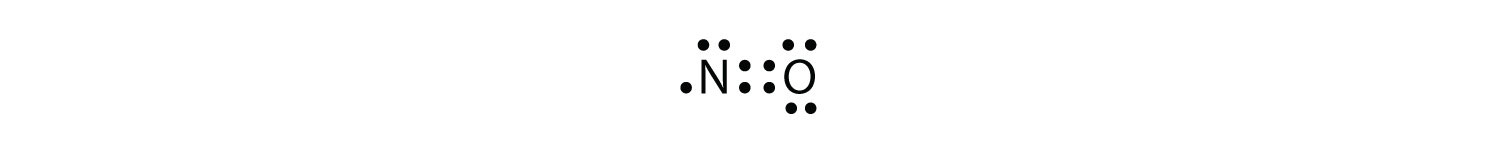
O原子は電子のオクテットを持っていますが、N原子はその価電子殻に七つの電子しか持っていません。 NOは安定な化合物ですが、他のほとんどの奇数電子化合物と同様に、非常に化学的に反応性があります。
電子欠損分子原子の価電子殻に8個未満の電子を有する分子。 オクテット規則に対する第二の違反を表します。 これらの安定な化合物は、分子内の原子の周りに八つ未満の電子を持っています。 最も一般的な例は、ベリリウムとホウ素の共有結合化合物である。 例えば、ベリリウムは2つの共有結合を形成することができ、その価電子殻には4つの電子しか存在しない。:
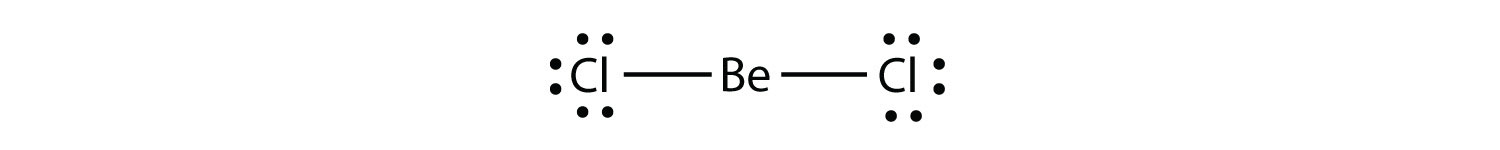
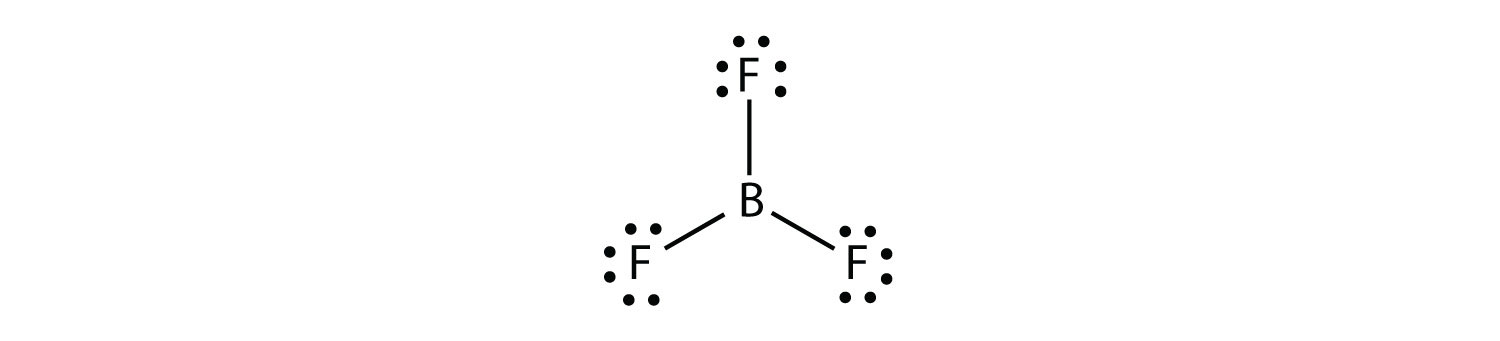
ホウ素は一般的に3つの共有結合のみを作り、B原子の周りに6つの価電子しか得られません。 よく知られている例はBF3です:
オクテット則への第三の違反は、それらの原子価殻に割り当てられた八つ以上の電子を持つ化合物 これらは拡張原子価殻分子と呼ばれます原子の原子価殻に8つ以上の電子を持つ分子。. このような化合物は、共有結合に関与し得るそれらの原子価殻に空のd軌道を有する周期表の第三列またはそれ以降の中心原子によってのみ形成 そのような化合物の1つがPF5である。 この化合物のための唯一の合理的なルイス電子ドット図は、5つの共有結合を作るP原子を持っています:
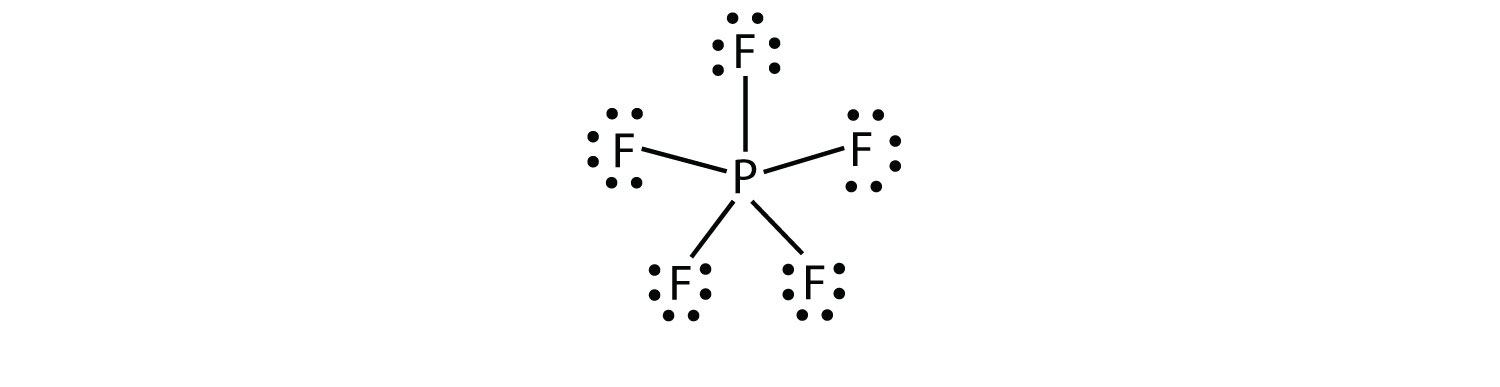
正式には、P原子
例9
ルイス電子ドット図を描くことによって、オクテット規則に対する各違反を特定します。1つのCl原子と1つのO原子を持つこの分子は6+7=13の価電子を持つので、奇数電子分子です。
- ClO
- SF6
溶液
-
1つのCl原子と1つのO原子を持つこの分子は、6+7=13の価電子を持つので、奇数電子分子です。 この分子のルイス電子ドット図は次のとおりです。

-
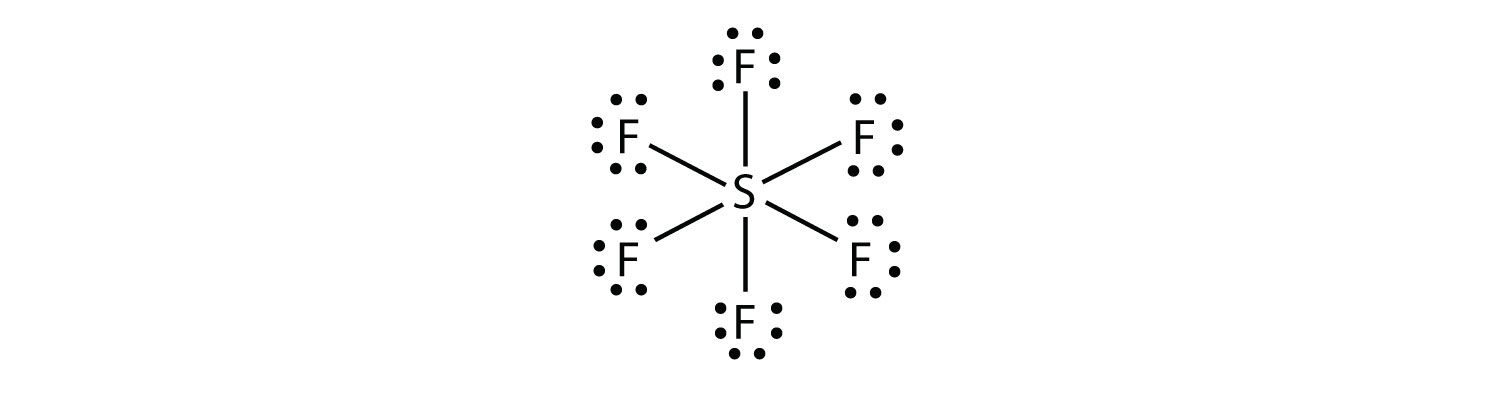
SF6では、中心のS原子は周囲のF原子に六つの共有結合を作るので、展開された原子価シェル分子である。 そのルイス電子ドット図は以下の通りである:/p>
自分自身をテスト
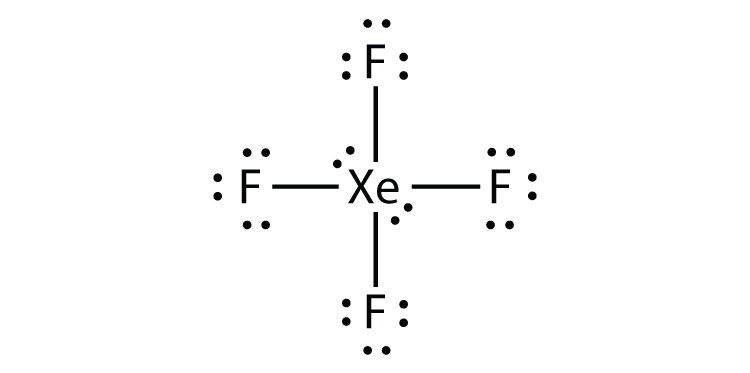
ルイス電子ドット図を描くことによって、Xef2のオクテット規則への違反を識別します。
答え
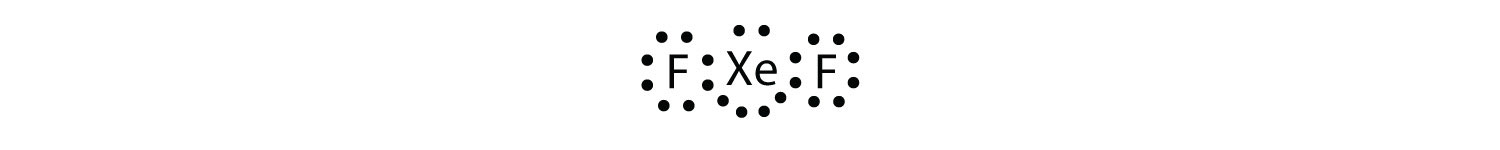
Xe原子は、その周りに8つ以上の電子を持つ拡張された原子価殻を持っています。
キーテイクアウト
- オクテット則には、奇数電子分子、電子欠損分子、および拡張原子価殻分子の三つの違反があります。
演習
-
なぜ奇数電子分子はオクテット則を満たさないのですか?なぜ周期表の2番目の行の原子が展開された原子価シェル分子を形成できないのですか?
-
オクテット則に違反するこれらの分子に対して許容可能なルイス電子ドット図を描画します。
- NO2
- Xef4
-
オクテット則に違反するこれらの分子に対して許容可能なルイス電子ドット図を描画します。
- Bcl3
- Clo2
-
オクテット則に違反するこれらの分子に対して許容可能なルイス電子ドット図を描画します。p>
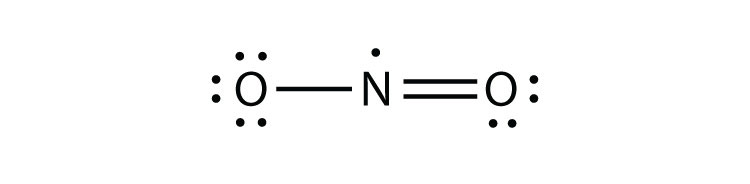
- POF3
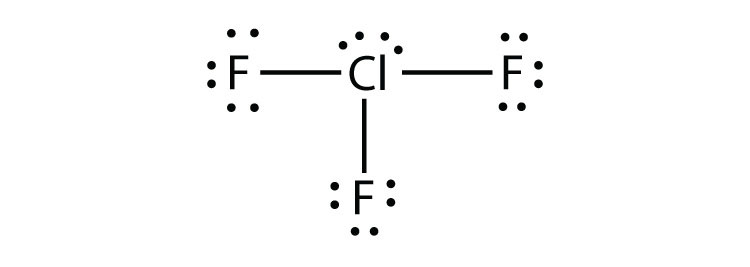
- Clf3
-
オクテット則に違反するこれらの分子に対して許容可能なルイス電子ドット図を描画します。
- SF4
- Beh2
答え
-
それらの奇数がある場合、すべての電子がペアになる方法はありません。
-
-
-
-
-
-