生体病態生理
インスリン合成および分泌
インスリンは、約6000ダルトンの分子量を有する小 それはジスルフィド結合によって一緒に保持された二つの鎖で構成されています。 右の図は、ウシインスリンの分子モデルを示し、A鎖は青色で、より大きなB鎖は緑色である。 このようなモデルを自分で操作することで、インスリンの構造をよりよく理解することができます。
アミノ酸配列は脊椎動物の間で高度に保存されており、ある哺乳動物からのインスリンはほぼ確実に別の哺乳動物で生物学的に活性である。
今日でも、多くの糖尿病患者は豚の膵臓から抽出されたインスリンで治療されています。
インスリンの生合成
インスリンは、膵臓のベータ細胞においてのみ有意な量で合成される。 インスリンmRNAはプレプロインスリンと呼ばれる一本鎖前駆体として翻訳され、小胞体への挿入中にそのシグナルペプチドを除去するとプロインスリンが生成される。
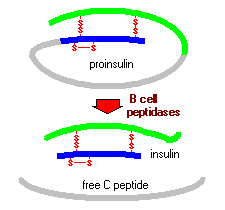 プロインスリンは、アミノ末端B鎖、カルボキシ末端A鎖、およびcペプチドとして知られている中間の接続ペプチドの三つのドメ 小胞体の中では、proinsulinはそれによりインシュリンの成長した形態を発生させるCのペプチッドを切除する複数の特定のendopeptidasesに露出されます。 インスリンと遊離Cペプチドはゴルジ中に封入され,細胞質に蓄積する分泌か粒になる。
プロインスリンは、アミノ末端B鎖、カルボキシ末端A鎖、およびcペプチドとして知られている中間の接続ペプチドの三つのドメ 小胞体の中では、proinsulinはそれによりインシュリンの成長した形態を発生させるCのペプチッドを切除する複数の特定のendopeptidasesに露出されます。 インスリンと遊離Cペプチドはゴルジ中に封入され,細胞質に蓄積する分泌か粒になる。
β細胞が適切に刺激されると、インスリンはエキソサイトーシスによって細胞から分泌され、膵島毛細血管血中に拡散する。 Cのペプチッドはまた血に分泌しますが、知られていた生物学的活性がありません。
インスリン分泌の制御
インスリンは、主にグルコースの血中濃度の上昇に応答して分泌される。 これはインシュリンが細胞にブドウ糖の記入項目の促進の”担当”であるので理にかなっています。 いくつかの神経刺激(例えば 食品の視力と味)およびアミノ酸および脂肪酸を含む他の燃料分子の血中濃度の増加も、インスリン分泌を促進する。
インスリン分泌の背後にあるメカニズムの私たちの理解はやや断片的なままです。 それにもかかわらず、このプロセスの特定の機能は、以下のモデルをもたらし、明確かつ繰り返し実証されている:
- グルコースは、グルコース輸送体を介; 細胞外液中のグルコース濃度の上昇は、β細胞内のグルコース濃度の上昇をもたらす。
- ベータ細胞内のグルコース濃度の上昇は、最終的に膜脱分極および細胞外カルシウムの流入をもたらす。 結果として生じる細胞内カルシウムの増加は,インスリン含有分泌か粒のエキソサイトーシスの主な引き金の一つであると考えられている。 Β細胞内のグルコースレベルの上昇が脱分極を引き起こすメカニズムは明らかに確立されていないが、グルコースおよび細胞内の他の燃料分子の代謝に起因するようであり、おそらくATP:ADP比の変化として感知され、膜コンダクタンスの変化に変換される。
- β細胞内のグルコースレベルの増加は、インスリン分泌に関与するカルシウム非依存性経路を活性化するように見える。インスリン放出の刺激は、動物全体または人々において容易に観察される。 人間およびほとんどのほ乳類の正常な絶食の血ブドウ糖の集中はインシュリンの分泌の非常に低レベルと関連付けられる100つのmlごとの80から90
右の図は、空腹時の2-3倍の血中濃度を1時間維持するのに十分なグルコースを注入したときのインスリン分泌への影響を示しています。 注入が開始された直後に、血漿インスリンレベルが劇的に増加する。 この初期の増加は、すぐに大幅に枯渇している事前に形成されたインスリンの分泌によるものである。 インシュリンの二次上昇はすぐに解放されるかなりの量の新たに総合されたインシュリンを反映します。 明らかに、上昇したグルコースは、インスリン分泌をシミュレートするだけでなく、インスリン遺伝子の転写およびそのmRNAの翻訳もシミュレートする。
高度なおよび補足的なトピック
- インスリンの構造