Una malattia trasmessa da vettori (in particolare un trasferimento biologico piuttosto che meccanico) è quella in cui la trasmissione dell’infezione in una popolazione (la popolazione ospite) avviene solo attraverso una seconda popolazione (vettori). I vettori sono di solito artropodi ematofagi (che alimentano il sangue) come zanzare, lucciole o zecche. Ci sono molte di queste malattie, le cui dinamiche sono di grande interesse dal punto di vista del controllo dell’infezione. Malaria, leishmaniosi, febbre dengue e virus del Nilo occidentale sono solo per citarne alcuni che attualmente hanno un enorme impatto sociale sulle popolazioni umane.
Ogni anno nella regione di 225 milioni di persone sono infettate dal parassita della malaria e nel 2009 circa 781.000 di queste hanno provocato la mortalità indotta dalla malattia. La storia è simile per leishmaniosi dove ci sono circa 12 milioni di persone a livello globale che si pensa di essere infettati in un dato momento e circa 80.000 persone muoiono ogni anno dalla forma più grave, leishmaniosi viscerale. Tali malattie sono diffuse nei paesi in via di sviluppo; una combinazione di habitat ottimale per i vettori nelle regioni tropicali e una mancanza di aiuto medico portano a endemismi su larga scala lì.
Le malattie umane non sono l’unica preoccupazione; ce ne sono molte altre che infettano altre classi di ospiti che sono anche di interesse, in particolare dal punto di vista della conservazione delle specie in via di estinzione.
Il tipico corso di infezione per la trasmissione trasmessa da vettori, ignorando la malattia, l’ospite o le speciche vettoriali, inizia con un vettore infetto (un artropode adulto che si nutre di sangue o succhia) che prende un pasto di sangue da un membro suscettibile della popolazione ospite. Una volta morso, l’ospite ha la possibilità di essere infettato dalla malattia. In questa fase, se infetto, l’ospite è considerato esposto ma non soffre di eetti avversi dall’infezione e non può trasmettere la malattia. Il tempo dopo essere stato infettato, ma prima di diventare contagioso è noto come il periodo di latenza. Quando il parassita ha raggiunto un certo stadio del suo ciclo riproduttivo, l’ospite diventa infettivo dopo di che, se viene morso, può trasmettere la malattia a un vettore suscettibile attraverso il suo sangue infetto da parassiti e completare il ciclo di trasmissione (mostrato nella figura seguente).
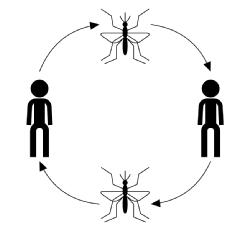
La trasmissione della malattia è solitamente caratterizzata da:
- l’abbondanza e la diffusione spaziale di entrambi gli host e vettori
- demografia
- un tasso di alimentazione o di un vettore desiderio di mordere
- il successo o il fallimento di trasmissione
in Genere i modelli matematici di malattie trasmesse da vettori sono basati su due popolazione SI(R) modello espongono “criss-cross” infezione termini, dove e
sono la forza di infezione dei termini per i padroni di casa e vettori rispettivamente:
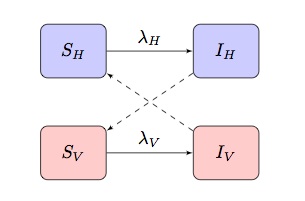
A seconda della malattia e della popolazione modellata, questa può essere adattata per incorporare altre caratteristiche più specifiche.
Modellazione della dinamica delle malattie trasmesse da vettori
Esistono molti tipi diversi di modelli matematici per la trasmissione di malattie trasmesse da vettori; idealmente questi sono ricercati per essere mantenuti matematicamente trattabili e il più semplici possibile, pur mantenendo la dinamica generale del sistema biologico. Non sorprende che i modelli della gamma di letteratura siano notevolmente; da deterministico a stocastico, endemico (compresi i tassi di nascita e morte) o epidemico (un focolaio di durata limitata), incorporando diffusione spaziale, eterogeneità spaziale, periodi di latenza, struttura per età, acquisizione e perdita di immunità, ceppi multipli e molti altri. Anche quando si considera solo una malattia specifica, le variazioni della malattia all’interno di diverse popolazioni possono portare a cambiamenti non solo nella parametrizzazione, ma anche nel modo in cui si potrebbe desiderare di adottare l’approccio modellistico.
Alcuni dei lavori di Kat si concentrano sulle semplificazioni che vengono spesso fatte per ridurre la complessità dei modelli. Questo lavoro considera gli effetti dell’uso di modelli di trasmissione “solo host” come l’assunzione di quasi-equilibrio sulla dinamica della malattia e anche l’effetto di omettere il periodo di latenza sulle previsioni epidemiche.
La leishmaniosi
Da completare con Erin
Tripanosomiasi africana umana (HAT)
La tripanosomiasi africana umana (HAT), più colloquialmente nota come malattia del sonno, è una malattia mortale endemica in gran parte dell’Africa sub-sahariana. 70 milioni di persone vivono in aree a rischio che coprono oltre un milione e mezzo di chilometri quadrati. Mentre la prevalenza di CAPPELLO non è alta come quella di altre malattie trasmesse da vettori, come la malaria, la dengue (c’erano poco più di 7000 casi segnalati di CAPPELLO, ma a 207 milioni di euro stimati i casi di malaria nel 2012), la mancanza di chimica profilassi, estremamente sgradevole (e spesso mortale) il trattamento e la carenza di sostanziale la ricerca scientica si è piazzato HAT nella lista delle malattie tropicali trascurate.
Il vettore per HAT è il tsetse; la sua necessità di alimentare il sangue per prevenire la fame e un’interazione vettore-parassita unica (causando un “fenomeno di suscettibilità tenerale”) significa che la modellazione del CAPPELLO è nettamente diversa da altre malattie trasmesse da vettori come la malaria.
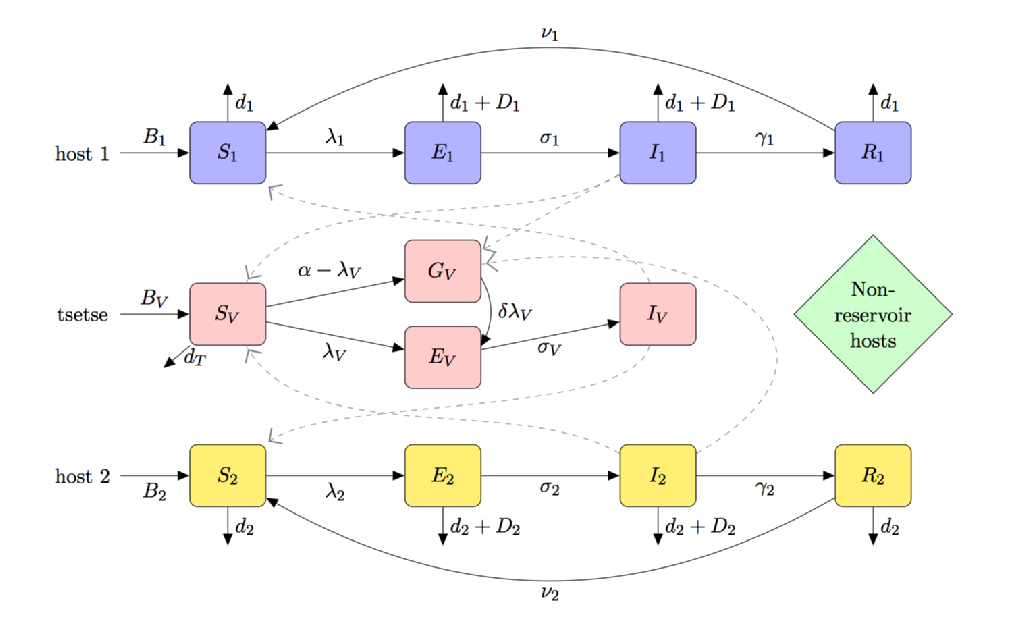
La figura seguente è una caricatura compartimentale di un modello per CAPPELLO che include:
- (parziale) teneral volare suscettibilità
- multi-host specie (compreso serbatoio e non ospiti del serbatoio)
- tse-tse alimentazione preferenza
- la fame di digiuno tse-tse
la febbre catarrale degli ovini (BTV)
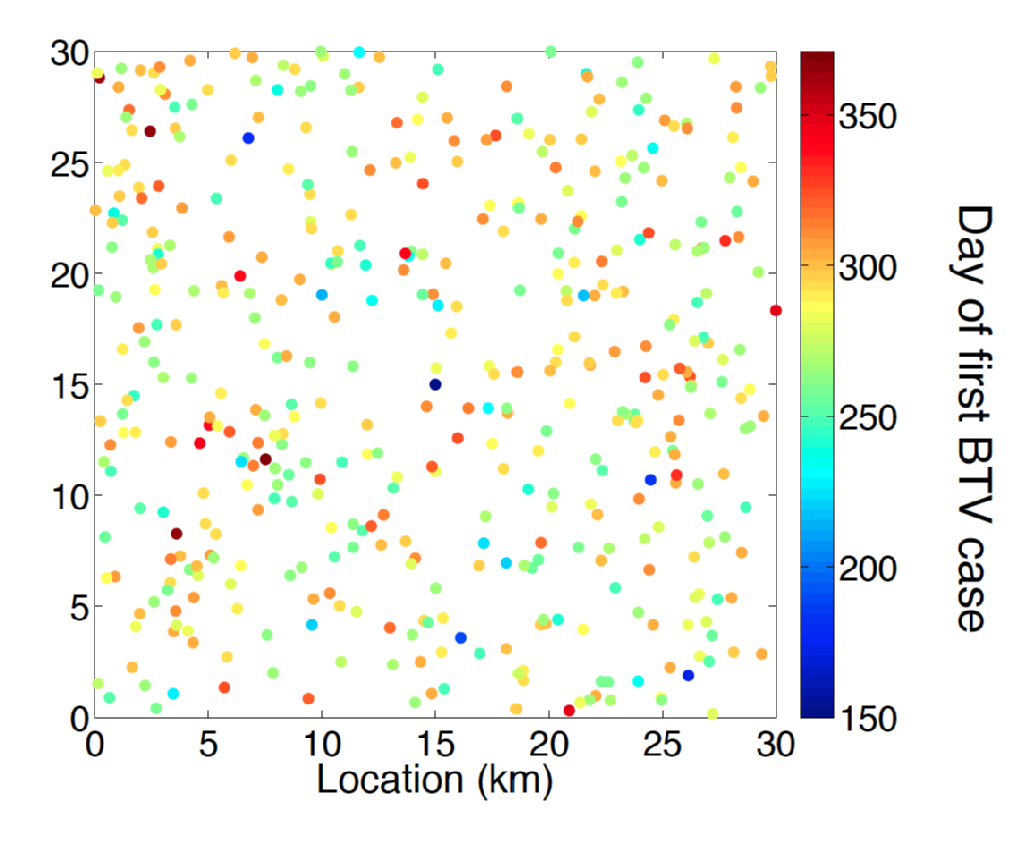
la febbre catarrale degli ovini è una malattia virale (BTV) dei ruminanti trasmessa da vari genere Culicoides mordere midge specie. I sintomi per il bestiame malato con BTV includevano disagio, febbre alta e cianosi della lingua, che dà il nome alla malattia. Tra le pecore la malattia BTV ha un’alta mortalità associata. Fino alla fine degli anni 1990 la gamma europea di BTV era interamente associata alla gamma del vettore moscerino C. Imicola. Alla fine degli anni ‘ 90 e nei primi anni 2000 c’è stata un’espansione senza precedenti di BTV in aree dell’Europa che fanno parte della gamma di altre specie di moscerino come quelle del complesso C. Obsoletus e specie di moscerino strettamente correlate. In particolare, un focolaio originario dei Paesi Bassi nel 2006 è il primo esempio registrato di un’incursione di BTV a 50 gradi di latitudine nord. Nelle estati successive sono stati scoperti casi di BTV in tutta l’Europa settentrionale, tra cui in Belgio, Germania, Regno Unito e Danimarca, dimostrando la capacità della febbre catarrale degli ovini durante l’inverno nell’ambiente dell’Europa settentrionale. Una caratteristica sconcertante della sierologia nordeuropea della febbre catarrale degli ovini è che la malattia è stata causata da un ceppo distinto (BTV-8) da quelli responsabili delle incursioni nell’Europa meridionale, vale a dire Spagna (BTV-4) e Italia (BTV-2).
Prevedere l’impatto dell’incursione BTV e la migliore progettazione della gestione del bestiame e del controllo delle malattie richiede una metodologia di modellazione all’avanguardia. Molto è compreso circa l’epidemiologia di BTV quale una comprensione solida del periodo previsto di viremia per i bovini e gli ospiti ovini e l’effetto della temperatura climatica sul periodo di incubazione della febbre catarrale all’interno del suo vettore del moscerino. Tuttavia, la stima del rischio spazio-temporale rappresentato dalla dispersione vettoriale dal bestiame ospite infetto rimane una sfida significativa. Il problema di inferenza qui è multifattoriale che richiede non solo l’inferenza dei parametri ma anche la selezione del modello statisticamente basata sui principi.
la Malaria
la Malaria segue generico ciclo di trasmissione di quanto sopra; il vettore sta la zanzara femmina che prende il suo pasto di sangue come parte del processo riproduttivo; i maschi della specie sono nectavorious e, come tali, non hanno alcuna parte nel ciclo di trasmissione. La frequenza di alimentazione è determinata da questo bisogno biologico, e quindi il tasso medio di alimentazione è di solito circa una volta ogni quattro giorni e di solito si presume che la sazietà per un lotto di uova si ottiene all’interno di questo pasto. Ci sono molti diversi tipi di malaria, alcuni che colpiscono gli esseri umani (questo può essere causato da uno dei quattro diversi tipi di plasmodio) e altri che colpiscono gli animali. Il genere Anopheles è responsabile della trasmissione all’uomo, di cui circa solo 30 specie su 400 causano prevalentemente la diffusione dell’infezione.
Una caratteristica fondamentale che colpisce la malaria è la temperatura; anche se la zanzara risiede all’interno della zona data, temperature esterne inferiori a circa 16C (esatto temperato dipende dalla specie di parassita), non è abbastanza caldo per consentire lo sviluppo. In generale, poiché la temperatura aumenta da 16C più breve è il periodo di incubazione con un arresto improvviso sopra circa 32C poiché il parassita non è in grado di sopravvivere oltre queste temperature.
Malaria aviaria e Honeycreeper hawaiano
Alcuni sistemi, tuttavia, possono essere molto più complessi dell’esempio generale fornito in precedenza. Un esempio è il favo hawaiano (Drepanididae); soffre non solo gli effetti negativi della malaria aviaria (Plasmodium relictum) che viene trasmessa attraverso la zanzara (Culex quinquefasciatus) ma anche quelli del cambiamento climatico e della predazione. L’interazione tra questi fattori dominanti è grande, con temperature e abbondanza di predatori che influenzano il decorso della malattia e la capacità (o incapacità) degli uccelli di resistere all’estinzione. Inoltre alcune specie di honeycreeper mostrano la capacità di conferire resistenza alla malaria, non subendo effetti deleteri dalla malattia pur rimanendo infettive (queste sono più comunemente chiamate portatori e inavvertitamente causano un serbatoio di infezione sopravvivendo alla normale aspettativa di vita “libera da malattia” ma diffondendo ancora l’infezione.
Questo lavoro è stato pubblicato come:
K. S. Rock et al. “Modelling the Future of the Hawaiian Honeycreeper: An Ecological and Epidemiological Problem”. Modellazione ecologica (giugno 2012)