Nome generico: Terbutaline sulfate
Forma di dosaggio: iniezione, soluzione
Medicamente recensito da Drugs.com. Ultimo aggiornamento il 1 settembre 2020.
- Panoramica
- Effetti Collaterali
- Dosaggio
- Professional
- Interazioni
- Più
Una soluzione acquosa sterile per iniezione sottocutanea
Rx Solo
ATTENZIONE: PROLUNGATO TOCOLYSIS
Terbutaline sulfate non è stato approvato e non deve essere utilizzato per lunghi tocolysis (al di là di 48-72 ore). In particolare, il solfato di terbutalina non deve essere utilizzato per la tocolisi di mantenimento in ambito ambulatoriale o domestico. Dopo somministrazione di terbutalina solfato a donne in gravidanza sono state riportate reazioni avverse gravi, compreso il decesso. Nella madre, queste reazioni avverse includono aumento della frequenza cardiaca, iperglicemia transitoria, ipopotassiemia, aritmie cardiache, edema polmonare e ischemia miocardica. L’aumento della frequenza cardiaca fetale e l’ipoglicemia neonatale possono verificarsi a seguito della somministrazione materna (vedi CONTROINDICAZIONI: tocolisi prolungata).
- Terbutalina Descrizione
- Terbutalina – Farmacologia clinica
- Studi preclinici
- Farmacocinetica
- Indicazioni e utilizzo per Terbutaline
- Controindicazioni
- Avvertenze
- Peggioramento dell ‘asma
- Uso di agenti antinfiammatori
- Effetti cardiovascolari
- Convulsioni
- Precauzioni
- Generale
- Interazioni farmacologiche
- la Carcinogenesi, Mutagenesi, Compromissione della Fertilità
- Gravidanza-Effetti teratogeni
- Uso in travaglio e parto
- Madri che allattano
- Uso pediatrico
- Uso geriatrico
- Reazioni avverse
- Sovradosaggio
- Dosaggio e somministrazione di Terbutalina
- Come viene fornita la terbutalina
- PRINCIPALE del PANNELLO di VISUALIZZAZIONE
- PRINCIPALE del PANNELLO di VISUALIZZAZIONE
- SERIALIZATION IMAGE
- di Più su terbutaline
- risorse per i Consumatori
- risorse Professionali
- relativo trattamento guide
Terbutalina Descrizione
Terbutalina solfato, USP, il principio attivo dell’iniezione di terbutalina solfato, USP, è un broncodilatatore agonista beta‑adrenergico disponibile come soluzione acquosa sterile, non pirogenica in flaconcini, per somministrazione sottocutanea. Ogni millilitro di soluzione contiene 1 mg di solfato di terbutalina, USP (0,82 mg della base libera), cloruro di sodio per isotonicità, 0,055% edetato disodio diidrato come agente stabilizzante e acido cloridrico per la regolazione a un pH target di 4. Il solfato di terbutalina è (±)- a sulfate 3,5-diidrossibenzyI solfato di alcool (2:1) (sale). La formula molecolare è (C12H19N03) 2 * H2SO4 e la formula strutturale è:
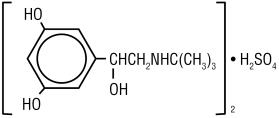
Terbutalina solfato, USP è un bianco a polvere cristallina grigio-bianca. È inodore o ha un debole odore di acido acetico. È solubile in acqua e in acido cloridrico 0,1 N, leggermente solubile in metanolo e insolubile in cloroformio. Il suo peso molecolare è 548,65.
Terbutalina – Farmacologia clinica
L’iniezione di terbutalina solfato è un agonista del recettore beta-adrenergico. Studi farmacologici in vitro e in vivo hanno dimostrato che la terbutalina esercita un effetto preferenziale sui recettori beta2‑adrenergici. Mentre è riconosciuto che i recettori beta2-adrenergici sono i recettori predominanti nella muscolatura liscia bronchiale, i dati indicano che esiste una popolazione di recettori beta2 nel cuore umano, esistente in una concentrazione compresa tra il 10% e il 50%. La funzione precisa di questi recettori non è stata stabilita (vedere AVVERTENZE). Studi clinici controllati in pazienti trattati con Terbutalina per via sottocutanea non hanno rivelato un effetto preferenziale beta2-adrenergico.
Gli effetti farmacologici degli agonisti beta-adrenergici, inclusa la Terbutalina, sono almeno in parte attribuibili alla stimolazione attraverso i recettori beta-adrenergici dell’adenil ciclasi intracellulare, l’enzima che catalizza la conversione dell’adenosina trifosfato (ATP) in 3’,5’-adenosina monofosfato ciclico (cAMP). L’aumento dei livelli di cAMP è associato al rilassamento della muscolatura liscia bronchiale e all’inibizione del rilascio di mediatori di ipersensibilità immediata dalle cellule, in particolare dai mastociti.
Studi clinici controllati hanno dimostrato che l’iniezione di terbutalina solfato allevia il broncospasmo nella malattia polmonare ostruttiva acuta e cronica aumentando significativamente le portate polmonari (ad esempio, un aumento del 15% o più del FEV1). Dopo somministrazione sottocutanea di 0,25 mg di iniezione di terbutalina solfato, un cambiamento misurabile nella portata espiratoria di solito si verifica entro 5 minuti e un aumento clinicamente significativo del FEV1 si verifica entro 15 minuti. L’effetto massimo di solito si verifica entro 30-60 minuti e l’attività broncodilatatrice clinicamente significativa può continuare per 1,5 – 4 ore. La durata del miglioramento clinicamente significativo è paragonabile a quella osservata con le dosi di equimilligram di epinefrina.
Studi preclinici
in animali da laboratorio (minipig, roditori e cani) hanno dimostrato l’insorgenza di aritmie cardiache e morte improvvisa (con evidenza istologica di necrosi miocardica) quando vengono somministrati contemporaneamente beta-agonisti e metilxantine. Il significato clinico di questi risultati non è noto.
Farmacocinetica
La somministrazione sottocutanea di 0,5 mg di Terbutalina solfato a 17 soggetti sani adulti di sesso maschile ha determinato un picco medio (DS) di concentrazione plasmatica di Terbutalina di 9,6 (3,6) ng / mL, osservato in un tempo mediano (range) di 0,5 (0,08-1,0) ore dopo la somministrazione. I valori medi (DS) dell’AUC (da 0 a 48) e della clearance corporea totale sono stati rispettivamente di 29,4 (14,2) ore•ng/ml e 311 (112) ml/min. L ‘ emivita terminale è stata determinata in 9 dei 17 soggetti e ha avuto una media (DS) di 5,7 (2,0) ore.
Dopo somministrazione sottocutanea di 0,25 mg di Terbutalina solfato a due soggetti di sesso maschile, sono state osservate concentrazioni sieriche di picco di Terbutalina di 5,2 e 5,3 ng/mL a circa 20 minuti dalla somministrazione.
L’emivita di eliminazione del farmaco in 10 pazienti su 14 è stata di circa 2,9 ore dopo la somministrazione sottocutanea, ma negli altri 4 pazienti sono state riscontrate emivita di eliminazione più lunghe (tra 6 e 14 ore). Circa il 90% del farmaco è stato escreto nelle urine a 96 ore dopo la somministrazione sottocutanea, con circa il 60% di questo farmaco immodificato. Sembra che il coniugato solfato sia un importante metabolita della Terbutalina e che l’escrezione urinaria sia la via primaria di eliminazione.
Indicazioni e utilizzo per Terbutaline
Terbutaline Sulfate Injection, USP è indicato per la prevenzione e l’inversione del broncospasmo in pazienti di età pari o superiore a 12 anni con asma e broncospasmo reversibile associato a bronchite ed enfisema.
Controindicazioni
1. Tocolisi prolungata
Terbutalina solfato non è stato approvato e non deve essere utilizzato per tocolisi prolungata (oltre 48-72 ore). In particolare, la terbutalina solfato non deve essere utilizzata per la tocolisi di mantenimento in ambito ambulatoriale o domiciliare (vedere AVVERTENZA IN SCATOLA: tocolisi prolungata).
2. Ipersensibilità
Terbutalina solfato iniezione è controindicato nei pazienti noti per essere ipersensibili alle ammine simpaticomimetici o qualsiasi componente di questo prodotto farmaco.
Avvertenze
Peggioramento dell ‘asma
L’ asma può peggiorare acutamente per un periodo di ore o cronicamente per diversi giorni o più. Se il paziente ha bisogno di più dosi di terbutalina solfato del solito, questo può essere un marker di destabilizzazione dell’asma e richiede una rivalutazione del paziente e del regime di trattamento, tenendo in particolare considerazione l’eventuale necessità di un trattamento antinfiammatorio, ad esempio corticosteroidi.
Uso di agenti antinfiammatori
L’uso di broncodilatatori agonisti beta-adrenergici da soli potrebbe non essere adeguato per controllare l’asma in molti pazienti. Si deve considerare precocemente l’aggiunta di agenti antinfiammatori, ad esempio corticosteroidi.
Effetti cardiovascolari
La terbutalina solfato, come tutti gli altri agonisti beta-adrenergici, può produrre un effetto cardiovascolare clinicamente significativo in alcuni pazienti misurato dalla frequenza cardiaca, dalla pressione sanguigna e / o dai sintomi. Sebbene tali effetti siano rari dopo la somministrazione di terbutalina solfato alle dosi raccomandate, se si verificano, potrebbe essere necessario interrompere il farmaco. Inoltre, i beta-agonisti sono stati segnalati per produrre cambiamenti dell’elettrocardiogramma (ECG), come l’appiattimento dell’onda T, il prolungamento dell’intervallo QTc e la depressione del segmento ST. Il significato clinico di questi risultati non è noto. Pertanto, il solfato di terbutalina, come tutte le ammine simpaticomimetiche, deve essere usato con cautela nei pazienti con disturbi cardiovascolari, in particolare insufficienza coronarica, aritmie cardiache e ipertensione.
Convulsioni
Ci sono state rare segnalazioni di convulsioni in pazienti trattati con terbutalina; le convulsioni non si sono ripresentate in questi pazienti dopo la sospensione del farmaco.
Precauzioni
Generale
Terbutaline, come con tutti i simpaticomimetici ammina, deve essere usato con cautela in pazienti con disturbi cardiovascolari, tra cui la malattia di cuore ischemica, ipertensione e aritmie cardiache; in pazienti con ipertiroidismo o diabete mellito; e in pazienti che sono particolarmente sensibile a simpaticomimetici ammina o che hanno disturbi convulsivi. Sono stati osservati cambiamenti significativi nella pressione arteriosa sistolica e diastolica e ci si può aspettare che si verifichino in alcuni pazienti dopo l’uso di qualsiasi broncodilatatore beta-adrenergico.
Dopo somministrazione di Terbutalina sono state riportate reazioni immediate di ipersensibilità ed esacerbazioni del broncospasmo.
I farmaci agonisti beta-adrenergici possono produrre ipopotassiemia significativa in alcuni pazienti, possibilmente attraverso lo smistamento intracellulare, che ha il potenziale per produrre effetti cardiovascolari avversi. La diminuzione è solitamente transitoria, non richiedendo l’integrazione.
Grandi dosi di terbutalina per via endovenosa sono state riportate per aggravare il diabete mellito preesistente e la chetoacidosi.
Interazioni farmacologiche
L’uso concomitante di iniezione di terbutalina solfato con altri agenti simpaticomimetici non è raccomandato, poiché l’effetto combinato sul sistema cardiovascolare può essere deleterio per il paziente.
Inibitori della monoamino ossidasi o antidepressivi triciclici: la terbutalina deve essere somministrata con estrema cautela ai pazienti trattati con inibitori della monoamino ossidasi o antidepressivi triciclici, o entro 2 settimane dall’interruzione di tali agenti, poiché l’azione della Terbutalina sul sistema vascolare può essere potenziata.
Beta-bloccanti: Gli agenti bloccanti del recettore beta-adrenergico non solo bloccano l’effetto polmonare dei beta-agonisti, come l’iniezione di solfato di terbutalina, ma possono produrre broncospasmo grave nei pazienti asmatici. Pertanto, i pazienti con asma non devono normalmente essere trattati con beta-bloccanti. Tuttavia, in determinate circostanze, ad esempio, come profilassi dopo infarto miocardico, potrebbero non esserci alternative accettabili all’uso di agenti bloccanti beta-adrenergici in pazienti con asma. In questo contesto, i beta-bloccanti cardioselettivi potrebbero essere considerati, sebbene debbano essere somministrati con cautela.
Diuretici: I cambiamenti dell’ECG e / o l’ipopotassiemia che possono derivare dalla somministrazione di diuretici non risparmiatori di potassio (come diuretici dell’ansa o tiazidici) possono essere acutamente peggiorati dai beta-agonisti, specialmente quando viene superata la dose raccomandata del beta-agonista. Sebbene il significato clinico di questi effetti non sia noto, si consiglia cautela nella somministrazione concomitante di beta-agonisti con diuretici risparmiatori di potassio.
la Carcinogenesi, Mutagenesi, Compromissione della Fertilità
In 2 anni di studio in ratti Sprague-Dawley, Terbutalina solfato ha causato un significativo e dose‑correlato aumento dell’incidenza di benigni leiomiomi dell’mesovarium la dieta dosi di 50 mg/kg (circa 810 volte la massima giornaliera raccomandata per via sottocutanea (sc) dose per gli adulti su una base mg/m2). In uno studio di 21 mesi su topi CD-1, la terbutalina solfato non ha mostrato evidenza di tumorigenicità a dosi dietetiche fino a 200 mg / kg (circa 1.600 volte la dose massima giornaliera raccomandata per gli adulti su base mg/m2). Il potenziale di mutagenicità della terbutalina solfato non è stato determinato.
Gli studi sulla riproduzione condotti nei ratti con terbutalina solfato non hanno dimostrato alcuna compromissione della fertilità a dosi orali fino a 50 mg/kg (circa 810 volte la dose massima giornaliera raccomandata per gli adulti su base mg / m2).
Gravidanza-Effetti teratogeni
Categoria di gravidanza C
Non esistono studi adeguati e ben controllati sulla terbutalina solfato in donne in gravidanza. Studi su animali pubblicati dimostrano che la prole di ratto mostra alterazioni nel comportamento e nello sviluppo del cervello, tra cui una diminuzione della proliferazione cellulare e della differenziazione quando le dighe sono state trattate per via sottocutanea con terbutalina durante la fase avanzata della gravidanza e del periodo di allattamento. Le esposizioni di terbutalina nelle femmine di ratto sono state approssimativamente da 24 a 48 volte la dose comune nell ‘ uomo negli adulti di 2-4 mg/die, su base mg/m2.
Il solfato di terbutalina non è stato approvato e non deve essere usato per tocolisi prolungata (oltre 48-72 ore). In particolare, il solfato di terbutalina non deve essere utilizzato per la tocolisi di mantenimento in ambito ambulatoriale o domestico. Dopo somministrazione di terbutalina solfato a donne in gravidanza sono state riportate reazioni avverse gravi, compreso il decesso. Nella madre, queste reazioni avverse includono aumento della frequenza cardiaca, iperglicemia transitoria, ipopotassiemia, aritmie cardiache, edema polmonare e ischemia miocardica. L’aumento della frequenza cardiaca fetale e l’ipoglicemia neonatale possono verificarsi a seguito della somministrazione materna (vedere AVVERTENZA IN SCATOLA: Tocolisi prolungata e CONTROINDICAZIONI: tocolisi prolungata).
In studi di sviluppo embriofetali animali, non sono stati osservati effetti teratogeni nella prole quando ratti e conigli gravidi hanno ricevuto Terbutalina solfato a dosi orali fino a 50 mg/kg/die, circa 810 e 1.600 volte, rispettivamente, la dose sottocutanea giornaliera massima raccomandata per gli adulti, su base mg / m2.
Il solfato di terbutalina deve essere usato durante la gravidanza solo se i potenziali benefici giustificano il potenziale rischio per il feto.
Uso in travaglio e parto
A causa del potenziale di interferenza beta-agonista con la contrattilità uterina, l’uso dell’iniezione di solfato di terbutalina per il sollievo del broncospasmo durante il travaglio dovrebbe essere limitato a quei pazienti in cui i benefici superano chiaramente il rischio.
La terbutalina attraversa la placenta. Dopo somministrazione endovenosa di una singola dose di Terbutalina a 22 donne in gravidanza avanzata che sono state consegnate con taglio cesareo elettivo a causa di motivi clinici, i livelli ematici ombelicali di Terbutalina sono risultati variare dall ‘ 11% al 48% dei livelli ematici materni.
Madri che allattano
Non è noto se questo farmaco sia escreto nel latte materno. Pertanto, l’iniezione di solfato di terbutalina deve essere utilizzata durante l’allattamento solo se il potenziale beneficio giustifica il possibile rischio per il neonato.
Uso pediatrico
L’iniezione di terbutalina solfato non è raccomandata per i pazienti di età inferiore ai 12 anni a causa di dati clinici insufficienti per stabilire sicurezza ed efficacia.
Uso geriatrico
Gli studi clinici sull’iniezione di terbutalina solfato non hanno incluso un numero sufficiente di soggetti di età pari o superiore a 65 anni per determinare se rispondono in modo diverso rispetto ai soggetti più giovani. Altre esperienze cliniche riportate non hanno identificato differenze nelle risposte tra pazienti anziani e pazienti più giovani. In generale, la selezione della dose per un paziente anziano deve essere cauta, di solito a partire dalla fascia bassa del range di dosaggio, riflettendo la maggiore frequenza di diminuzione della funzionalità epatica, renale o cardiaca e della malattia concomitante o di altre terapie farmacologiche.
Reazioni avverse
Le reazioni avverse osservate con l’iniezione di terbutalina solfato sono simili a quelle comunemente osservate con altri agenti simpaticomimetici. Tutte queste reazioni sono di natura transitoria e di solito non richiedono trattamento.
La seguente tabella confronta le reazioni avverse osservate in pazienti trattati con Terbutalina solfato iniettabile (0,25 mg e 0,5 mg), con quelle osservate in pazienti trattati con epinefrina iniettabile (0,25 mg e 0,5 mg), durante otto studi crossover in doppio cieco che hanno coinvolto un totale di 214 pazienti.
| Incidence (%) of Adverse Reactions | |||||
| Terbutaline (%) | Epinephrine (%) | ||||
|
0.25 mg |
0.5 mg N = 205 |
0.25 mg N = 153 |
0.5 mg N = 61 |
||
| Reaction Central Nervous System |
|||||
| Tremor | 7.8 | 38.0 | 16.3 | 18.0 | |
| Nervousness | 16.9 | 30.7 | 8.5 | 31.1 | |
| Dizziness | 1.3 | 10.2 | 7.8 | 3.3 | |
| Headache | 7.8 | 8.8 | 3.3 | 9.8 | |
| Drowsiness | 11.7 | 9.8 | 14.4 | 8.2 | |
| Cardiovascular | |||||
| Palpitations | 7.8 | 22.9 | 7.8 | 29.5 | |
| Tachycardia | 1.3 | 1.5 | 2.6 | 0.0 | |
| Respiratory | |||||
| Dyspnea | 0.0 | 2.0 | 2.0 | 0.0 | |
| Chest discomfort | 1.3 | 1.5 | 2.6 | 0.0 | |
| Gastrointestinal | |||||
| Nausea/vomiting | 1.3 | 3.9 | 1.3 | 11.5 | |
| Systemic | |||||
| Weakness | 1.3 | 0.5 | 2.6 | 1.6 | |
| Flushed feeling | 0.0 | 2.4 | 1.3 | 0.0 | |
| Sweating | 0.0 | 2.4 | 0.0 | 0.0 | |
| Pain at injection site | 2.6 | 0.5 | 2.6 | 1.6 | |
Nota: Alcuni pazienti ricevuto più di una forza di dosaggio di terbutalina solfato ed epinefrina. Inoltre, ci sono state segnalazioni di ansia, crampi muscolari e secchezza delle fauci (< 0,5%). Sono stati riportati rari casi di aumento degli enzimi epatici e di vasculite da ipersensibilità con somministrazione di terbutalina.
Per segnalare REAZIONI AVVERSE SOSPETTE, contattare Hikma Pharmaceuticals USA Inc.. a 1-877-233-2001, o la FDA a 1-800-FDA-1088 o www.fda.gov/medwatch.
Sovradosaggio
La dose letale sc mediana di terbutalina solfato nei ratti maturi è stata di circa 165 mg/kg (circa 2.700 volte la dose giornaliera sc massima raccomandata per gli adulti su base mg / m2). La dose letale sc mediana di terbutalina solfato nei ratti giovani è stata di circa 2.000 mg / kg (circa 32.000 volte la dose massima giornaliera raccomandata per gli adulti su base mg/m2).
Il previsto sintomi di sovradosaggio sono quelli di una eccessiva stimolazione beta-adrenergica e/o insorgenza o esagerazione di uno qualsiasi dei sintomi elencati sotto REAZIONI AVVERSE, ad esempio, convulsioni, angina, ipertensione o ipotensione, tachicardia con tassi fino a 200 battiti al minuto, aritmie, nervosismo, mal di testa, tremore, secchezza delle fauci, palpitazioni, nausea, vertigini, stanchezza, malessere, insonnia. Può anche verificarsi ipopotassiemia. Non esiste un antidoto specifico. Il trattamento consiste nell’interruzione dell’iniezione di terbutalina solfato insieme ad un’appropriata terapia sintomatica. L’uso giudizioso di un bloccante del beta-recettore cardioselettivo può essere considerato, tenendo presente che tale farmaco può produrre broncospasmo. Non ci sono prove sufficienti per determinare se la dialisi è utile per il sovradosaggio di terbutalina solfato iniezione.
Dosaggio e somministrazione di Terbutalina
I flaconcini devono essere utilizzati solo per somministrazione sottocutanea e non per infusione endovenosa.
La sterilità e il dosaggio accurato non possono essere assicurati se i flaconcini non vengono utilizzati in conformità con il DOSAGGIO E LA SOMMINISTRAZIONE.
Eliminare la porzione non utilizzata dopo l’uso in singolo paziente.
La dose sottocutanea usuale di iniezione di terbutalina solfato è di 0,25 mg iniettata nell’area deltoide laterale. Se non si verifica un miglioramento clinico significativo entro 15-30 minuti, può essere somministrata una seconda dose di 0,25 mg. Se il paziente non risponde entro altri 15-30 minuti, devono essere prese in considerazione altre misure terapeutiche. La dose totale entro 4 ore non deve superare 0,5 mg.
Nota: i farmaci per via parenterale devono essere ispezionati visivamente per la presenza di particolato e scolorimento prima della somministrazione, ogni volta che la soluzione e il contenitore lo consentono.
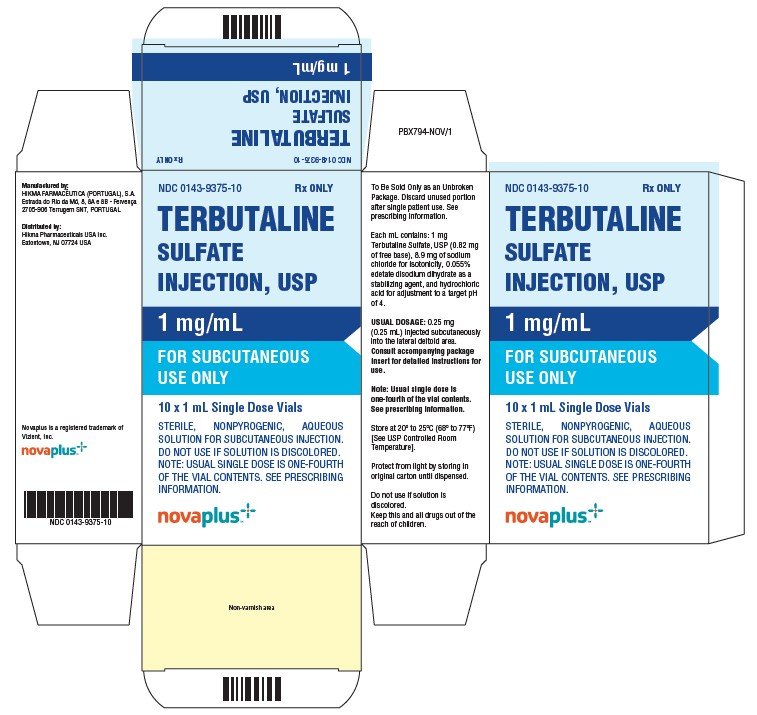
Come viene fornita la terbutalina
L’iniezione di terbutalina solfato, USP, 1 mg / mL, viene fornita ad un volume di 1 mL contenuto in un flaconcino di vetro ambrato da 2 ml. Ogni flaconcino contiene 1 mg di Terbutalina solfato per 1 mL di soluzione; 0,25 ml di soluzione forniranno la dose clinica usuale di 0,25 mg.
NDC 0143-9375-10 Scatola da 10 flaconcini.
Conservare a 20 ° a 25 ° C (68° a 77°F) .
Proteggere dalla luce conservando i flaconcini nella confezione originale fino all’erogazione.
Non usare se la soluzione è scolorita.
Eliminare la porzione non utilizzata dopo l’uso in singolo paziente.
Prodotto da:
HIKMA FARMACÊUTICA (PORTUGAL), S.A..
Estrada do Rio da Mó, nº 8, 8A e 8B-Fervença,
2705 – 906 Terrugem SNT,
PORTUGAL
Distribuito da:
Hikma Pharmaceuticals USA Inc.
Eatontown, NJ 07724 USA
Novaplus è un marchio registrato di Vizient, Inc.
Rivisto: Ottobre 2020
PIN552-NOV/2
PRINCIPALE del PANNELLO di VISUALIZZAZIONE
NDC 0143-9375-01 Rx SOLO
Terbutaline
SOLFATO
INIEZIONE, USP
1 mg/mL
PER via SOTTOCUTANEA
UTILIZZARE SOLO

PRINCIPALE del PANNELLO di VISUALIZZAZIONE
NDC 0143-9375-10 Rx SOLO
Terbutaline
SOLFATO
INIEZIONE, USP
1 mg/mL
PER via SOTTOCUTANEA
UTILIZZARE SOLO
10 X 1 mL Dose Singola Fiale
STERILE, NONPYROGENIC ACQUOSA
SOLUZIONE PER INIEZIONE SOTTOCUTANEA.
NON USARE SE LA SOLUZIONE È SCOLORITA.
NOTA: LA DOSE SINGOLA ABITUALE È UN QUARTO
DEL CONTENUTO DEL FLACONCINO. SEE PRESCRIBING
INFORMATION.
SERIALIZATION IMAGE
| Terbutaline SULFATE Terbutaline sulfate injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Hikma Pharmaceuticals USA Inc. (001230762)
Dichiarante – HIKMA FARMACEUTICA (PORTUGAL), S.A. (452742943)
di Più su terbutaline
- Effetti Collaterali
- Durante la Gravidanza o l’Allattamento al seno
- il Dosaggio di Informazioni
- Interazioni Immagini
- interazioni Farmacologiche
- Confronto Alternative
- Prezzi & Coupon
- In inglese
- 11 Recensioni
- classe di Droga: broncodilatatori adrenergici
- FDA Avvisi (1)
risorse per i Consumatori
- Informazioni Paziente
- Terbutaline (Avanzate di Lettura)
- Terbutaline Sottocutaneo (Avanzate di Lettura)
risorse Professionali
- la Prescrizione di Informazione;
- Terbutaline (Professional Paziente di Consulenza)
- Terbutaline Pastiglie (FDA)
relativo trattamento guide
- Travaglio
- Asma Allergica
- Asma, Manutenzione
- Asma acuto
Disclaimer Medico