Se hai mai studiato una tavola periodica degli elementi (vedi sotto), probabilmente sei già consapevole che questa tabella rivela molto sulle proprietà chimiche degli atomi che compongono il nostro mondo.
Ma potresti non renderti conto che ogni quadrato sulla tavola periodica rappresenta in realtà una famiglia di isotopi — atomi che condividono lo stesso nome e proprietà chimiche, ma hanno masse diverse.
Per capire quali sono gli isotopi e come possiamo usarli, dobbiamo dare un’occhiata più da vicino all’interno di un atomo.

Elementi costitutivi della materia
Un atomo è composto da un nucleo incredibilmente denso (chiamato nucleo) di protoni e neutroni, circondato da una nube diffusa di elettroni.
Puoi pensare a protoni e neutroni come allo stesso tipo di particella con una differenza fondamentale: i protoni sono caricati positivamente, mentre i neutroni non portano carica. Ciò significa che i protoni possono “sentire” campi elettrici o magnetici, mentre i neutroni non possono.
Gli elettroni, che sono molto più leggeri di protoni o neutroni, portano la stessa grandezza di carica di un protone ma con il segno opposto, il che significa che ogni atomo che ha un numero uguale di protoni ed elettroni è elettricamente neutro.
Sono gli elettroni che determinano il comportamento chimico di un particolare elemento.

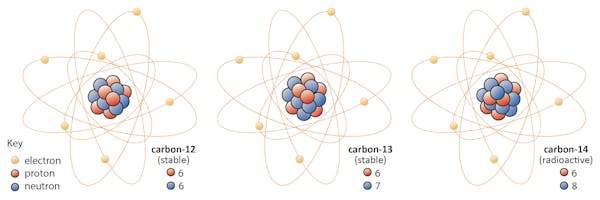
Gli isotopi di un elemento condividono lo stesso numero di protoni ma hanno un numero diverso di neutroni. Usiamo il carbonio come esempio.
Ci sono tre isotopi di carbonio trovati in natura: carbonio – 12, carbonio-13 e carbonio-14. Tutti e tre hanno sei protoni, ma i loro numeri di neutroni – 6, 7 e 8, rispettivamente-sono tutti diversi. Ciò significa che tutti e tre gli isotopi hanno masse atomiche diverse (il carbonio-14 è il più pesante), ma condividono lo stesso numero atomico (Z=6).
Chimicamente, tutti e tre sono indistinguibili, perché il numero di elettroni in ciascuno di questi tre isotopi è lo stesso.
Quindi diversi isotopi dello stesso elemento sono identici, chimicamente parlando. Ma alcuni isotopi hanno la capacità di aggirare questa regola trasformandosi completamente in un altro elemento.
Marciando verso la stabilità
Questa capacità di trasformazione di alcuni isotopi ha a che fare con il fatto che non tutti gli isotopi sono stabili, ed è ciò che ha portato Frederick Soddy alla sua scoperta premio Nobel degli isotopi nel 1913.
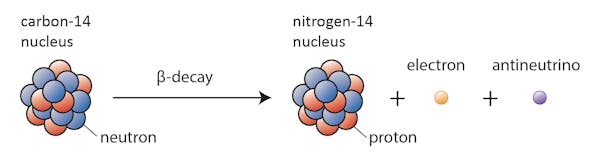
Alcuni isotopi – come il carbonio-12 – continueranno felicemente ad esistere come carbonio a meno che non accada qualcosa di straordinario. Altri-carbonio-14, dire-sarà ad un certo punto decadimento in un isotopo stabile nelle vicinanze.
In questo caso, uno dei neutroni nel carbonio-14 si trasforma in un protone, formando azoto-14. Durante questo processo, noto come decadimento beta, il nucleo emette radiazioni sotto forma di un elettrone e un antineutrino.
Ci sono molti fattori che possono causare il decadimento di un nucleo. Uno dei più importanti è il rapporto tra protoni e neutroni di un particolare nucleo. Se un nucleo ha troppi neutroni (la definizione di “troppi” dipende da quanto è pesante il nucleo), c’è una possibilità che decada verso la stabilità.
Lo stesso vale se un nucleo ha troppi protoni. Questo è uno dei motivi per cui alcuni isotopi di un dato elemento sono radioattivi, mentre altri non lo sono.
Dalle pance delle stelle
Ormai, ci si potrebbe chiedere come tutti questi isotopi sono stati creati in primo luogo. A quanto pare, questa domanda è complessa, ma presta un po ‘ di verità all’adagio che siamo tutti fatti di polvere di stelle.
Alcuni degli isotopi più leggeri si formarono molto presto nella storia dell’universo, durante il Big Bang. Altri derivano da processi che avvengono all’interno delle stelle o come risultato di collisioni casuali tra nuclei altamente energetici – noti come raggi cosmici – all’interno della nostra atmosfera.
La maggior parte degli isotopi naturalmente esistenti sono il prodotto finale (stabile o di lunga durata) risultante da una lunga serie di reazioni nucleari e decadimenti.
Nella maggior parte di questi casi, i nuclei di luce hanno dovuto distruggere insieme con abbastanza energia per consentire la forza forte – un legame simile alla colla che si forma quando protoni e neutroni si avvicinano abbastanza da toccare-per superare la forza elettromagnetica – che spinge i protoni a parte. Se la forza forte vince, i nuclei in collisione si legano insieme, o si fondono, per formare un nucleo più pesante.
Il nostro sole è un buon esempio di questo. Una delle sue principali fonti di energia è una serie di reazioni di fusione e processi di decadimento beta che trasformano l’idrogeno in elio.

Trasformare la conoscenza in strumenti
Fin dai primi anni del 1900, quando l’esistenza degli isotopi fu realizzata per la prima volta, fisici e chimici nucleari hanno cercato modi per studiare come si possono formare gli isotopi, come decadono e come potremmo usarli.
A quanto pare, la natura degli isotopi – la loro uniformità chimica, il loro carattere distintivo nucleare – li rende utili per una vasta gamma di applicazioni in campi diversi come la medicina, l’archeologia, l’agricoltura, la produzione di energia e l’estrazione mineraria.
Se avete mai avuto una scansione PET, avete beneficiato di un sottoprodotto del decadimento radioattivo di alcuni isotopi (spesso chiamati isotopi medici). Produciamo questi isotopi medici usando la nostra conoscenza di come procedono le reazioni nucleari, con l’aiuto di reattori nucleari o acceleratori chiamati ciclotroni.
Ma abbiamo anche trovato modi per fare uso di isotopi radioattivi presenti in natura. Carbonio incontri, per esempio, fa uso del carbonio isotopo longevo-14 per determinare quanti anni gli oggetti sono.
In circostanze normali, il carbonio-14 viene prodotto nella nostra atmosfera attraverso reazioni di raggi cosmici con azoto-14. Ha un’emivita di circa 5.700 anni, il che significa che metà di una quantità di carbonio-14 sarà decaduta in quel periodo di tempo.

Mentre un organismo biologico è vivo, prende circa un isotopo di carbonio-14 per ogni trilione di isotopi stabili di carbonio-12 e il rapporto tra carbonio-12 e carbonio-14 rimane circa lo stesso mentre l’organismo vive. Una volta che muore, nuova assunzione di carbonio si ferma.
Ciò significa che il rapporto tra carbonio-14 e carbonio-12 cambia nei resti di questo organismo nel tempo.
Se estraiamo il carbonio usando metodi chimici da un campione, possiamo quindi applicare un metodo chiamato spettrometria di massa dell’acceleratore (AMS) per separare i singoli isotopi di carbonio in peso.
AMS fa uso del fatto che particelle accelerate con la stessa carica ma masse diverse seguono percorsi separati attraverso campi magnetici. Facendo uso di questi percorsi separati, siamo in grado di determinare i rapporti isotopici con incredibile precisione.
Come puoi vedere da questi esempi, applichiamo la nostra conoscenza degli isotopi in una varietà di modi. Li produciamo, li rileviamo, li estraiamo e li studiamo con il duplice scopo di capire perché il nucleo atomico si comporta così e come possiamo sfruttare il suo potere a nostro vantaggio.