Poiché la maggior parte dei nuovi ioni idrossido viene rimossa, il pH non aumenta molto.
Rimozione degli ioni idrossido mediante reazione con ioni idrogeno
Ricordare che sono presenti alcuni ioni idrogeno dalla ionizzazione dell’acido etanoico.
![]()
![]()
Gli ioni idrossido possono combinarsi con questi per produrre acqua. Non appena ciò accade, l’equilibrio punta a sostituirli. Questo continua ad accadere fino a quando la maggior parte degli ioni idrossido vengono rimossi.
![]()
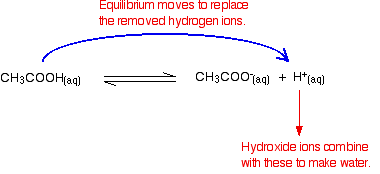
Ancora una volta, poiché si hanno equilibri coinvolti, non tutti gli ioni idrossido vengono rimossi – solo la maggior parte di essi. L’acqua formata ri-ionizza in misura molto piccola per dare pochi ioni idrogeno e ioni idrossido.
Soluzioni tampone alcaline
Prenderemo una miscela di soluzioni di ammoniaca e cloruro di ammonio come tipico.
L’ammoniaca è una base debole e la posizione di questo equilibrio sarà ben a sinistra:
![]()
![]()
L’aggiunta di cloruro di ammonio a questo aggiunge molti ioni di ammonio extra. Secondo il principio di Le Chatelier, ciò porterà la posizione dell’equilibrio ancora più a sinistra.
La soluzione conterrà quindi queste cose importanti:
-
un sacco di ammoniaca non reagita;
-
un sacco di ioni ammonio dal cloruro di ammonio;
-
abbastanza ioni idrossido per rendere la soluzione alcalina.
Altre cose (come acqua e ioni cloruro) che sono presenti non sono importanti per l’argomento.
Aggiunta di un acido a questa soluzione tampone
Ci sono due processi che possono rimuovere gli ioni idrogeno che si stanno aggiungendo.
Rimozione reagendo con ammoniaca
La sostanza di base più probabile che uno hydrogen idrogeno sta per scontrarsi con è una molecola di ammoniaca. Reagiranno per formare ioni di ammonio.
![]()
![]()
La maggior parte, ma non tutti, degli ioni idrogeno saranno rimossi. Lo ammonium ammonio è debolmente acido e quindi alcuni ioni idrogeno verranno rilasciati di nuovo.
Rimozione degli ioni idrogeno reagendo con ioni idrossido
Ricorda che sono presenti alcuni ioni idrossido dalla reazione tra l’ammoniaca e l’acqua.
![]()
![]()
Gli ioni idrogeno possono combinarsi con questi ioni idrossido per produrre acqua. Non appena ciò accade, l’equilibrio punta a sostituire gli ioni idrossido. Questo continua ad accadere fino a quando la maggior parte degli ioni idrogeno vengono rimossi.
![]()
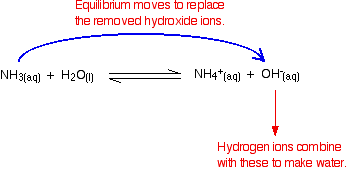
Ancora una volta, poiché si hanno equilibri coinvolti, non tutti gli ioni idrogeno vengono rimossi – solo la maggior parte di essi.
Aggiungendo un alcali a questa soluzione tampone
Gli ioni idrossido dall’alcali vengono rimossi da una semplice reazione con ioni ammonio.
![]()
![]()
Poiché l’ammoniaca formata è una base debole, può reagire con l’acqua – e quindi la reazione è leggermente reversibile. Ciò significa che, ancora una volta, la maggior parte (ma non tutti) degli ioni idrossido vengono rimossi dalla soluzione.
Calcoli che coinvolgono soluzioni buffer
Questa è solo una breve introduzione. Ci sono altri esempi, tra cui diverse varianti, oltre 10 pagine nel mio libro di calcoli di chimica.
Soluzioni tampone acide
Questo è più facile da vedere con un esempio specifico. Ricorda che un tampone acido può essere fatto da un acido debole e uno dei suoi sali.
Supponiamo di avere una soluzione tampone contenente 0,10 mol dm – 3 di acido etanoico e 0.20 mol dm – 3 di etanoato di sodio. Come si calcola il suo pH?
In qualsiasi soluzione contenente un acido debole, c’è un equilibrio tra l’acido non ionizzato e i suoi ioni. Quindi per l’acido etanoico, hai l’equilibrio:
![]()
![]()
La presenza degli ioni etanoato dall’etanoato di sodio avrà spostato l’equilibrio a sinistra, ma l’equilibrio esiste ancora.
Ciò significa che puoi scrivere la costante di equilibrio, Ka, per questo:
![]()
![]()
Dove hai fatto calcoli usando questa equazione in precedenza con un acido debole, avrai supposto che le concentrazioni degli ioni idrogeno e degli ioni etanoato fossero le stesse. Ogni molecola di acido etanoico che si divide dà uno di ogni tipo di ion.
Non è più vero per una soluzione buffer:
![]()
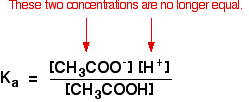
Se l’equilibrio è stato spinto ancora più a sinistra, il numero di ioni etanoato provenienti dall’acido etanoico sarà completamente trascurabile rispetto a quelli dell’etanoato di sodio.
Assumiamo quindi che la concentrazione di ioni etanoato sia la stessa della concentrazione dell’etanoato di sodio – in questo caso, 0,20 mol dm-3.
In un calcolo dell’acido debole, normalmente assumiamo che così poco dell’acido si sia ionizzato che la concentrazione dell’acido all’equilibrio sia la stessa della concentrazione dell’acido che abbiamo usato. Ciò è ancor più vero ora che l’equilibrio è stato spostato ancora più a sinistra.
Così i presupposti per una soluzione tampone sono:
![]()
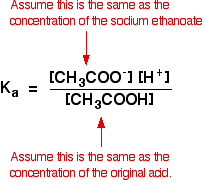
Ora, se conosciamo il valore di Ka, si può calcolare la concentrazione di ioni idrogeno e di conseguenza il pH.
Ka per ethanoic acido è 1,74 x 10-5 mol dm-3.
Ricordiamo che vogliamo calcolare il pH di una soluzione tampone contenente 0,10 mol dm-3 di acido etanoico e 0,20 mol dm-3 di etanoato di sodio.
![]()
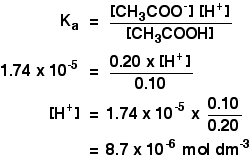
Poi tutto quello che dovete fare è trovare il pH con l’espressione
pH = -log10
Si avrà ancora il valore della concentrazione di ioni idrogeno sul vostro calcolatore, quindi, premere il pulsante log e ignorare il segno negativo (per consentire il segno meno, il pH espressione).
Dovresti ottenere una risposta da 5.1 a due cifre significative. Non puoi essere più preciso di questo, perché le tue concentrazioni sono state date solo a due cifre.