Quanta energia viene rilasciata nell’idrolisi dell’ATP?
Modalità lettore
L’ATP è spesso indicato come la valuta energetica della cella. Centinaia di reazioni nella cellula dalle trasformazioni metaboliche agli eventi di segnalazione sono accoppiate all’idrolisi (letteralmente che significa “allentamento dell’acqua”) dell’ATP da parte dell’acqua . La reazione ATP + H2O <> ADP + Pi trasforma l’adenosina trifosfato (ATP) in adenosina difosfato (ADP) e fosfato inorganico (Pi). Il cambiamento di energia libera associato a questa reazione determina una grande frazione di reazioni cellulari con il potenziale di membrana e la potenza riducente che sono le altre due fonti di energia dominanti. Ma esattamente quanto vale questa valuta energetica e cosa rivela sulle transazioni chimiche che possono essere acquistate? Naturalmente, non c’è una risposta a questa domanda poiché la quantità di energia liberata da questa reazione di idrolisi dipende dalle condizioni intracellulari, ma è possibile avere un’idea del “valore” approssimativo di questa valuta ricorrendo ad alcune semplici stime.

Figura 1: La relazione tra l’energia libera di Gibbs dell’idrolisi di ATP in condizioni standard e la costante di equilibrio e la relazione tra l’energia libera dell’idrolisi in condizioni fisiologiche e le concentrazioni di reagenti fisiologici.
Il cambiamento di energia libera di Gibbs (ΔG) dovuto all’idrolisi dell’ATP dipende dalle concentrazioni dei vari partecipanti alla reazione come illustrato nella Figura 1. Quando le concentrazioni sono più lontane dai loro valori di equilibrio, il valore assoluto di ΔG è maggiore. In condizioni “standard” (es. concentrazioni di 1M per tutti i reagenti tranne l’acqua che viene presa alla sua concentrazione caratteristica di 55M) l’energia libera di Gibbs dell’idrolisi ATP varia da -28 a -34 kJ / mol (cioè ≈12 kBT, BNID 101989) a seconda della concentrazione del catione Mg2+. La dipendenza dagli ioni Mg si verifica perché gli ioni di magnesio caricati positivamente aiutano a stabilizzare la molecola di ATP. Tuttavia, nella cella le condizioni non sono mai nemmeno vicine ai valori di stato standard. Ad esempio, una concentrazione di 1M ATP significherebbe che la massa di soluto sarebbe simile a quella del solvente dell’acqua stessa. Nella figura 1 mostriamo la derivazione spesso confusa dell’energia libera fisiologica (ΔG) dato il rapporto delle concentrazioni dal valore standard (ΔGo). La divisione per termini come sono necessari per prendersi cura delle unità come logaritmo dovrebbe sempre contenere un termine senza unità. A volte è sorprendente pensare che se la cellula fosse all’equilibrio, il valore di ΔG sarebbe stato zero e non ci sarebbe energia da guadagnare per idrolisi di ATP. Fortunatamente, questo non è mai il caso negli organismi viventi. .
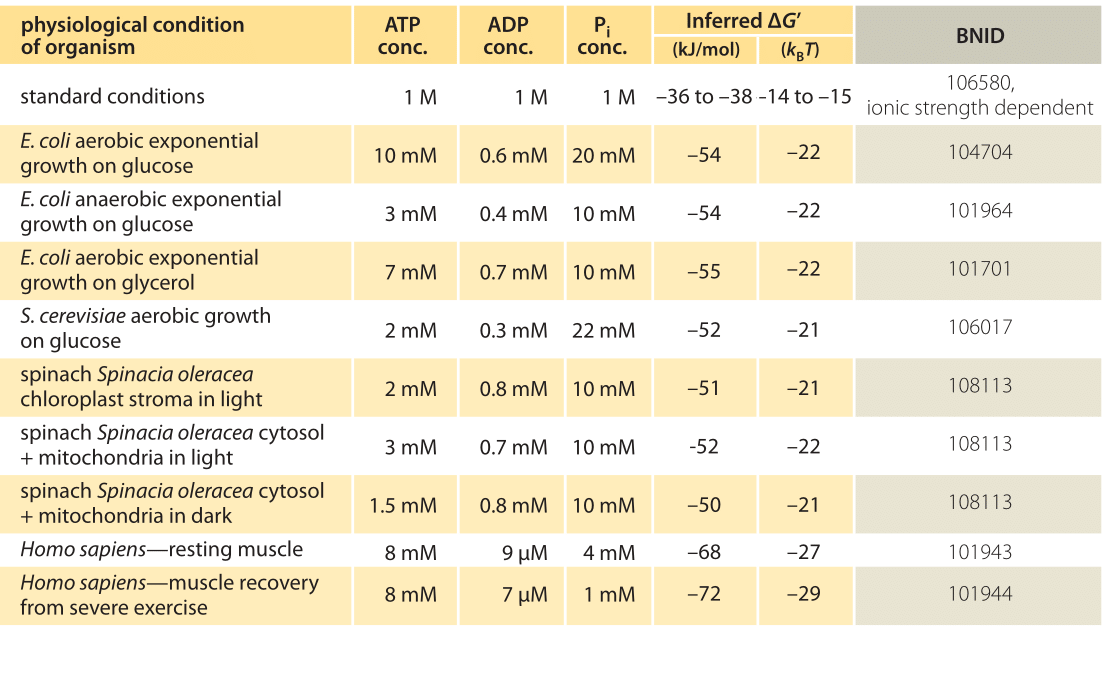
Tabella 1: Energia libera per l’idrolisi dell’ATP in vari organismi e in diverse condizioni fisiologiche. Dedotto calcoli ΔG ‘ basati su un valore di ΔG’0 di -37,6 kJ/mol. Ciò rende i valori della tabella coerenti tra loro ma crea piccole deviazioni dai valori ΔG’ riportati nelle fonti primarie. Tali deviazioni possono derivare da variazioni nella forza ionica, pH e metodi di misurazione pregiudizi. I valori sono arrotondati a una o due cifre significative. Negli spinaci, dove la concentrazione di Pi non è stata riportata, è stato utilizzato un valore caratteristico di 10 mm (BNID 103984, 103983, 111358, 105540).
In pratica le condizioni fisiologiche dipendono dall’organismo studiato, dal tessuto o dal compartimento all’interno della cellula in esame e dalle attuali richieste di energia per reazioni metaboliche e di altro tipo. Ad esempio, nel fegato di ratto perfuso il rapporto ATP-ADP è risultato essere di circa 10:1 nel citosol ma 1:10 nei mitocondri con alti tassi di glicolisi e con bassi tassi di glicolisi entrambi i rapporti erano molto vicini a 1 (BNID 111357). Pertanto è previsto un intervallo di valori per ΔG. La chiave per comprendere questo intervallo è avere un’idea di quanto Q differisca da K, cioè come le concentrazioni differiscano dalle condizioni standard. Le concentrazioni intracellulari tipiche di tutti i componenti rilevanti (ATP, ADP e Pi) sono nell’intervallo mM, molto più basse rispetto alle condizioni standard. Il rapporto / con concentrazioni nell’intervallo mM è molto inferiore a uno e la reazione sarà energeticamente più favorevole rispetto alle condizioni standard come mostrato nella Tabella 1. Il valore più alto ≈-70 kJ / mol (≈30kBT) è stato calcolato dai valori nel muscolo umano degli atleti che si riprendono dopo lo sforzo (BNID 101944). Nelle cellule di E. coli che crescono sul glucosio, è stato riportato un valore di -47 kJ / mol (≈20kBT, BNID 101964). Per mettere questi numeri in prospettiva, un motore molecolare che esercita una forza di circa 5 pN (BNID 101832) su una dimensione di passo di 10 nm (BNID 101857) funziona di ordine 50 PN nm, richiedendo poco più di 10 kBT di energia, ben all’interno della gamma di ciò che un singolo ATP può fornire.
I calcoli di ΔG richiedono una misurazione accurata delle concentrazioni intracellulari rilevanti. Tali concentrazioni sono misurate in vivo nell’uomo utilizzando la risonanza magnetica nucleare. La forma naturale del fosforo (31P) ha proprietà magnetiche, quindi non è necessario aggiungere alcuna sostanza esterna. Il tessuto di interesse come il muscolo è posto in un forte campo magnetico e gli spostamenti di frequenza degli impulsi radio sono usati per dedurre la concentrazione di ATP e Pi direttamente dai picchi negli spettri NMR. In E. coli, le concentrazioni di ATP possono essere misurate più direttamente con un test di bioluminescenza ATP. Un campione di batteri in crescita rimossi dalla coltura può essere analizzato utilizzando luciferasi, una proteina da batteri che vivono in simbiosi con calamari ma che è ormai entrato nella cassetta degli attrezzi dei biologi come reporter molecolare. L’enzima luciferasi utilizza ATP in una reazione che produce luce che può essere misurata utilizzando un luminometro e la concentrazione di ATP può essere dedotta dalla potenza del segnale. Quindi abbiamo il contenuto della cella come input, luciferasi come “dispositivo” che trasforma la quantità di ATP in emissione luminosa che funge da output misurato. Usando strumenti come questi si scopre che nella “vita reale” l’ATP vale circa il doppio rispetto alle condizioni “standard” a causa delle concentrazioni più favorevoli per la reazione in avanti.
Finiamo notando che è una domanda permanente sul perché il nucleotide dell’adenina sia stato individuato per servire come principale valuta energetica con GTP e gli altri nucleotidi che servono ruoli molto più minori. È un caso di scelta casuale che in seguito è diventato “incidente congelato” o c’era un vantaggio selettivo per ATP rispetto a GTP, CTP, UTP e TTP?




