
Il volume molare (simbolo Vm) di una sostanza è il volume occupato da una mole della sostanza alla volta.data temperatura e pressione. È uguale alla massa molecolare (M) della sostanza divisa per la sua densità (ρ) alla data temperatura e pressione:
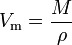
Ha un’unità SI di metri cubi per mole (m3/mol). Tuttavia, i volumi molari sono spesso espressi in metri cubi per 1.000 moli (m3/kmol) o decimetri cubici per mol (dm3/mol) per i gas e in centimetri per mole (cm3/mol) per liquidi e solidi.
Se una sostanza è una miscela contenente N componenti, il volume molare viene calcolato utilizzando:
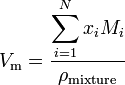
dove x è la frazione molare dell’i-esimo componente, M è la massa molecolare dell’i-esimo componente e pmixture è la miscela densità a una data temperatura e pressione.
Quando si indicano i valori numerici del volume molare, è importante indicare anche le condizioni date di temperatura e pressione. Altrimenti, i valori numerici sono privi di significato.
gas Ideali
La legge del gas ideale equazione può essere riorganizzato per dare a questa espressione per il volume molare di un gas ideale:
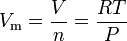
Dove in unità del SI:
= gas di pressione assoluta, in Pa
= numero di moli, in mol
= volume molare del gas, in m3/mol
= gas temperatura assoluta in K
= universale dei gas legge costante di 8.314472 m3·Pa·mol-1·K-1
Dove STATUNITENSI unità:
= gas di pressione assoluta, nel psia
= numero di moli, in lb-mol
= volume molare del gas, in ft3/lb-mol
= gas temperatura assoluta in gradi di Rankine (°R)
= universale dei gas legge costante di 10.7316 ft3·psia·lb-mol-l·°R-1
Esempio di calcolo di un gas ideale i volumi molari:
- Nel SI l’unità di misura metriche:
Vm = 8.314472 × 273.15 / 101,325 = 0.022414 m3/mol a 0 °C e 101,325 Pa di pressione assoluta = 22.414 m3/kmol a 0 °C (273.15 K) e 101.325 kPa di pressione assoluta Vm = 8.314472 × 273.15 / 100,000 = 0.022711 m3/kmol a 0 °C e 100 000 Pa di pressione assoluta = 22.711 m3/kmol a 0 °C (273.15 K) e 100 kPa di pressione assoluta
- Nel consueto USA quote:
Vm = 10.7316 × 519.67 / 14.696 = 379.48 ft3/lb-mol a 60 °F (519.67 °R) e 14.696 psia
Note:
- lb-mol è un’abbreviazione per la libbra-mol
- °R è in gradi di Rankine (una scala di temperatura assoluta) e °F è in gradi Fahrenheit (una scala di temperatura).
- °R = ° F + 459.67
- La letteratura tecnica può essere confusa perché alcuni autori spesso non riescono a spiegare se stanno usando la costante di legge universale del gas R, che si applica a qualsiasi gas ideale, o se stanno usando la costante di legge specifica del gas Rs, che si applica solo a un singolo gas specifico. La relazione tra le due costanti è Rs = R / M dove M è la massa molecolare del gas.
Gas reali
I gas reali sono quei gas che non presentano un comportamento del gas ideale. Per i gas, il metodo più semplice per determinare i volumi molari è utilizzando compressibilità fattori come l’espressione seguente:
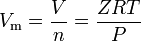
dove Z è il fattore di compressibilità del gas, che è un utile termodinamico proprietà per modificare la legge del gas ideale per tenere conto del comportamento dei gas perfetti. L’equazione di cui sopra è fondamentalmente una semplice equazione di stato (EOS). La limitazione principale di questa equazione di stato è che il fattore di compressibilità del gas, Z, non è una costante, ma varia da un gas all’altro, nonché con la temperatura e la pressione del gas in esame.
Valori più accurati dei volumi molari di gas reali possono essere ottenuti usando equazioni di stato come l’equazione di van der Waals sviluppata nel 1873, l’equazione di Redlich-Kwong sviluppata nel 1949, l’equazione di Soave-Redlich-Kwong sviluppata nel 1972 e l’equazione di Peng-Robinson sviluppata nel 1976.
- 1.0 1.1 International Union of Pure and Applied chemistry (IUPAC): Quantities, Units and Symbols in Physical Chemistry 2nd Edition, 1993
- 2.0 2.1 NIST Guide to SI Item 8.6.3 in Section 8
- 3.0 3.1 Determination of gas compressibility values Information on how to determine gas compressibility factors and molar volumes.
| |
Alcuni contenuti di questa pagina potrebbero essere apparsi in precedenza su Citizendium. |