Termini chiave
Assicurati di poter definire e utilizzare nel contesto i termini chiave di seguito.
- Catalizzatore di Adams
- idrogenazione
Note di studio
Le reazioni chimiche eterogenee hanno reagenti che si trovano in almeno due fasi diverse (ad esempio gas con un solido), mentre le reazioni omogenee si verificano in una singola fase (ad esempio gas con un altro gas).
Una certa confusione può derivare dalla descrizione del catalizzatore utilizzato nella reazione tra alcheni e idrogeno. Tre metalli-nichel, platino e palladio-sono comunemente usati, ma un chimico non può semplicemente posizionare un pezzo di uno di questi metalli in una miscela di alchene e idrogeno e ottenere una reazione. Ogni catalizzatore metallico deve essere preparato in un modo speciale:
- il nichel viene solitamente utilizzato in una forma finemente divisa chiamata “Raney nickel.”È preparato facendo reagire una lega di Ni-Al con NaOH.
- il palladio è ottenuto commercialmente “supportato” su una sostanza inerte, come il carbone di legna, (Pd/C). L’alchene è solitamente disciolto in etanolo quando Pd / C è usato come catalizzatore.
- il platino è usato come PtO2, catalizzatore di Adams, anche se in realtà è il metallo platino che è il catalizzatore. L’idrogeno utilizzato per aggiungere al doppio legame carbonio-carbonio riduce anche l’ossido di platino (IV) a metallo di platino finemente diviso. Etanolo o acido acetico è usato come solvente per l’alchene.
Altri tipi di composti contenenti legami multipli, come chetoni, esteri e nitrili, non reagiscono con l’idrogeno nelle condizioni utilizzate per idrogenare gli alcheni. Gli esempi seguenti mostrano la riduzione di un alchene, ma i gruppi chetonici e nitrilici presenti rimangono intatti e non sono ridotti.

Anche gli anelli aromatici non sono ridotti nelle condizioni utilizzate per ridurre gli alcheni, sebbene questi anelli sembrino contenere tre doppi legami carbonio-carbonio. Come vedrai più avanti, gli anelli aromatici non contengono realmente doppi legami, e molti chimici preferiscono rappresentare l’anello benzenico come un esagono con un cerchio al suo interno

piuttosto che come un esagono con tre doppi legami alternati.
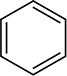
La rappresentazione dell’anello benzenico sarà discussa ulteriormente nella Sezione 15.2.
La reazione tra doppi legami carbonio-carbonio e idrogeno fornisce un metodo per determinare il numero di doppi legami presenti in un composto. Per esempio, una mole di cicloesene reagisce con una mole di idrogeno per produrre una mole di cicloesano:

ma una mole di 1,4-cyclohexadiene reagisce con due moli di idrogeno per formare una mole di cicloesano:
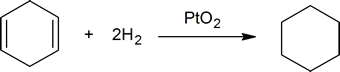
Un chimico direbbe che cicloesene reagisce con un equivalente di idrogeno, e 1,4-cicloesadiene reagisce con due equivalenti di idrogeno. Se si prende una quantità nota di un idrocarburo sconosciuto e insaturo e si determina la quantità di idrogeno che assorbirà, è possibile determinare facilmente il numero di doppi legami presenti nell’idrocarburo (vedere domanda 2, sotto).
L’aggiunta di idrogeno a un doppio legame carbonio-carbonio è chiamata idrogenazione. L’effetto complessivo di tale aggiunta è la rimozione riduttiva del gruppo funzionale a doppio legame. La regioselettività non è un problema, poiché lo stesso gruppo (un atomo di idrogeno) è legato a ciascuno dei carboni a doppio legame. La fonte più semplice di due atomi di idrogeno è l’idrogeno molecolare (H2), ma la miscelazione di alcheni con idrogeno non provoca alcuna reazione distinguibile. Sebbene la reazione di idrogenazione complessiva sia esotermica, un’elevata energia di attivazione impedisce che si verifichi in condizioni normali. Questa restrizione può essere aggirata mediante l’uso di un catalizzatore, come mostrato nello schema seguente.
Un esempio di reazione di addizione alchenica è un processo chiamato hydrogenation.In una reazione di idrogenazione, due atomi di idrogeno vengono aggiunti attraverso il doppio legame di un alchene, risultando in un alcano saturo. L’idrogenazione di un doppio legame è una reazione termodinamicamente favorevole perché forma un prodotto più stabile (energia inferiore). In altre parole, l’energia del prodotto è inferiore all’energia del reagente; quindi è esotermica (il calore viene rilasciato). Il calore rilasciato è chiamato il calore di idrogenazione, che è un indicatore della stabilità di una molecola.


I catalizzatori sono sostanze che modificano la velocità (velocità) di una reazione chimica senza essere consumate o apparire come parte del prodotto. I catalizzatori agiscono abbassando l’energia di attivazione delle reazioni, ma non modificano l’energia potenziale relativa dei reagenti e dei prodotti. I metalli finemente divisi, come platino, palladio e nichel, sono tra i catalizzatori di idrogenazione più utilizzati. L’idrogenazione catalitica avviene in almeno due fasi, come illustrato nel diagramma. In primo luogo, l’alchene deve essere adsorbito sulla superficie del catalizzatore insieme ad alcuni dell’idrogeno. Successivamente, due idrogeni si spostano dalla superficie metallica ai carboni del doppio legame e l’idrocarburo saturo risultante, che è più debolmente adsorbito, lascia la superficie del catalizzatore. La natura esatta e la tempistica degli ultimi eventi non è ben compresa.

Come mostrato nel diagramma di energia, l’idrogenazione degli alcheni è esotermica e il calore viene rilasciato corrispondente al ΔE (colorato verde) nel diagramma. Questo calore di reazione può essere utilizzato per valutare la stabilità termodinamica di alcheni con diversi numeri di sostituenti alchilici sul doppio legame. Ad esempio, la seguente tabella elenca i riscaldamenti di idrogenazione per tre alcheni C5H10 che danno lo stesso prodotto alcano (2-metilbutano). Poiché un grande calore di reazione indica un reagente ad alta energia, questi riscaldamenti sono inversamente proporzionali alle stabilità degli isomeri alchenici. Ad un’approssimazione approssimativa, vediamo che ogni sostituente alchilico su un doppio legame stabilizza questo gruppo funzionale di un po ‘ più di 1 kcal/mole.
| Alkene Isomer | (CH3)2CHCH=CH2 3-methyl-1-butene |
CH2=C(CH3)CH2CH3 2-methyl-1-butene |
(CH3)2C=CHCH3 2-methyl-2-butene |
|---|---|---|---|
| Heat of Reaction ( ΔHº ) |
–30.3 kcal/mole | –28.5 kcal/mole | –26.9 kcal/mole |

Dal meccanismo mostrato qui ci si aspetterebbe che l’aggiunta di idrogeno avvenga con syn-stereoselettività. Questo è spesso vero, ma i catalizzatori di idrogenazione possono anche causare l’isomerizzazione del doppio legame prima dell’aggiunta di idrogeno, nel qual caso la stereoselettività può essere incerta.

Esercita
- Nella reazione
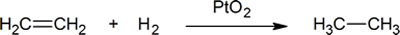
- 0,500 mol di etene reagisce con _______ mol di idrogeno. Quindi un chimico potrebbe dire che l’etene reagisce con un _ _ _ _ _ _ _ di idrogeno.
- l’etene viene_______; mentre _ _ _ _ _ _ _ _ viene ossidato.
- il numero di ossidazione del carbonio in etene è _______; in etano è _______.
- Quando 1.000 g di un certo trigliceride (grasso) viene trattato con gas idrogeno in presenza del catalizzatore di Adams, si scopre che il volume di gas idrogeno consumato a 99,8 kPa e 25,0°C è di 162 mL. Un esperimento separato indica che la massa molare del grasso è 914 g mol−1. Quanti doppi legami carbonio-carbonio contiene il composto?
Risposte:
-
-
Mostra risposta
-
Mostra risposta
-
Mostra risposta
-
-
Mostra la Risposta
Examples
Question
Predict the products if the following alkenes were reacted with catalytic hydrogen.

Solution

Contributors
- Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
- Prof. Steven Farmer (Sonoma State University)
- Chimica organica con un’enfasi biologica di Tim Soderberg (Università del Minnesota, Morris)