Il normale metabolismo cellulare dipende dal mantenimento del pH ematicoentro limiti molto ristretti (7,35-7,45).
Anche escursioni relativamente lievi al di fuori di questo intervallo di pH normale possono avere effetti deleteri, tra cui una ridotta erogazione di ossigeno ai tessuti, perturbazioni elettrolitiche e cambiamenti nella contrattilità del muscolo cardiaco; la sopravvivenza è grave se il pH del sangue scende al di sotto di 6,8 o sale al di sopra di 7,8.
il problema per Il corpo che è normale metabolismo è associato withcontinuous produzione di ioni idrogeno (H+) e il biossido di carbonio(CO2), che tendono a ridurre il pH. Il mechanismwhich supera questo problema e serve a mantenere il normale pH del sangue(cioè mantenere equilibrio acido-base) è una complessa sinergia ofaction che coinvolgono chimica del buffer nel sangue, globuli rossi(eritrociti), che circolano nel sangue, e la funzione di threeorgans: polmoni, reni e cervello.
Prima di spiegare come questi cinque elementi contribuiscono al mantenimento complessivo del pH del sangue, sarebbe utile rivedere rapidamente alcuni concetti di base.
- Cos’è un acido, cos’è una base e cos’è il pH?
- Che cos’è un buffer? – il sistema tampone bicarbonato
- Funzione polmonare, trasporto di CO2 e equilibrio acido-basebalance
- Reni e equilibrio acido-base
- DISTURBI DELL’EQUILIBRIO ACIDO-BASE
- Cause di disturbi acido-base
- Acidosi respiratoria – (aumento di pCO2(a),pH ridotto)
- Alcalosi respiratoria – (ridottapCO2(a), aumento del pH)
- Acidosi metabolica – (diminuitoHCO3 -, diminuzione del pH)
- Alcalosi metabolica – (aumentatoHCO3 -, aumento del pH)
- Compensazione-una conseguenza di acido-basedisturbance
- Disturbi misti acido-base
- Sommario
- Alcuni hanno suggerito di leggere ulteriormente
Cos’è un acido, cos’è una base e cos’è il pH?
Un acido è una sostanza che rilascia ioni idrogeno (H+) sulla dissociazione in soluzione.
Per esempio: Acido cloridrico (HCl) si dissocia per hydrogenions e ioni cloruro
HCl ![]() H+ + Cl-
H+ + Cl-
l’acido Carbonico (H2CO3) si dissocia tohydrogen ioni bicarbonato e ioni
H2CO3 ![]() H+ +HCO3–
H+ +HCO3–
Possiamo distinguere tra acidi forti come l’acido cloridrico andweak gli acidi, come l’acido carbonico. La differenza è che gli acidi fortidissociare più degli acidi deboli. Di conseguenza, la concentrazione di ioni idrogeno di un acido forte è molto superiore a quella di un acido debole.
Una base è una sostanza che in soluzione accettaioni di idrogeno.
Ad esempio, il bicarbonato di base (HCO3–)accetta ioni idrogeno per formare acido carbonico:
HCO3– + H+ ![]() H2CO3
H2CO3
Il pH è una scala di 0-14 di acidità e alcalinità. L’acqua pura ha un pH di 7 ed è neutra (né acida né alcalina). pH superiore a 7è alcalino e inferiore a 7 acido. Quindi il pH del sangue (7,35-7,45) è leggermente alcalino sebbene nella medicina clinica il termine alcalosiè, forse confusamente, riservato al pH del sangue superiore a 7.45e il termine acidosi è riservato per il pH del sangue inferiore a 7,35.
pH è una misura della concentrazione di ioni idrogeno (H+).Le due cose sono collegate secondo il followingequation:
pH = – log10
dove è la concentrazione di ioni di idrogeno inmoles per litro (mmol/L)
Da questa equazione
pH 7.4 = H+ concentrazione di 40 nmol/L
pH 7.0 = H+ concentrazione di 100 nmol/L
pH 6.0 = H+ concentrazione di 1000 nmol/L
da:
- i due parametri variano inversamente; all’aumentare della concentrazione di ioni idrogeno, il pH diminuisce
- a causa della relazione logaritmica, un grande cambiamento nella concentrazione di ioni idrogeno è in realtà un piccolo cambiamento nel pH. Ad esempio, raddoppiando la concentrazione di ioni idrogeno il pH diminuisce di appena 0,3
Che cos’è un buffer? – il sistema tampone bicarbonato
I tamponi sono sostanze chimiche in soluzione che riducono al minimo il cambiamento di pH che si verifica quando gli acidi vengono aggiunti “lavando” gli ioni idrogeno. Un buffer è una soluzione di un acido debole e il suobase coniugata. Nel sangue, il sistema tampone principale è il deboleacido, acido carbonico (H2CO3) e la sua base coniugata, bicarbonato (HCO3–). Per spiegare howthis sistema riduce al minimo i cambiamenti di pH, supponiamo di aggiungere un acido forte,ad esempio HCl, il bicarbonato buffer:
L’acido si dissocia liberando ioni di idrogeno:
HCl ![]() H+ + Cl–
H+ + Cl–
Il bicarbonato di buffer poi ‘assorbe’ gli ioni di idrogeno, formingcarbonic acido nel processo:
HCO3– + H+ ![]() H2CO3 (acido carbonico)
H2CO3 (acido carbonico)
Il punto importante è che, poiché gli ioni di idrogeno da HClhave stata incorporata nella debole di acido carbonico, che non notdissociate facilmente, il numero totale di ioni di idrogeno in solutionand quindi il pH non cambia molto come sarebbe occurredin assenza di buffer.
Sebbene un buffer minimizzi grandemente il cambiamento di PH, non lo elimina perché anche un acido debole (come l’acido carbonico) si dissocia in una certa misura. Il pH di una soluzione tampone è una funzione delle concentrazioni relative dell’acido debole e della sua base coniugata.
pH = 6.1 + log (/)
Dove = concentrazione dibicarbonato
= concentrazione di acido carbonico
Questa relazione, nota come equazione di Henderson-Hasselbalch,mostra che il pH è governato dal rapporto tra concentrazione di base(HCO3–) e concentrazione di acido(H2CO3).
Come ioni idrogeno vengono aggiunti al buffer bicarbonato:
H+ +HCO3– ![]() H2CO3
H2CO3
il bicarbonato (base) viene consumato (la concentrazione diminuisce) e viene prodotto acido carbonico (la concentrazione aumenta). Se gli idrogenioni continuano ad essere aggiunti, tutto il bicarbonato finirebbe per essere consumato (convertito in acido carbonico) e non ci sarebbe alcun effetto tampone – il pH diminuirebbe bruscamente se fosse aggiunto più acido.
Tuttavia, se l’acido carbonico potesse essere continuamente rimosso dal sistema e il bicarbonato costantemente rigenerato, allora la capacità di assorbimento e quindi il pH potrebbero essere mantenuti nonostante l’aggiunta continuata di ioni idrogeno.
Come diventerà chiaro con più dettagli della fisiologia diequilibrio acido-base, cioè, in effetti, ciò che accade nel corpo. In assenza, i polmoni assicurano la rimozione dell’acido carbonico (come anidride carbonica) ei reni assicurano la rigenerazione continua dibicarbonato.
Questo ruolo dei polmoni dipende da una caratteristica singolaredel sistema tampone del bicarbonato e cioè la capacità dell’acido carbonico di essere convertito in anidride carbonica e acqua.
La seguente equazione illustra il rapporto di allelements del sistema tampone bicarbonato di come funziona nel corpo
H+ +HCO3– ![]() H2CO3
H2CO3 ![]() H2O + CO2
H2O + CO2
e ‘ importante notare che le reazioni sono reversibili.La direzione dipende dalla concentrazione relativa di ciascunoelemento. In modo che, ad esempio, un aumento del diossido di carboniola concentrazione forza la reazione a sinistra con una maggiore formazionedi acido carbonico e infine ioni idrogeno.
Questo spiega il potenziale acido dell’anidride carbonica e ci porta all’importante contributo che i polmoni e i globuli rossi apportano all’equilibrio acido-basebalance generale.
Funzione polmonare, trasporto di CO2 e equilibrio acido-basebalance
Una quantità costante di CO2 nel sangue, essenziale per il normale equilibrio acido-base, riflette un equilibrio tra quello prodotto come risultato del metabolismo cellulare dei tessuti e quello escreto dai polmoni aria inespressa.
Variando la velocità con cui si trova l’anidride carbonica, i polmoni regolano il contenuto di anidride carbonica nel sangue.La sequenza di eventi dalla produzione di anidride carbonica neltessuti all’eliminazione in aria espirata è descritta in Fig. 1.L’anidride carbonica si diffonde dalle cellule dei tessuti circondantisangue capsulare (Fig. 1 bis). Una piccola proporzione si dissolve nel sangueplasma e viene trasportato ai polmoni invariato.
Ma la maggior parte diffonde nei globuli rossi dove si combina con l’acqua per formare acido carbonico.L’acido si dissocia con la produzione di ioni idrogeno ebicarbonato. Gli ioni idrogeno si combinano con l’emoglobina deossigenata(l’emoglobina agisce come un tampone qui), prevenendo un pericoloso calo del pH cellulare e il bicarbonato si diffonde lungo una concentrazione gradiente dal globulo rosso al plasma.
Così la maggior parte del diossido di carbonioprodotto nei tessuti viene trasportato ai polmoni come bicarbonatein plasma sanguigno.
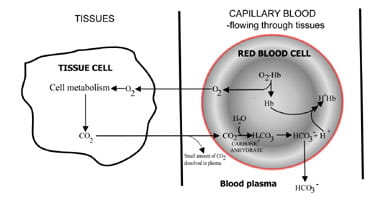
Fig. 1a. CO2 prodotta in tessuti convertiti in bicarbonato per il trasporto ai polmoni.
|
|
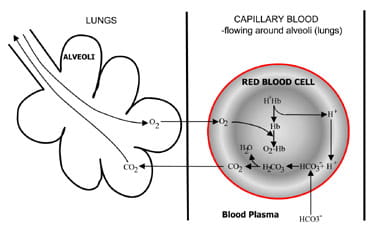
Fig. 1b. At the lungs bicarbonate convertedback to CO2 and eliminated by the lungs.
Agli alveoli nei polmoni il processo è invertito (Fig. 1 ter).Gli ioni idrogeno sono spostati dall’emoglobina mentre assorbono l’ossigenoda aria ispirata. Gli ioni idrogeno sono ora tamponati dal bicarbonato che si diffonde dal plasma in globuli rossi e si forma acido carbonico. Quando la concentrazione di questo aumenta, lo èconvertito in acqua e anidride carbonica. Infine, il diossido di carbonio riduce un gradiente di concentrazione da globuli rossi a alveoli per l’escrezione in aria espirata.
I chemorecettori respiratori nel tronco cerebrale rispondono ai cambiamentinella concentrazione di anidride carbonica nel sangue, causando un aumentoventilazione (respirazione) se la concentrazione di anidride carbonica aumenta ediminuire la ventilazione se l’anidride carbonica cade.
Reni e equilibrio acido-base
Il normale metabolismo cellulare provoca una continua produzione di ioni idrogeno. Abbiamo visto che combinando questi ioni idrogeno, il tampone bicarbonato nel sangue minimizza il loro effetto. Tuttavia, il buffering è utile solo a breve termine e,in definitiva, gli ioni idrogeno devono essere rimossi dal corpo.Inoltre, è importante che il bicarbonato che viene utilizzato abuffer ioni idrogeno viene continuamente sostituito.
Questi due compiti,l’eliminazione degli ioni idrogeno e la rigenerazione del bicarbonato, sonocomplesso dai reni. Le cellule dei tubuli renali sono ricche delenzima anidrasi carbonica, che facilita la formazione di anidride carbonica da anidride carbonica e acqua. L’acido carbonico dissocia gli ioni tobicarbonato e idrogeno. Il bicarbonato viene riassorbito nel sangue e gli ioni idrogeno passano nel lume del tubulo e vengono eliminati dal corpo nelle urine.
Questa eliminazione urinaria èdipendente dalla presenza nelle urine di tamponi, principalmente ioni fosfati e ammoniaca.
DISTURBI DELL’EQUILIBRIO ACIDO-BASE
la Maggior parte acido-base disturbi del risultato
- malattia o danni agli organi (reni, polmoni, cervello), la cui funzione normale è necessario per l’equilibrio acido-base,
- malattia che provoca un anomalo aumento della produzione di acidi metabolici tale che i meccanismi omeostatici sono sopraffatti
- intervento medico (ad es. ventilazione meccanica, alcuni farmaci)
I gas del sangue arterioso sono l’esame del sangue utilizzato per identificare emonitorare i disturbi acido-base. Tre parametri misurati durante l’analisi dei gas del sangue, il pH del sangue arterioso (pH), la pressione parziale di biossido di carbonio nel sangue arterioso(pCO2 (a)) e la concentrazione di bicarbonato (HCO3–) sono di importanza cruciale (cfr.Tabella I per la gamma di riferimento (normale)).I risultati di questi tre consentono la classificazione di acido-basedisturbance ad una delle quattro categorie eziologiche:
- Respiratory acidosis
- Respiratory alkalosis
- Metabolic acidosis
- Metabolic alkalosis
|
Adults |
Neonates |
|
|
pH |
7.35-7.45 |
7.30-7.40 |
|
pCO2 (kPa) |
4.7-6.0 |
3.5-5.4 |
|
Bicarbonate |
22-28 |
15-25 |
TABLE I. Gamme approssimative di riferimento (normali)
Per capire come i risultati di pH, pCO2(a)e bicarbonato sono usati per classificare i disturbi acido-base in questomodo, dobbiamo tornare all’equazione di Henderson-Hasselbalch
pH = 6.1 + log (/ )
Misuriamo pH e bicarbonato ma non acido carbonico(H2CO3). Tuttavia, esiste una relazionetra pCO2 (a) e h2co3che consente di rideterminare l’equazione di Henderson-Hasselbalch tra i tre parametri (pH, pCO2(a) ebicarbonato) misurati durante l’analisi dei gas ematici:
pH = 6.1 + log ( /( pCO2(a) × 0.23))
Rimuovendo tutte le costanti da questa equazione, la relazione tra i tre parametri misurati può essere più semplice:
pH pH / pCO2(a)
Questa relazione, cruciale per la comprensione di tutto ciò che segue riguardo ai disturbi acido-base, afferma che il pH del sangue arterioso è proporzionale al rapporto tra concentrazione di bicarbonato e pCO2(a). Permette le seguenti riduzioni:
- Il pH rimane normale finché il rapporto : pCO2(a) rimane normale
- Il pH aumenta (cioè si verifica alcalosi) se aumenta o pCO2(a) diminuisce.
- Il pH diminuisce (cioè si verifica acidosi) se uno diminuisce o pCO2 (a) aumenta
- Se entrambi pCO2(a) e sono aumentati di relativamente la stessa quantità, il rapporto e quindi il pH sono normali
- Se entrambi pCO2(a) e sono diminuiti di relativamente la stessa quantità, il rapporto e quindi il pH sono normali.
I disturbi acido-base colpiscono principalmente entrambipco2 (a), nel qual caso si chiama disturbo respiratorio o, nel qual caso, si chiama disturbo respiratorio o metabolico:
- Se il primario disturbo è alzata di pCO2(a) (che provoca acidosi – vedi sopra), la condizione è chiamata acidosi respiratoria
- Se il primario disturbo è una riduzione della pCO2(a) (che causa alcalosi – vedi sopra), la condizione è chiamata alcalosi respiratoria
- Se il primario disturbo è associato con ridotto bicarbonato (che si traduce in acidosi – vedi sopra), la condizione è detta acidosi metabolica
- Se il primario disturbo è associato con aumento di bicarbonato (che si traduce in alcalosi – vedi sopra), la condizione è chiamata alcalosi metabolica
Cause di disturbi acido-base
Acidosi respiratoria – (aumento di pCO2(a),pH ridotto)
L’acidosi respiratoria è caratterizzata da un aumentopco2(a) a causa di insufficiente ventilazione alveolare(ipoventilazione) e conseguente ridotta eliminazione diCO2 dal sangue. Le malattie respiratorie, comebronchopneumonia, enfisema, asma e vie aeree ostruttive cronichemalattie, possono essere associate a ipoventilazione sufficiente a causare acidosi respiratoria.
Alcuni farmaci (ad es. morfina ebarbiturati) può causare acidosi respiratoria deprimendo il centro respiratorio nel cervello. Danni o traumi alla parete toracica e la muscolatura coinvolta nella meccanica della respirazione puòridurre la velocità di ventilazione. Questo spiega l’acidosi respiratoriache può complicare il decorso di malattie come la poliomielite,la sindrome di Guillain-Barre e il recupero da un grave trauma toracico.
Alcalosi respiratoria – (ridottapCO2(a), aumento del pH)
Al contrario, l’alcalosi respiratoria è caratterizzata da diminuzionepco2(a) a causa dell’eccessiva ventilazione alveolaree conseguente eccessiva eliminazione di CO2 dal sangue.Malattia in cui, a causa della riduzione dell’ossigeno nel sangue (ipossiemia), ilcentro respiratorio è stimolato può provocare respiratorioalcalosi.
Esempi qui includono anemia grave, embolismoe sindrome respiratoria adulta polmonare. Iperventilazione sufficiente acausare l’alcalosi respiratoria può essere una caratteristica degli attacchi di ansia e rispondere al dolore severo. Una delle proprietà meno gradite disalicilato (aspirina) è il suo effetto stimolante sul respiratoriocentro. Questo effetto rappresenta l’alcalosi respiratoria che si verifica dopo sovradosaggio di salicilato. Infine, esageramentola ventilazione meccanica può causare alcalosi respiratoria.
Acidosi metabolica – (diminuitoHCO3 -, diminuzione del pH)
Il bicarbonato ridotto è sempre una caratteristica dell’acidosi metabolica. Ciò si verifica per uno dei due motivi: aumento dell’uso dibicarbonato nel tamponare un carico acido anormale o aumento delle perdite di bicarbonato dal corpo. La chetoacidosi diabetica e la lacticacidosi sono due condizioni caratterizzate da sovrapproduzione di acidi metabolici e conseguente esaurimento del bicarbonato.
Nel primo caso, concentrazioni ematiche anormalmente elevate di chetoacidi(acido b-idrossibutirrico e acido acetoacetico) riflettono i gravi disturbi metabolici derivanti dall’insulindeficienza.
Tutte le cellule producono acido lattico se sono carenti di ossigeno,quindi l’aumento della produzione di acido lattico e la conseguente acidosi metabolica si verificano in qualsiasi condizione in cui l’apporto di ossigeno ai tessuti è gravemente compromesso.
Esempi includono arresto cardiacoe qualsiasi condizione associata a shock ipovolemico (ad es. perdita di liquidi massicci). Il fegato svolge un ruolo importante nella rimozione del piccoloquantità di acido lattico prodotta durante il normale metabolismo cellulare, in modo che l’acidosi lattica possa essere una caratteristica del fallimento del fegato.
Perdita anormale di bicarbonato dal corpo può verificarsi durantegrave diarrea. Se non controllato, questo può portare ad acidosi metabolica.La mancata rigenerazione del bicarbonato e l’escrezione di ioni di idrogeno spiega l’acidosi metabolica che si verifica in renalfailure.
Alcalosi metabolica – (aumentatoHCO3 -, aumento del pH)
Il bicarbonato è sempre sollevato nell’alcalosi metabolica. Raramente, l’eccessiva somministrazione di bicarbonato o l’ingestione di bicarbonatein antiacido può causare alcalosi metabolica, ma questo èdi solito transitoria. La perdita anormale di ioni idrogeno dal corpo puòessere il problema principale. Bicarbonato che altrimenti beconsumed nel tamponare questi ioni di idrogeno persi consequentlyaccumulates in sangue. Il succo gastrico è acido e gastricoaspirazione o qualsiasi processo di malattia in cui i contenuti gastrici sonoperso dal corpo rappresenta una perdita di ioni idrogeno.
Il vomito proiettile di succo gastrico, ad esempio, spiega ilalkalosi metabolica che può verificarsi in pazienti con stenosi pilorica. Grave deplezione di potassio può causare alcalosi metabolicaa causa della relazione reciproca tra idrogeno e potassiumioni.
Compensazione-una conseguenza di acido-basedisturbance
E ‘ vitale per la vita che il pH non rinuncia troppo lontano dal normale,e il corpo sarà sempre tentare di restituire un pH anomalo towardsnormal quando l’equilibrio acido-base è disturbato. La compensazione è lo stesso dato a questo processo di conservazione della vita. Per capirecompensazione, è importante ricordare che il pH è governato da theratio: pCO2 (a).Finché il rapporto è normale, il pH sarà normale.
Considerare il paziente con acidosi metabolica il cui pH è bassoperché il bicarbonato è basso. Tocompensate per il rapporto basso e restorethe tutto-importante verso normale il paziente deve abbassare hispCO2 (a). I chemiorecettori nel centro respiratorio del cervello rispondono a una crescente concentrazione di ioni idrogeno(pH basso), causando una maggiore ventilazione (iperventilazione) e quindi una maggiore eliminazione dell’anidride carbonica; il PCO2(a) cade e il rapporto : pCO2(a) ritorna normale.
La compensazione per l’alcalosi metabolica in cui è alta, al contrario, comporta la depressione della respirazione e quindi la ritenzione del diossido di carbonioin modo che il pCO2(a) aumenti per corrispondere all’aumento . Tuttavia, la depressione ofrespiration ha l’effetto collaterale indesiderato di minacciare adequateoxygenation di tessuti. Per questo motivo la compensazione respiratoria dil’alcalosi metabolica è limitata.
I disturbi primari della pCO2(a) (acidosi respiratoria e alcalosi) sono compensati da aggiustamenti renali dell’escrezione di ioni idrogeno che provocano cambiamenti che compensano in modo appropriato il cambiamento primario della pCO2(a). Così il renalcompensation per l’acidosi respiratoria (raisedpCO2(a)) comprende il ofbicarbonate aumentato di riassorbimento e la compensazione renale per l’alcalosi respiratoria(pco2 ridotto(a)) comprende il bicarbonatereabsorption ridotto.
Il concetto di equilibrio acido-base durante la compensazioneviene trasmesso visivamente in Fig. 2. La tabella II riassume i gas del sanguerisultati che caratterizzano tutti e quattro i disturbi acido-base primae dopo la compensazione.
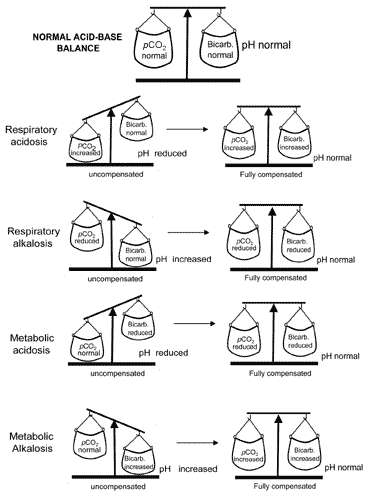
Fig. 2. Il”equilibrio acido-base” : compensationrestores normal pH
|
Primary disturbance |
||||
|
Respiratory |
Repiratory |
Metabolic |
Metabolic |
|
|
Some |
Emphysema |
Hyper- |
Renal failure |
Bicarbonate Potassium |
|
Compen- |
RENAL |
RENAL |
RESPIRA- |
RESPIRA- |
|
Initial blood |
pH |
pH |
pH |
pH |
|
Blood gas |
pH pCO2 |
pH pCO2 |
pH pCO2 |
Limitata |
|
Blood gas |
pH normal |
pH normal |
pH normal |
Limited |
Versione stampabile della tabella, pdf.
TABELLA II. I gas del sangue provocano disturbi diequilibrio acido-base
Compensazione respiratoria per un disturbo metabolico primariosi verifica molto più rapidamente della compensazione metabolica (renale) per un disturbo respiratorio primario. Nel secondo caso, compensazionesi verifica per giorni piuttosto che per ore.
Se i risultati di compensazione inreturn di pH a normale allora il paziente è detto per essere fullycompensated. Ma in molti casi la compensazione restituisce pHtowards normale senza effettivamente raggiungere la normalità; in tali casiil paziente si dice che sia parzialmente compensato.
Per motivi descritti sopra, l’alcalosi metabolica è molto raramente completamente compensata.
Disturbi misti acido-base
Dalla discussione di cui sopra si potrebbe presumere che tutti i pazienti con disturbi acido-base soffrano di una sola delle quattro categorie di equilibrio acido-base. Questo potrebbe essere il caso, ma in circostanze particolari i pazienti possono presentare più disturbi.
Ad esempio, considera il paziente con una cronicamalattia polmonare come l’enfisema che ha una lunga acidosi respiratoria parzialmente compensata. Se questo paziente fosse anche adiabetico che non aveva preso la sua dose normale di insulina e di conseguenza si trovava in uno stato di chetoacidosi diabetica, i risultati dei gas nel sangue rifletterebbero l’effetto combinato sia dell’acidosi respiratoria che dell’acidosi metabolica.
Tali disturbi misti acido-base non sono infrequenti e possono essere difficili da svelare sulla base dei soli risultati dei gas arterialblood.
Sommario
Il mantenimento del normale pH del sangue coinvolge diversi sistemi di organie dipende dall’integrità circolatoria. Non è sorprendente thenthat disturbo di equilibrio acido-base può complicare il corso ofwidely diverse malattie così come trauma a molte parti del corpo. Il corpo ha un notevole potere di preservare il pH del sangue, ele perturbazioni di solito implicano una grave malattia cronica o una malattia acuta.
I risultati dell’analisi dei gas del sangue arterioso possonoidentificare il disturbo acido–base e fornire informazioni preziose comeper la sua causa.
Alcuni hanno suggerito di leggere ulteriormente
- Thomson WST, Adams JF, Cowan RA. Equilibrio acido-base clinico. Oxford: Oxford Medical Publications 1997
- Harrison RA. Equilibrio acido-base. Respir Care Clin N. America 1995; 1,1: 7-21
- Woodrow P. Analisi dei gas del sangue arterioso. Nursing Standard 2004; 18,21: 45-52
- Sirker AA, Rhodes A, Gounds RM, Bennet ED. Fisiologia acido-base: l’approccio “tradizionale” e quello “moderno”. Anestesia 2002; 57: 348-56