Plasticità muscolare
Il muscolo scheletrico è il tessuto più grande del corpo. È altamente plastico e può subire drammatiche oscillazioni non patologiche sia in massa che in forza in risposta a una miriade di influenze ambientali. Dopo l’esercizio di resistenza o l’esposizione agli steroidi anabolizzanti, i muscoli subiscono ipertrofia e aumentano la massa, l’area della sezione trasversale e la forza (Aagaard, 2004; Schiaffino et al., 2013). Questi stessi parametri possono declinare precipitosamente quando i muscoli iniziano l’atrofia in risposta a qualsiasi gamma di insulti che includono: fame, denervazione, immobilizzazione, sepsi, cachessia da cancro, insufficienza cardiaca, diabete, insufficienza renale, disturbo polmonare ostruttivo cronico e sindrome da immunodeficienza acquisita (Schiaffino et al., 2013).
Le conseguenze dell’atrofia hanno evidenti implicazioni per la salute. La debolezza muscolare è un importante contributo sia alla mortalità che alla morbilità ed è associata all’aumento del rischio di tutte le cause di morte (Metter et al., 2002). Infatti, ridurre l’atrofia muscolare nella cachessia del cancro può prolungare significativamente la vita (Zhou et al., 2010). Inoltre, molti individui più anziani soffrono di sarcopenia, un disturbo di deperimento muscolare protratto che in genere inizia dopo i 50 anni e comporta una perdita di circa l ‘ 1% della massa muscolare all’anno (Woo, 2017). Ciò significa che all’età di 80 anni, gli individui sarcopenici hanno perso circa il 40% della loro massa muscolare, un fattore chiave nelle cadute, fragilità e ricoveri in casa di cura. Di conseguenza, la comprensione dei meccanismi e delle potenziali risposte terapeutiche all’atrofia è di ampio interesse di base e clinico (Ali e Garcia, 2014; Cohen et al., 2015; Ziaaldini et al., 2017).
Ipotesi del dominio mionucleare
Il muscolo scheletrico è abbastanza unico in quanto le cellule mature sono sinciziali e possono contenere centinaia di nuclei. Questo è un adattamento necessario dato che le singole fibre muscolari possono essere enormi, raggiungendo lunghezze fino a ~600 mm (23 pollici) (ad esempio sartorius muscle; Yang et al., 1998) e volumi che possono essere più di 100.000 volte maggiori di una tipica cellula mononucleata (Bruusgaard et al., 2003). I contributi di più nuclei sono necessari per produrre grandi quantità di mRNA necessari per dirigere la prodigiosa sintesi proteica necessaria per generare e mantenere l’apparato contrattile (Nevalainen et al., 2013).
Sia la natura plastica del muscolo che la sua organizzazione sinciziale hanno dato origine a una controversia che solo di recente sembra essere stata risolta—l ‘ “ipotesi del dominio mionucleare” (Qaisar e Larsson, 2014; Gundersen, 2016; Schwartz et al., 2016). Questa teoria ha le sue origini nel concetto di “Wirkungssphäre” o “sfera di influenza” proposto da Strassburger (1893), in cui sosteneva che un nucleo può supportare solo un volume discreto di citoplasma, definendo così i limiti superiori alle dimensioni delle cellule. Questo principio è stato ulteriormente elaborato da Gregory (2001) che ha sostenuto che il contenuto e il volume di acido desossiribonucleico cellulare sono strettamente accoppiati. La natura sinciziale del muscolo scheletrico aiuta queste cellule a superare questa limitazione. L’ipotesi del dominio mionucleare impone che per mantenere il corretto rapporto nucleare-citoplasmatico, nuovi nuclei vengono aggiunti durante l’ipertrofia e persi con atrofia.
Ci sono dati sostanziali che dimostrano che il numero nucleare aumenta con l’ipertrofia muscolare (Moss, 1968; Cabric e James, 1983; Eger et al., 2016), anche se rimane qualche controversia (Murach et al., 2018). Questo processo è stato un’area di intensa indagine e alcuni dei meccanismi molecolari sottostanti che regolano l’acquisizione di nuovi nuclei durante l’ipertrofia sono stati definiti di recente (Guerci et al., 2012; Bentzinger et al., 2014; Ross et al., 2018). Questi nuclei soprannumerari vengono acquisiti quando le cellule staminali limitate al lignaggio, in genere cellule satelliti, si fondono con le fibre muscolari e contribuiscono ai loro nuclei (Brack e Rando, 2012; Bachman et al., 2018). Le cellule satelliti risiedono sotto la membrana basale e si appoggiano al sarcolemma (Katz, 1961; Mauro, 1961). Rimangono quiescenti fino a quando non vengono stimolati da steroidi anabolizzanti come il testosterone o da lesioni focali dopo l’esercizio di resistenza, a quel punto rientrano nel ciclo cellulare e proliferano (Joubert e Tobin, 1995; Abreu et al., 2017). Alcune delle cellule figlie si fondono con la fibra muscolare e facilitano sia la riparazione che la crescita, mentre altre arrestano e ricostituiscono la piscina satellitare (Dumont et al., 2015; Goh e Millay, 2017). Le restanti cellule in eccesso subiscono apoptosi (Schwartz, 2008).
L’aspetto controverso dell’ipotesi del dominio mionucleare è la tesi che i mionuclei siano persi durante l’atrofia. Ci sono molti interventi che inducono atrofia nei modelli animali, tra cui: immobilizzazione, denervazione e sepsi (Fitts et al., 1986; Minnaard et al., 2005; O’Leary et al., 2012). In ogni caso, vi è una perdita netta sia dell’area della sezione trasversale muscolare (il test primario) che della comparsa di cellule apoptotiche all’interno del tessuto (McCall et al., 1998; Smith et al., 2000; Strasser et al., 2000; Alway et al., 2003; McClung et al., 2007; Andrianjafiniony et al., 2010; Guo et al., 2012; Palumbo et al., 2012; Barnes et al., 2015; Cheema et al., 2015; Li et al., 2016; Kletzien et al., 2018). In questi studi, l’apoptosi viene misurata in una varietà di metodi, tra cui l’attivazione della caspasi, il rilascio di EndoG mitocondriale o la frammentazione del DNA . Questi studi forniscono dati convincenti che l’apoptosi aumenta drammaticamente durante la fase iniziale di atrofia. Ad esempio, in un recente studio completo (Guo et al., 2012), Guo et al. topi sottoposti a 14 giorni di sospensione dell’arto posteriore, un trattamento che ha comportato una riduzione del 69% del peso bagnato muscolare e una riduzione del 43,8% dell’area della sezione trasversale rispetto al muscolo controlaterale non manipolato. Gli autori hanno anche quantificato un numero di marcatori di apoptosi, tra cui la colorazione di TUNEL, la scissione/attivazione della caspasi-3 e la scissione della poli(adenosina difosfato ribosio) polimerasi (PARP), una proteina coinvolta nella riparazione del DNA. Ciascuna di queste misure di apoptosi è aumentata in modo significativo dopo la sospensione dell’arto posteriore. Mentre l’obiettivo principale di questo articolo era valutare l’impatto positivo della stimolazione elettrica sulla limitazione dell’atrofia a seguito di un insulto, loro e molti altri ricercatori interpretano questo tipo di dati come un forte supporto per l’ipotesi del dominio mionucleare.
Da una prospettiva biologica cellulare, la perdita presuntiva di nuclei all’interno di un tessuto sinciziale come il muscolo scheletrico presenta un grave problema pratico. Come può un singolo nucleo diventare così compromesso che il suo genoma si condensa e si frammenta rapidamente mentre i suoi vicini persistono e aiutano a mantenere la vitalità della fibra muscolare? Dato che l’apoptosi è tipicamente mediata dall’attivazione della classe delle proteasi della cisteina note come caspasi, non è chiaro quale meccanismo possa servire a limitare l’attività di una proteasi diffusibile all’interno di un citoplasma comune.
Questa domanda è stata affrontata indirettamente in un altro tipo di cellula sinciziale, il sincitiotrofoblasto umano, un tessuto che circonda la placenta e contiene circa 5 × 1010 nuclei (Mayhew et al., 1999). Quando l’apoptosi è indotta nel sincitiotrofoblasto, si propaga come un’onda ad una velocità di circa 5 micron al minuto fino a quando l’intero tessuto è coinvolto (Longtine et al., 2012). Di conseguenza, non ci sono regioni “privilegiate” all’interno del citoplasma sinciziale e tutti i nuclei vengono infine distrutti.
Una delle sfide chiave con l’analisi dell’apoptosi nel muscolo scheletrico è che si tratta di un tessuto molto eterogeneo, in cui circa la metà dei suoi nuclei risiede al di fuori delle fibre muscolari (Schmalbruch e Hellhammer, 1977). Queste cellule mononucleate includono cellule satelliti, cellule endoteliali, fibroblasti, periciti e macrofagi (Tedesco et al., 2010). Di conseguenza, è molto difficile determinare quale lato del sarcolemma, un nucleo risiede, e quindi se è un vero mionucleo.
Imaging Time-lapse in vivo di fibre muscolari di topo marcate
Nonostante il gran numero di documenti che dimostrano l’apoptosi durante l’atrofia muscolare, diversi autori hanno messo in discussione questi risultati (Wada et al., 2002; Zhong et al., 2005; Aravamudan et al., 2006; Gundersen e Bruusgaard, 2008; Duddy et al., 2011; Qaisar e Larsson, 2014). Ad esempio, utilizzando fibre muscolari isolate in vitro, Duddy et al. notato che mentre il volume delle fibre muscolari diminuiva nel tempo, riflettendo un processo atrofico, il numero di mionuclei sembrava essere stabile (Duddy et al., 2011).
In una serie di esperimenti eleganti, il laboratorio di Gundersen ha iniettato fibre muscolari individuali di estensore digitorum longus (EDL) o muscoli solei con coloranti che etichettavano indipendentemente i nuclei e il citoplasma nei topi anestetizzati (Bruusgaard e Gundersen, 2008; Bruusgaard et al., 2010). Ciò ha permesso loro di identificare ciascun nucleo all’interno delle singole fibre muscolari in vivo nel tempo e quindi valutare il suo destino. Ad esempio, i muscoli EDL sono stati indotti all’ipertrofia dall’ablazione dei loro principali sinergizzanti (Bruusgaard et al., 2010). Tra i giorni 6 e 11, il numero di mionuclei è aumentato di circa il 54% e tra i giorni 9 e 14 c’è stato un aumento del 35% dell’area della sezione trasversale (Figura 1). Questi dati sono coerenti con l’ipotesi che i muscoli acquisiscano nuclei soprannumerari prima della maggiore crescita della fibra durante l’ipertrofia.

Figura 1. I mionuclei vengono acquisiti durante l’ipertrofia ma non persi durante l’atrofia nel topo. Micrografie della stessa fibra muscolare EDL nel tempo a seguito dell’induzione dell’ipertrofia (riga superiore) e della successiva induzione dell’atrofia (riga inferiore). Oligonucleotidi fluorescenti etichettati sono stati usati per visualizzare i nuclei in vivo. Le linee tratteggiate rappresentano il sarcolemma. Scala bar = 50 µm. (Adattato da Bruusgaard et al., 2010. Utilizzato con il permesso degli Atti della National Academy of Sciences.)
Hanno quindi esaminato il destino di questi mionuclei univocamente identificabili nelle stesse fibre muscolari quando sono stati indotti a subire atrofia. La denervazione ha portato a una riduzione di circa il 50% del volume delle fibre muscolari, ma nessuna perdita di mionuclei (Figura 1; Bruusgaard et al., 2010). La mancata osservazione della perdita nucleare non era dovuta allo stimolo atrofico impiegato poiché hanno ottenuto gli stessi risultati quando i muscoli sono stati indotti ad atrofizzarsi in risposta al blocco nervoso indotto dalla tetrodotossina, alla sospensione degli arti posteriori, alla cachessia del cancro o al detraining (Bruusgaard e Gundersen, 2008; Bruusgaard et al., 2010; Winje et al., 2018a). Infatti, nel corso dei loro studi, hanno esaminato più di 200.000 singoli mionuclei nei muscoli atrofici e hanno osservato solo 4 nuclei TUNEL-positivi (apoptotici), che rappresentano una perdita di solo ~0,002% dei nuclei (Bruusgaard et al., 2012). Questi dati supportano fortemente l’ipotesi che l’atrofia muscolare scheletrica non sia accompagnata da morte mionucleare.
Muscolo insetto come modello
Per quanto potenti siano questi studi, ci sono alcune limitazioni inerenti all’uso di modelli di mammiferi. In primo luogo, invariabilmente si basano su interventi sperimentali come la denervazione per indurre atrofia muscolare. In secondo luogo, il muscolo controlaterale viene tipicamente utilizzato come controllo interno anche se è esposto ad alcuni degli stessi segnali ambientali, come gli ormoni dello stress (Bonaldo e Sandri, 2013). Infine, i muscoli scheletrici possono anche subire la morte cellulare programmata (PCD) durante lo sviluppo e questi modelli affrontano raramente il ruolo dell’apoptosi in queste cellule.
Un modello alternativo che non soffre di nessuna di queste limitazioni e consente lo studio dei nuclei muscolari sia durante l’atrofia che durante la PCD naturale, è il muscolo intersegmentale (ISM) del tabacco hawkmoth Manduca sexta. Gli ISMI sono composti da fogli di fibre muscolari giganti, in cui ogni cellula è lunga circa 5 mm e fino a 1 mm di diametro (Figura 2A). Gli ISMI si attaccano ai confini segmentali all’interno dell’addome e generano sia il comportamento strisciante delle larve che il comportamento eclosion (emergenza) della falena adulta quando sfugge dalla cuticola pupale alla fine della metamorfosi.
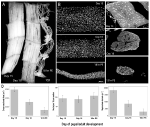
Figura 2. Ritenzione di mionuclei durante l’atrofia e la morte dei muscoli intersegmentali (ISMI) dalla falena Manduca sexta. (A) ISMi da tre fasi di sviluppo: omeostatico (giorni 15 di sviluppo pupale-adulto; a sinistra); atrofico (giorno 18; medio); e morire (18 h post-eclosione; destra). La barra di scala è uguale a ~1 mm (adattato da Schwartz et al., 2016). (B) Gli ISMI di queste stesse fasi di sviluppo sono stati ripuliti e colorati con il colorante nucleare DAPI e visualizzati tramite microscopia confocale (adattato da Schwartz et al., 2016). (C) Sezioni di fibre ISM (10 µm) sono state colorate con il colorante nucleare DAPI. Si noti la drammatica perdita di proteine muscolari (zona grigia chiara) durante l’atrofia e la morte, ma la ritenzione dei nuclei in tutte le fasi (adattato da Schwartz et al., 2016). (D) Quantificazione del volume della fibra ISM (a sinistra), del numero nucleare (al centro) e della dimensione del dominio mionucleare (a destra) durante l’omeostasi, l’atrofia e la morte. (Errore medio ± standard.) (Adattato da Schwartz et al., 2016).
Il giorno 15 dei normali 18 giorni di sviluppo pupale-adulto, gli ISM iniziano un programma di atrofia attivato ormonalmente che si traduce in una perdita di massa del 40% al momento dell’eclosione 3 giorni dopo (Figura 2A; Schwartz e Truman, 1983). Questa drammatica perdita di massa muscolare è equivalente a quella osservata in individui di 80 anni con sarcopenia, ma si svolge in 3 giorni piuttosto che in 30 anni. Mentre gli ISM perdono massa, mantengono normali proprietà fisiologiche come il potenziale di riposo e l’area forza/sezione trasversale (Schwartz e Ruff, 2002). Gli ISM sono utilizzati per generare il comportamento eclosion alla fine del giorno 18 e quindi avviare PCD, entrambi i quali sono innescati da un ormone peptidico (Schwartz e Truman, 1982, 1983). .
In contrasto con i muscoli dei mammiferi, gli ISMI non contengono capillari, cellule satelliti, cellule endoteliali o periciti, il che significa che praticamente tutti i nuclei nel tessuto risiedono all’interno delle fibre muscolari stesse (Beaulaton e Lockshin, 1977). Abbiamo usato due metodi indipendenti per monitorare il destino nucleare durante l’atrofia e la morte in questo modello (Schwartz et al., 2016). Il primo era un approccio anatomico standard. Quando gli ISMI subiscono atrofia e morte, ci sono drastiche riduzioni sia del volume che dell’area della sezione trasversale delle fibre, ma grossolanamente, il numero nucleare è rimasto invariato (Figura 2B). Utilizzando tessuti sezionati per studi quantitativi, abbiamo scoperto che c’era una riduzione del 49% nell’area della sezione trasversale delle fibre durante l’atrofia e un ulteriore declino del 30% durante le prime fasi della morte (Figure 2C,D; Schwartz et al., 2016). Tuttavia, il numero di nuclei non è cambiato durante questo stesso periodo, il che significa che c’è stata funzionalmente una riduzione dell ‘ 84% nel dominio mionucleare.
Il secondo metodo che abbiamo impiegato è stato quello di misurare il contenuto di DNA delle singole fibre muscolari degli animali il giorno 13, quando i muscoli sono omeostatici, fino a 18 h post-eclosione, quando i muscoli sono altamente degenerati (Schwartz et al., 2016). Abbiamo quantificato il contenuto di DNA di 420 singole cellule e abbiamo scoperto che non vi era alcuna perdita significativa durante lo sviluppo. Queste analisi biochimiche concordano bene con i dati anatomici e suggeriscono che la concentrazione relativa di entrambi i nuclei e DNA genomico funzionalmente aumentato come i muscoli atrofizzati e morti. Di conseguenza, i dati di topi e falene suggeriscono che i nuclei muscolari non subiscono apoptosi durante l’atrofia (o PCD) e portano alla conclusione che l’ipotesi del dominio mionucleare dovrebbe essere respinta.
Conclusioni
Queste osservazioni hanno una serie di implicazioni sia per la comprensione della biologia di base del muscolo che per lo sviluppo di potenziali interventi terapeutici. Mentre ci sono dati sostanziali che riportano la presenza di nuclei apoptotici all’interno del tessuto a seguito di insulti atrofici, dati recenti suggeriscono che questi non sono veri mionuclei, ma piuttosto, cellule mononucleate condannate che risiedono al di fuori della fibra muscolare. La ragione principale di questa discrepanza è che gli strumenti tradizionali utilizzati per rilevare l’apoptosi mancano della risoluzione necessaria per determinare adeguatamente quale lato del sarcolemma risiede una cellula morente. Metodi che etichettano specificamente i mionuclei, tramite iniezioni in vivo di coloranti fluorescenti (Bruusgaard e Gundersen, 2008) o tramite manipolazioni genetiche per esprimere proteine marker (Duddy et al., 2011), rivelano pochi se nessun nucleo apoptotico all’interno delle fibre etichettate. La recente dimostrazione che gli anticorpi diretti contro la proteina pericentriolare materiale 1 (PCM1) etichetta solo autentico myonuclei offre uno strumento promettente che può essere applicato ai materiali istologici tradizionali che vengono abitualmente analizzati sul campo (Winje et al., 2018b).
L’incapacità dei muscoli scheletrici di impiegare l’apoptosi come meccanismo per eliminare i mionuclei non è sorprendente. Sembra che il muscolo scheletrico maturo sia in gran parte precluso dall’avvio dell’apoptosi in quanto sovraregola l’espressione di potenti proteine di sopravvivenza come l’inibitore X-linked della proteina apoptosi (XIAP) (Smith et al., 2009) e apoptosis repressor con caspase recruitment domain (ARC) (Xiao et al., 2011), mentre esprime simultaneamente bassi livelli di mediatori di apoptosi come il fattore di attivazione della proteasi apoptotica 1 (Apaf-1) (Burgess et al., 1999). Questo ha senso teleologicamente poiché i muscoli sono soggetti a perturbazioni estreme, tra cui la rottura del sarcolemma dopo un intenso esercizio fisico, quindi sarebbe catastrofico se innescassero la morte cellulare piuttosto che iniziare la riparazione dei tessuti e possibilmente l’ipertrofia. Come altre cellule terminali differenziate, i muscoli tendono ad impiegare meccanismi non apoptotici, in particolare il PCD autofagico (noto anche come degenerazione di tipo II) (Clarke, 1990; Schwartz et al., 1993; Kole et al., 2013; Ginet et al., 2014) quando muoiono durante lo sviluppo.
Anche se esistesse un meccanismo attraverso il quale i muscoli potrebbero mirare selettivamente ai singoli nuclei, non è chiaro che ciò sarebbe vantaggioso. Infatti, la ritenzione di nuclei “in eccesso” durante l’atrofia conferisce un netto vantaggio per l’individuo poiché i muscoli scheletrici subiscono frequentemente cicli di atrofia e ipertrofia in risposta a condizioni ambientali come la disponibilità di cibo. La capacità di recuperare rapidamente utilizzando mionuclei preesistenti può servire un ruolo importante nell’adattamento (Jackson et al., 2012) e aiutare a spiegare il fenomeno della “memoria muscolare” (Staron et al., 1991; Gundersen, 2016). È ben documentato nel campo della fisiologia dell’esercizio che è molto più facile riacquistare un certo livello di forma fisica muscolare attraverso l’esercizio piuttosto che raggiungerlo in primo luogo, anche se c’è stato un lungo periodo di detraining. In altre parole, la frase “usalo o perdilo” potrebbe essere articolata in modo più accurato come” usalo o perdilo, finché non ci lavori di nuovo.”Questo è stato dimostrato direttamente da un altro esperimento del Gundersen lab che ha dimostrato che una volta che un muscolo ha acquisito nuovi nuclei, li trattiene molto tempo dopo che lo stimolo ipertrofico è stato rimosso. Hanno indotto l’ipertrofia muscolare nei topi femminili trattandoli per 2 settimane con testosterone e poi hanno esaminato i muscoli 3 settimane dopo il ritiro degli steroidi (Eger et al., 2013). Il volume muscolare era tornato alla linea di base, ma i nuclei appena acquisiti persistevano anche 3 mesi dopo. Quando i muscoli sono stati sottoposti a sovraccarico per reinizializzare l’ipertrofia, quelli trattati con steroidi hanno subito rapidamente un aumento del 36% nel volume delle fibre mentre i muscoli di controllo sono cresciuti solo del 6%. Questi dati suggeriscono che i nuclei” eccedenti ” potrebbero essere mobilitati rapidamente per facilitare la riqualificazione.
Queste osservazioni hanno potenziali implicazioni per la politica di sanità pubblica. È stato dimostrato che la crescita muscolare, la funzione fisiologica e la capacità rigenerativa diminuiscono con l’età, in gran parte a causa della ridotta proliferazione delle cellule satellitari (Blau et al., 2015). Di conseguenza, l’esercizio durante l’adolescenza, quando la crescita muscolare è potenziata da ormoni, nutrizione e un robusto pool satellitare, potrebbe servire funzionalmente a consentire agli individui di “bank” myonuclei che potrebbero essere disegnati più tardi nella vita per rallentare gli effetti dell’invecchiamento e possibilmente prevenire la sarcopenia.
Inoltre, questi dati hanno implicazioni nel settore degli sport competitivi. L’uso di steroidi anabolizzanti è un potente stimolo per l’ipertrofia muscolare e l’aggiunta di nuovi mionuclei (Eger et al., 2013). Dal momento che questi nuclei persistono molto tempo dopo l’uso di steroidi finisce, gli atleti probabilmente derivano i benefici dell’uso illegale di droghe senza il rischio di rilevamento.
In sintesi, mentre l’aggiunta di nuovi nuclei con crescita muscolare è ampiamente accettata, la perdita apoptotica di nuclei con atrofia non può essere supportata, suggerendo che l’interpretazione rigorosa dell’ipotesi del dominio mionucleare non può essere supportata. Invece, sembra che una volta acquisito, i mionuclei persistano anche quando un muscolo diventa atrofico o avvia la morte cellulare.
Contributi dell’autore
L’autore conferma di essere l’unico contributore di questo lavoro e lo ha approvato per la pubblicazione.
Finanziamento
Il lavoro per questa pubblicazione è stato sostenuto da fondi della Eugene M. e Ronnie Isenberg Professorship Endowment. Nessun supporto aziendale è stato fornito all’autore e nessun prodotto commerciale è menzionato o approvato.
Dichiarazione sul conflitto di interessi
L’autore dichiara che la ricerca è stata condotta in assenza di rapporti commerciali o finanziari che potrebbero essere interpretati come un potenziale conflitto di interessi.
Ringraziamenti
L’autore desidera ringraziare la signora Christine Brown per l’assistenza nella preparazione di questo manoscritto e la dotazione della cattedra Eugene M. e Ronnie Isenberg per il supporto.
Aagaard, P. (2004). Rendere i muscoli “più forti”: esercizio fisico, nutrizione, droghe. J. Musculoskelet. Neuronale. Interagire. 4, 165–174.
PubMed Abstract/Google Scholar
Abreu, P., Mendes, S. V., Ceccatto, V. M., e Hirabara, S. M. (2017). Attivazione delle cellule satellite indotta dall’adattamento muscolare aerobico in risposta all’esercizio di resistenza negli esseri umani e nei roditori. Sci vita. 170, 33–40. doi: 10.1016 / j. lfs.2016.11.016
PubMed Abstract | CrossRef Full Text/Google Scholar
Ali, S., e Garcia, JM (2014). Sarcopenia, cachessia e invecchiamento: diagnosi, meccanismi e opzioni terapeutiche—una mini-recensione. Gerontologia 60, 294-305. il nostro sito utilizza cookie tecnici e di terze parti per migliorare la tua esperienza di navigazione e per migliorare la tua esperienza di navigazione. (2003). Id2 expression during apoptosis and satellite cell activation in unloaded and loaded quail skeletal muscles. Am. J. Physiol. Regul. Integr. Comp. Physiol. 284, R540–R549. doi: 10.1152/ajpregu.00550.2002
PubMed Abstract | CrossRef Full Text | Google Scholar
Andrianjafiniony, T., Dupre-Aucouturier, S., Letexier, D., Couchoux, H., and Desplanches, D. (2010). Oxidative stress, apoptosis, and proteolysis in skeletal muscle repair after unloading. Am. J. Phys. Cell Physiol. 299, C307–C315. doi: 10.1152/ajpcell.00069.2010
PubMed Abstract | CrossRef Full Text/Google Scholar
Aravamudan, B., Mantilla, C. B., Zhan, W. Z., and Sieck, G. C. (2006). Effetti di denervazione sulla dimensione del dominio mionucleare delle fibre del diaframma del ratto. J. Appl. Physiol. 100, 1617–1622. doi: 10.1152 / japplphysiol.01277.2005
CrossRef Full Text/Google Scholar
Bachman, J. F., Klose, A., Liu, W., Paris, N. D., Blanc, RS, Schmalz, M., et al. (2018). La crescita del muscolo scheletrico prepuberale richiede un contributo mionucleare derivato dalle cellule satellitari che esprime Pax 7. Sviluppo 145: 167197.
Google Scholar
Barnes, BT, Confides, AL, Rich, MM e Dupont-Versteegden, EE (2015). Le vie apoptotiche del muscolo distinte sono attivate in muscoli con i tipi differenti della fibra in un modello del ratto della miopatia critica di malattia. J. Muscolo Res. Cellulare Motil. 36, 243–253. doi: 10.1007 / s10974-015-9410-8
PubMed Abstract | CrossRef Full Text/Google Scholar
Beaulaton, J., and Lockshin, R. A. (1977). Studio ultrastrutturale della normale degenerazione dei muscoli intersegmentali di Anthereae polyphemus e Manduca sexta (insecta, lepidoptera) con particolare riferimento all’autofagia cellulare. J. Morphol. 154, 39–57. doi: 10.1002 / jmor.1051540104
PubMed Abstract | CrossRef Full Text/Google Scholar
Bentzinger, CF, von Maltzahn, J., Dumont, N. A., Stark, D. A., Wang, Y. X., Nhan, K., et al. (2014). Wnt 7a stimola la motilità e l’attecchimento delle cellule staminali miogeniche con conseguente miglioramento della forza muscolare. J. Cell Biol. 205, 97–111. doi: 10.1083 / jcb.201310035
PubMed Abstract | CrossRef Full Text/Google Scholar
Blau, H. M., Cosgrove, B. D., e Ho, A. T. (2015). Il ruolo centrale delle cellule staminali muscolari nel fallimento rigenerativo con l’invecchiamento. NAT. Med. 21, 854–862. doi: 10.1038 / nm.3918
PubMed Abstract | CrossRef Full Text/Google Scholar
Bonaldo, P., and Sandri, M. (2013). Meccanismi cellulari e molecolari di atrofia muscolare. Dis. Modello. Mech. 6, 25–39. doi: 10.1242 / dmm.010389
CrossRef Full Text/Google Scholar
Brack, AS, and Rando, TA (2012). Cellule staminali tessuto-specifiche: lezioni dalla cellula satellite del muscolo scheletrico. Cellula staminale 10, 504-514. doi: 10.1016 / j.stelo.2012.04.001
PubMed Abstract | CrossRef Full Text/Google Scholar
Bruusgaard, J. C., Eger, I. M., Larsen, T. K., Dupre-Aucouturier, S., Desplanches, D., and Gundersen, K. (2012). Nessun cambiamento nel numero mionucleare durante lo scarico e la ricarica dei muscoli. J. Appl. Physiol. 113, 290–296. doi: 10.1152 / japplphysiol.00436.2012
PubMed Abstract / CrossRef Full Text/Google Scholar
Bruusgaard, JC, and Gundersen, K. (2008). La microscopia time-lapse in vivo non rivela alcuna perdita di mionuclei murino durante settimane di atrofia muscolare. J. Clin. Investire. 118, 1450–1457. doi: 10.1172/JCI34022
PubMed Abstract | CrossRef Full Text/Google Scholar
Bruusgaard, JC, Johansen, I. B., Eger, I. M., Rana, Z. A., and Gundersen, K. (2010). I mionuclei acquisiti dall’esercizio di sovraccarico precedono l’ipertrofia e non si perdono durante il detraining. Proc. Natl. Acad. Sic. U. S. A. 107, 15111-15116. doi: 10.1073 / pnas.0913935107
CrossRef Full Text / Google Scholar
Bruusgaard, JC, Liestol, K., Ekmark, M., Kollstad, K., e Gundersen, K. (2003). Numero e distribuzione spaziale dei nuclei nelle fibre muscolari di topi normali studiati in vivo. J. Physiol. 551, 467–478. doi: 10.1113 / jphysiol.2003.045328
PubMed Abstract | CrossRef Full Text/Google Scholar
Burgess, DH, Svensson, M., Dandrea, T., Gronlund, K., Hammarquist, F., Orrenius, S., et al. (1999). I citosol del muscolo scheletrico umano sono refrattari all’attivazione del citocromo c-dipendente delle caspasi di tipo II e mancano di APAF-1. La morte cellulare è diversa. 6, 256–261. doi: 10.1038 / sj.cdd.4400489
PubMed Abstract | CrossRef Full Text/Google Scholar
Cabric, M., and James, NT (1983). Analisi morfometriche sui muscoli di cani allenati e non allenati. Essere. J. Anat. 166, 359–368. doi: 10.1002 / aja.1001660309
PubMed Abstract | CrossRef Full Text/Google Scholar
Cheema, N., Herbst, A., McKenzie, D., and Aiken, JM (2015). L’apoptosi e la necrosi mediano la perdita di fibre muscolari scheletriche in anomalie enzimatiche mitocondriali indotte dall’età. Cella di invecchiamento 14, 1085-1093. doi: 10.1111 / acel.12399
PubMed Abstract | CrossRef Full Text/Google Scholar
Clarke, P. G. (1990). Morte cellulare evolutiva: diversità morfologica e meccanismi multipli. Anat. Embriolo. 181, 195–213.
Google Scholar
Cohen, S., Nathan, J. A. e Goldberg, A. L. (2015). Deperimento muscolare nella malattia: meccanismi molecolari e terapie promettenti. NAT. Rev. Droga Discov. 14, 58–74. doi: 10.1038/nrd4467
PubMed Abstract | CrossRef Full Text/Google Scholar
Duddy, WJ, Cohen, T., Duguez, S., and Partridge, TA (2011). La fibra muscolare isolata come modello di atrofia da disuso: caratterizzazione con PhAct, un metodo per quantificare la f-actina. Scad. Cella 317, 1979-1993. doi: 10.1016 / j. yexcr.2011.05.013
PubMed Abstract | CrossRef Full Text/Google Scholar
Dumont, NA, Wang, YX e Rudnicki, MA (2015). Meccanismi intrinseci ed estrinseci che regolano la funzione delle cellule satellite. Sviluppo 142, 1572-1581. doi: 10.1242 / dev.114223
PubMed Abstract | CrossRef Full Text/Google Scholar
Eger, I. M., Bruusgaard, J. C., Eftestol, E., and Gundersen, K. (2013). Un meccanismo di memoria cellulare aiuta l’ipertrofia di sovraccarico nel muscolo molto tempo dopo un’esposizione episodica agli steroidi anabolizzanti. J. Physiol. 591, 6221–6230. doi: 10.1113 / jphysiol.2013.264457
PubMed Abstract | CrossRef Full Text/Google Scholar
Eger, I. M., Bruusgaard, JC, and Gundersen, K. (2016). L’esaurimento delle cellule satellitari impedisce l’ipertrofia delle fibre nel muscolo scheletrico. Sviluppo 143, 2898-2906. doi: 10.1242 / dev.134411
PubMed Abstract / CrossRef Full Text/Google Scholar
Fitts, RH, Metzger, JM, Riley, D. A., and Unsworth, B. R. (1986). Modelli di disuso: un confronto tra sospensione dell’arto posteriore e immobilizzazione. J. Appl. Physiol. 60, 1946–1953.
Google Scholar
Ginet, V., Pittet, M. P., Rummel, C., Osterheld, M. C., Meuli, R., Clarke, P. G., et al. (2014). I neuroni morenti nel talamo di neonati e ratti a termine asfittici sono autofagici. Ann. Neurolo. 76, 695–711. doi: 10.1002 / ana.24257
PubMed Abstract | CrossRef Full Text/Google Scholar
Goh, Q., and Millay, D. P. (2017). Requisito della fusione delle cellule staminali mediata da miomaker per l’ipertrofia muscolare scheletrica. elife 6. doi: 10.7554 / eLife.20007
PubMed Abstract | CrossRef Full Text/Google Scholar
Gregory, T. R. (2001). Coincidenza, coevoluzione o causalità? Contenuto di DNA, dimensione delle cellule e l’enigma del valore C. Biol. Rev. Camb. Philo. Soc. 76, 65–101. doi: 10.1017 | s1464793100005595
PubMed Abstract/CrossRef Full Text/Google Scholar
Guerci, A., Lahute, C., Hebrard, S., Collard, L., Graindorge, D., Favier, M., et al. (2012). I segnali paracrini Srf-dipendenti prodotti dalle miofibre controllano l’ipertrofia muscolare scheletrica mediata dalle cellule satellitari. Metab cellulare. 15, 25–37. doi: 10.1016 / j. cmet.2011.12.001
PubMed Abstract | CrossRef Full Text/Google Scholar
Gundersen, K. (2016). Memoria muscolare e un nuovo modello cellulare per atrofia e ipertrofia muscolare. J. Scad. Biol. 219, 235–242. doi: 10.1242 / jeb.124495
PubMed Abstract | CrossRef Full Text/Google Scholar
Gundersen, K., and Bruusgaard, JC (2008). Domini nucleari durante l’atrofia muscolare: nuclei persi o paradigma perso? J. Physiol. 586, 2675–2681. doi: 10.1113 / jphysiol.2008.154369
PubMed Abstract | CrossRef Full Text/Google Scholar
Guo, BS, Cheung, KK, Yeung, SS, Zhang, BT, e Yeung, EW (2012). La stimolazione elettrica influenza la proliferazione delle cellule satellitari e l’apoptosi nell’atrofia muscolare indotta dallo scarico nei topi. PLoS Uno 7: e30348. doi: 10.1371 / giornale.pone.0053523
PubMed Abstract | CrossRef Full Text/Google Scholar
Jackson, J. R., Mula, J., Kirby, T. J., Fry, CS, Lee, J. D., Ubele, M. F., et al. (2012). L’esaurimento delle cellule satellite non inibisce la ricrescita del muscolo scheletrico adulto dopo atrofia indotta dallo scarico. Essere. J. Phys. Fisiolo cellulare. 303, C854-C861. doi: 10.1152 / ajpcell.00207.2012
PubMed Abstract | CrossRef Full Text/Google Scholar
Joubert, Y., and Tobin, C. (1995). I risultati del trattamento del testosterone nelle cellule satellite quiescenti che sono attivate e reclutate nel ciclo cellulare nel muscolo ani del levatore del ratto. Dev. Biol. 169, 286–294. doi: 10.1006 / dbio.1995.1144
PubMed Abstract | CrossRef Full Text/Google Scholar
Katz, B. (1961). Le terminazioni della fibra nervosa afferente nel fuso muscolare della rana. Philo. Trans. R. Soc. Lond. B Biol. Sic. 243, 221–240.
PubMed Abstract/Google Scholar
Kletzien, H., Hare, AJ, Leverson, G. e Connor, NP (2018). Effetto correlato all’età della morte cellulare sulla morfologia delle fibre e sul numero nel muscolo della lingua. Nervo muscolare 57, E29–E37. doi: 10.1002 / mus.25671
PubMed Abstract | CrossRef Full Text/Google Scholar
Kole, AJ, Annis, RP e Deshmukh, M. (2013). Neuroni maturi: attrezzati per la sopravvivenza. Morte cellulare Dis. 4: e689. doi: 10.1038 / cddis.2013.220
PubMed Abstract | CrossRef Full Text/Google Scholar
Li, TS, Shi, H., Wang, L. e Yan, C. (2016). Effetto delle cellule staminali mesenchimali del midollo osseo sulla proliferazione delle cellule satelliti e sull’apoptosi nell’atrofia muscolare indotta dall’immobilizzazione nei ratti. Med. Sic. Monit. 22, 4651–4660. doi: 10.12659 / MSM.898137
PubMed Abstract | CrossRef Full Text/Google Scholar
Lockshin, R. A., and Williams, C. M. (1965). Morte cellulare programmata – I. Citologia della degenerazione nei muscoli intersegmentali della seta Pernyi. J. Insetto Physiol. 11, 123–133. doi: 10.1016/0022-1910(65)90099-5 il sito utilizza cookie tecnici e di terze parti per migliorare la tua esperienza di navigazione. L’imaging a cellule vive mostra che l’apoptosi inizia localmente e si propaga come un’onda attraverso i sincitiotrofoblasti nelle colture primarie di trofoblasti villosi placentari umani. Placenta 33, 971-976. doi: 10.1016 / j.placenta.2012.09.013
PubMed Abstract | CrossRef Full Text/Google Scholar
Mauro, A. (1961). Cellula satellite delle fibre muscolari scheletriche. J. Biophys. Biochimica. Cytol. 9, 493–495.
Google Scholar
Mayhew, T. M., Leach, L., McGee, R., Ismail, W. W., Myklebust, R., e Lammiman, M. J. (1999). Proliferazione, differenziazione e apoptosi nel trofoblasto villoso a 13-41 settimane di gestazione (comprese osservazioni su lamelle annulate e complessi di pori nucleari). Placenta 20, 407-422. doi: 10.1053 / plac.1999.0399.il nostro sito utilizza cookie tecnici e di terze parti per migliorare la tua esperienza di navigazione. (1998). Mantenimento della dimensione del dominio mionucleare nel soleo di ratto dopo sovraccarico e trattamento con ormone della crescita/IGF-I. J. Appl. Physiol. 84, 1407–1412.il nostro sito utilizza cookie tecnici e di terze parti per migliorare la tua esperienza di navigazione. (2007). Caspasi-3 regolazione del dominio mionucleare del diaframma durante l’atrofia indotta dalla ventilazione meccanica. Essere. J. Respiro. Crit. Cura Med. 175, 150–159. doi: 10.1164 / rccm.200601-142OC
PubMed Abstract | CrossRef Full Text | Google Scholar
Metter, EJ, Talbot, LA, Schrager, M., e Conwit, R. (2002). Forza muscolare scheletrica come predittore della mortalità per tutte le cause negli uomini sani. J. Gerontol. Un Biol. Sic. Med. Sic. 57, B359-B365. doi: 10.1093/gerona / 57.10.B359
PubMed Abstract | CrossRef Full Text/Google Scholar
Minnaard, R., Drost, M. R., Wagenmakers, A. J., van Kranenburg, G. P., Kuipers, H., and Hesselink, M. K. (2005). Atrofia muscolare scheletrica e prestazioni contrattili nei ratti settici. Nervo muscolare 31, 339-348. doi: 10.1002 / mus.20268
PubMed Abstract / CrossRef Full Text / Google Scholar
Moss, F. P. (1968). La relazione tra le dimensioni delle fibre e il numero di nuclei durante la normale crescita del muscolo scheletrico negli uccelli domestici. Essere. J. Anat. 122, 555–563. doi: 10.1002 / aja.1001220308
PubMed Abstract | CrossRef Full Text/Google Scholar
Murach, K. A., Englund, DA, Dupont-Versteegden, E. E., McCarthy, JJ, e Peterson, CA (2018). La flessibilità del dominio mionucleare sfida le ipotesi rigide sul contributo delle cellule satelliti all’ipertrofia delle fibre muscolari scheletriche. Anteriore. Physiol. 9:635. doi: 10.3389 / fphys.2018.00635
CrossRef Full Text/Google Scholar
Nevalainen, M., Kaakinen, M. e Metsikko, K. (2013). Distribuzione di trascrizioni di mRNA e attività di traduzione in miofibre scheletriche. Tessuto cellulare Res. 353, 539-548. doi: 10.1007 / s00441-013-1659-per questo motivo, il progetto è stato pubblicato nel 2012, con il nome di “Google Scholar” (“Google Scholar”). Disfunzione mitocondriale indotta da denervazione e autofagia nel muscolo scheletrico di animali con deficit di apoptosi. Essere. J. Phys. Fisiolo cellulare. 303, C447–C454. doi: 10.1152/ajpcell.00451.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Palumbo, C., Rovesta, C., and Ferretti, M. (2012). Striated muscle fiber apoptosis after experimental tendon lesion in a rat model. J. Anat. 221, 358–363. doi: 10.1111/j.1469-7580.2012.01554.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Qaisar, R., and Larsson, L. (2014). What determines myonuclear domain size? Indian J. Physiol. Pharmacol. 58, 1–12.
PubMed Abstract | Google Scholar
Ross, J. A., Levy, Y., Svensson, K., Philp, A., Schenk, S., e Ochala, J. (2018). SIRT1 regola il numero nucleare e la dimensione del dominio nelle fibre muscolari scheletriche. J. Cell. Physiol. 233, 7157–7163. doi: 10.1002 / jcp.26542
PubMed Abstract | CrossRef Full Text/Google Scholar
Schiaffino, S., Dyar, K. A., Ciciliot, S., Blaauw, B., and Sandri, M. (2013). Meccanismi che regolano la crescita e l’atrofia del muscolo scheletrico. FEBS J. 280, 4294-4314. doi: 10.1111 / febs.12253
PubMed Abstract | CrossRef Full Text/Google Scholar
Schmalbruch, H., and Hellhammer, U. (1977). Il numero di nuclei nei muscoli di ratto adulti con particolare riferimento alle cellule satelliti. Anat. Rec. 189, 169–175. doi: 10.1002/ar.1091890204
PubMed Abstract | CrossRef Full Text/Google Scholar
Schwartz, L. M. (2008). Atrofia e morte cellulare programmata del muscolo scheletrico. La morte cellulare è diversa. 15, 1163–1169. doi: 10.1038 / cdd.2008.68
PubMed Abstract | CrossRef Full Text/Google Scholar
Schwartz, L. M., Brown, C., McLaughlin, K., Smith, W., e Bigelow, C. (2016). Il dominio mionucleare non viene mantenuto nel muscolo scheletrico durante l’atrofia o la morte cellulare programmata. Essere. J. Phys. Fisiolo cellulare. 311, C607-C615. doi: 10.1152 / ajpcell.00176.2016
PubMed Abstract | CrossRef Full Text/Google Scholar
Schwartz, L. M., and Ruff, R. L. (2002). Cambiamenti nelle proprietà contrattili del muscolo scheletrico durante l’atrofia e la morte programmate dallo sviluppo. Essere. J. Phys. Fisiolo cellulare. 282, C1270–C1277. doi: 10.1152 / ajpcell.01275.2000
CrossRef Full Text/Google Scholar
Schwartz, L. M., Smith, S. W., Jones, M. E., e Osborne, BA (1993). Tutte le morti cellulari programmate si verificano tramite apoptosi? Proc. Natl. Acad. Sic. USA 90, 980-984.
Google Scholar
Schwartz, LM, e Truman, JW (1983). Controllo ormonale dei tassi di sviluppo metamorfico nel tabacco hornworm Manduca sexta. Dev. Biol. 99, 103–114. doi: 10.1016/0012-1606(83)90257-9
PubMed Abstract / CrossRef Full Text / Google Scholar
Schwartz, LM, e Truman, JW (1982). Peptide e regolazione steroidea della degenerazione muscolare in un insetto. Scienza 215, 1420-1421. doi: 10.1126 / scienza.6278594
PubMed Abstract | CrossRef Full Text/Google Scholar
Smith, H. K., Maxwell, L., Martyn, J. A., and Bass, J. J. (2000). Frammentazione nucleare del DNA e alterazioni morfologiche nel muscolo scheletrico del coniglio adulto dopo immobilizzazione a breve termine. Tessuto cellulare Res. 302, 235-241. doi: 10.1007 | s004410000280
PubMed Abstract/CrossRef Full Text/Google Scholar
Smith, MI, Huang, YY e Deshmukh, M. (2009). La differenziazione del muscolo scheletrico evoca XIAP endogeno per limitare la via apoptotica. PLoS Uno 4:e5097. doi: 10.1371 / giornale.pone.0005097
CrossRef Full Text/Google Scholar
Staron, R. S., Leonardi, M. J., Karapondo, D. L., Malicky, E. S., Falkel, J. E., Hagerman, F. C., et al. (1991). Forza e adattamenti del muscolo scheletrico in donne addestrate alla resistenza pesante dopo il detraining e la riqualificazione. J. Appl. Physiol. 70, 631-640.
Google Scholar
Strassburger, E. (1893). La sfera d’azione dei nuclei e la dimensione delle cellule. Istol Beitr. 5, 97-124.
Google Scholar
Strasser, H., Tiefenthaler, M., Steinlechner, M., Eder, I., Bartsch, G., e Konwalinka, G. (2000). Apoptosi dipendente dall’età e perdita di cellule rabdosfintere. J. Urol. 164, 1781–1785. doi: 10.1016/S0022-5347 (05)67106-6
PubMed Abstract | CrossRef Full Text/Google Scholar
Tedesco, F. S., Dellavalle, A., Diaz-Manera, J., Messina, G., and Cossu, G. (2010). Riparazione del muscolo scheletrico: potenziale rigenerativo delle cellule staminali del muscolo scheletrico. J. Clin. Investire. 120, 11–19. doi: 10.1172/JCI40373
PubMed Abstract | CrossRef Full Text/Google Scholar
Wada, K. I., Takahashi, H., Katsuta, S., and Soya, H. (2002). Nessuna diminuzione del numero mionucleare dopo denervazione a lungo termine nei topi maturi. Essere. J. Phys. Fisiolo cellulare. 283, C484–C488. doi: 10.1152 / ajpcell.00025.2002
CrossRef Full Text/Google Scholar
Winje, I. M., Sheng, X., Hansson, K. A., Solbrå, A., Tennøe, S., Saatcioglu, F., et al. (2018a). Cachessia non induce perdita di myonuclei o fibre muscolari durante il cancro alla prostata xenografted nei topi. Acta Physiol. e13204. doi: 10.1111 / apha.13204
CrossRef Full Text/Google Scholar
Winje, I. M., Bengtsen, M., Eftestol, E., Juvkam, I., Bruusgaard, JC, e Gundersen, K. (2018b). Etichettatura specifica dei mionuclei da parte di un anticorpo contro il materiale pericentriolare 1 su sezioni di tessuto muscolare scheletrico. Acta Physiol. 223: e13034. doi: 10.1111 / apha.13034
CrossRef Full Text/Google Scholar
Woo, J. (2017). Sarcopenia. Clin. Geriatr. Med. 33, 305–314. doi: 10.1016 / j. cger.2010.02.012
CrossRef Full Text/Google Scholar
Xiao, R., Ferry, A. L., e Dupont-Versteegden, E. E. (2011). La resistenza alla morte cellulare dei miotubi differenziati è associata a meccanismi anti-apoptotici migliorati rispetto ai mioblasti. Apoptosi 16, 221-234. doi: 10.1007 / s10495-010-0566-9
PubMed Abstract | CrossRef Full Text/Google Scholar
Yang, D., Morris, S. F., and Sigurdson, L. (1998). Il muscolo sartorius: considerazioni anatomiche per i chirurghi ricostruttivi. Chirurgia radiologica. Anat. 20, 307–310. doi: 10.1007
PubMed Abstract | CrossRef Full Text/Google Scholar
Zhong, H., Roy, R. R., Siengthai, B., and Edgerton, V. R. (2005). Effetti dell’inattività sulle dimensioni delle fibre e sul numero mionucleare nel muscolo soleo di ratto. J. Appl. Physiol. 99, 1494–1499. doi: 10.1152 / japplphysiol.00394.2005
CrossRef Full Text/Google Scholar
Zhou, X., Wang, JL, Lu, J., Song, Y., Kwak, KS, Jiao, Q., et al. (2010). Inversione del cancro cachessia e atrofia muscolare da Act RIIB antagonismo porta alla sopravvivenza prolungata. Cella 142, 531-543. doi: 10.1016 / j.cella.2010.07.011
PubMed Abstract | CrossRef Full Text/Google Scholar
Ziaaldini, M. M., Marzetti, E., Picca, A., and Murlasits, Z. (2017). Percorsi biochimici della sarcopenia e loro modulazione mediante esercizio fisico: una rassegna narrativa. Anteriore. Med. 4:167. doi: 10.3389 / fmed.2017.00167
CrossRef Full Text / Google Scholar