Introduzione
L’isolamento elettrico delle vene polmonari (PV) è la pietra angolare delle strategie di ablazione del catetere per la fibrillazione atriale parossistica e persistente (AF). Le modalità energetiche attualmente disponibili come la radiofrequenza, la crioterapia e l’isolamento PV basato su laser (PVI) sono limitate da tassi di riconnessione PV a lungo termine che, nella migliore delle ipotesi, vanno dal 22% al 38%, 1,2 con altri studi che riportano tassi fino al 62,5%.3 Il riscaldamento dei tessuti (radiofrequenza) o il congelamento (crioterapia), i due approcci più comunemente usati, ablano il tessuto in modo indiscriminato senza distinguere i piani dei tessuti. Di conseguenza, queste fonti di energia sono associate a danni collaterali come il nervo frenico e la lesione esofagea, compresa la temuta fistola atriale-esofagea. Inoltre, l’ablazione del catetere può essere associata ad altre complicazioni come la stenosi PV, i pop di vapore e il rischio di ictus embolici.4,5 Queste limitazioni di sicurezza sono purtroppo aggravate dalla mancanza di transmuralità della lesione coerente, un meccanismo noto per la recidiva di AF.6 Così, c’è stato un bisogno pressante di una strategia ablativa che non solo è molto efficace, ma anche estremamente sicuro.
L’ablazione a campo pulsato (PFA) è una modalità di energia non termica che è stata utilizzata sia per l’elettrotrasferimento del gene che per l’ablazione del tumore dell’organo solido per molti anni.7,8 Più recentemente, i ricercatori hanno dimostrato un profilo di sicurezza unico e un’efficacia ablativa correlata alla sua capacità di mirare selettivamente ai cardiomiociti risparmiando il tessuto collaterale. Questo ha spinto PFA sotto i riflettori come una nuova fonte di energia per l’ablazione cardiaca.
Fondamenti di PFA
PFA è ampiamente basato sul concetto di ablazione in corrente continua che è stato usato brevemente negli anni 1980 prima della disponibilità di energia a radiofrequenza.4 In particolare, PFA prevede la rapida (sub-secondo) applicazione di impulsi elettrici intermittenti ad alta intensità per creare un campo elettrico attraverso il doppio strato lipidico della membrana cellulare per creare pori su scala nanometrica (elettroporazione) nella membrana cellulare (Figura 1). Il termine elettroporazione reversibile si riferisce alla formazione di pori non permanenti quando viene applicato un campo elettrico a bassa intensità che non supera la soglia del tessuto bersaglio. D’altra parte, l’elettroporazione irreversibile si riferisce alla creazione di pori permanenti quando il campo elettrico supera la soglia del tessuto bersaglio. Questi pori permanenti portano a perdite di contenuto cellulare, culminando nella morte cellulare (Figura 2). Forse la caratteristica più preziosa del PFA cardiaco è la sua selettività miocardica, conseguente ai cardiomiociti che hanno i valori di soglia del campo elettrico più bassi (400 V/cm) di tutti i tipi di tessuto.4,5
Figura 1
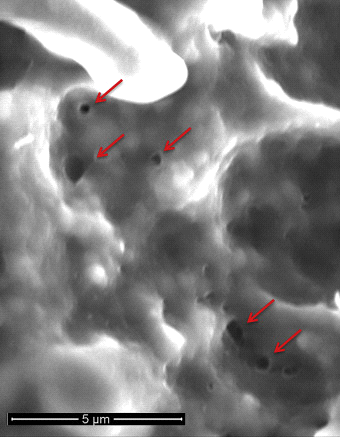
Figura 1

Figura 2
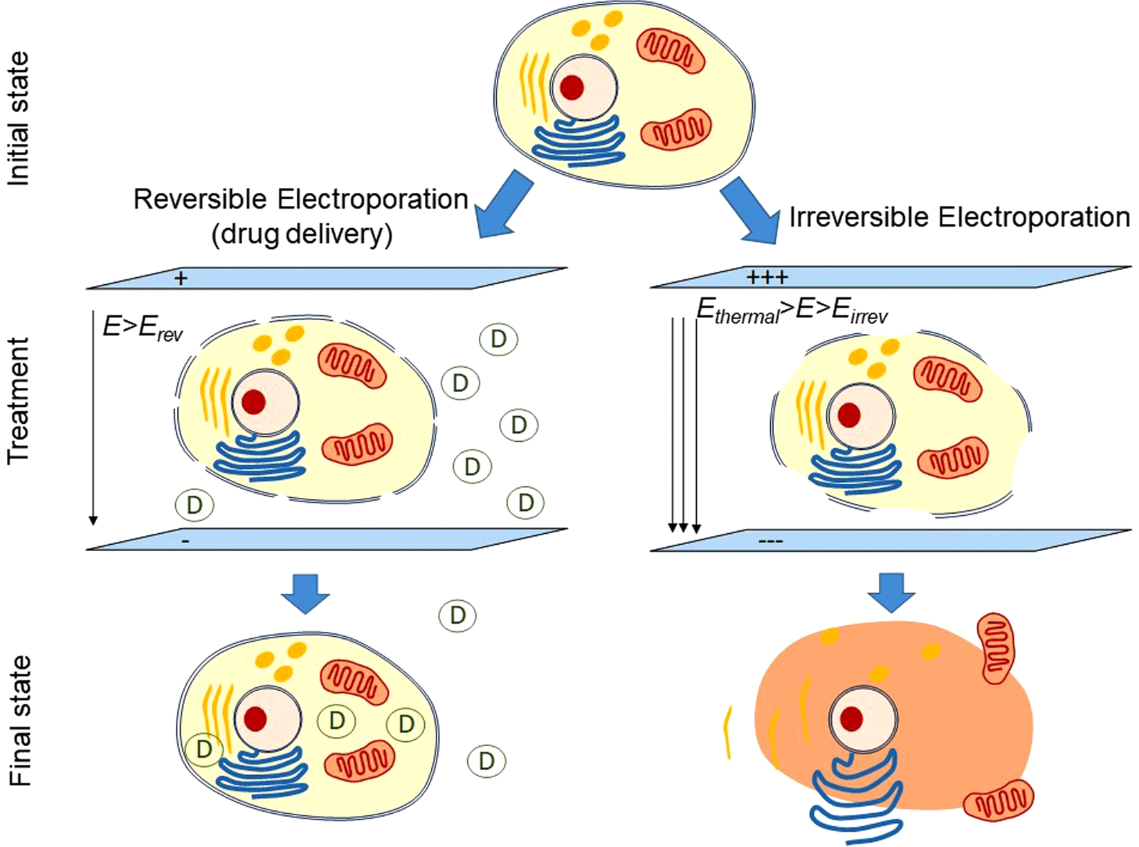
Figura 2

Tecnologia PFA
PFA è un termine che comprende uno spettro di caratteristiche di progettazione di impulsi e catetere. Queste caratteristiche sono strettamente legate al profilo di efficacia e sicurezza di PFA. Una caratteristica di PFA che ha un’implicazione significativa del flusso di lavoro clinico è la progettazione della forma d’onda. Le forme d’onda monofasiche in genere causano un’attivazione muscolare significativa, che impone l’uso dell’anestesia generale e della paralisi neuromuscolare. Al contrario, le forme d’onda bifasiche di PFA hanno dimostrato l’impegno limitato del muscolo scheletrico, permettendo che sia usato clinicamente senza l’esigenza dei paralitici.9
Dati preclinici
I dati preclinici di fattibilità sperimentale sulla PFA come terapia ablativa per il tessuto miocardico sono stati accumulati nell’ultimo decennio.Le lesioni di 4,10-14 PFA nel tessuto cardiaco sono caratteristicamente omogenee e risparmiano la matrice extracellulare all’interno dell’impalcatura del tessuto.4 Ciò contrasta con lesioni indiscriminate e dirompenti create con fonti di energia termica. Per quanto riguarda la PFA e il tessuto atriale, i ricercatori hanno dimostrato una manica miocardica completamente ablata con applicazioni monofasiche a 200 Joule in PV suina ostia senza significative cicatrici o proliferazione dell’intima e della lamina elastica.11 È importante sottolineare che, nonostante la creazione di lesioni all’interno del PV stesso, i diametri PV non sono stati influenzati,10,11 attestando PFAS unico meccanismo ablativo non stenotico. Nel tessuto ventricolare, la PFA ha dimostrato di creare grandi lesioni con risparmio della vascolarizzazione e dei nervi all’interno e adiacenti alla lesione.15 Inoltre, PFA ha dimostrato di risparmiare gli strati della mucosa esofagea e sub-mucosa nonostante l’applicazione deliberata di PFA sull’esofago.16,17 PFA ha anche dimostrato di non ferire il nervo frenico nonostante le molteplici applicazioni lungo il suo corso.18 Questi importanti risultati suggeriscono che il PFA ha un profilo di sicurezza unico che lo rende estremamente attraente per l’ablazione del tessuto atriale. Le valutazioni precliniche sopra menzionate sono state tutte eseguite con una forma d’onda monofasica PFA. Dati preclinici più recenti con nuove forme d’onda bifasiche PFA hanno dimostrato in modo incoraggiante di creare lesioni atriali contigue, omogenee e transmurali e di raggiungere endpoint rilevanti come l’isolamento PV durevole.19 È importante sottolineare che ogni forma d’onda PFA deve essere considerata un’entità unica e richiede una dettagliata valutazione preclinica della sicurezza e dell’efficacia.
Dati clinici
Reddy et al. sono stati i primi a descrivere l’esperienza clinica acuta iniziale con PFA sia endocardica che epicardica. Hanno condotto uno studio prospettico in aperto, non randomizzato della PFA in pazienti con AF.5 In questo studio, un catetere PFA multispline over-the-wire personalizzato (FARAWAVE) è stato utilizzato per fornire lesioni endocardiche all’antra PV in 15 pazienti. Questo catetere endocardico PFA ha 5 spline, ciascuna contenente 4 elettrodi, e può assumere una configurazione a fiore o a cesto. Questa progettazione tiene conto la copertura ostiale ed antrale circonferenziale di PV (figura 3). Inoltre, è stato utilizzato un catetere lineare PFA per ottenere l’isolamento combinato PVI e posteriore atriale sinistro (set di lesioni box) in 7 pazienti aggiuntivi durante la concomitante chirurgia cardiaca. Le forme d’onda monofasiche a tensione pulsata sono state consegnate in modo bipolare in questo studio; pertanto, tutte le procedure sono state eseguite in anestesia generale. Il PVI endocardico ha avuto un successo acuto in tutti i 15 pazienti (100%) con 3,26 ± 0,5 lesioni/PV e tempi di consegna dell’energia di <60 secondi per paziente. Le lesioni box sono riuscite a isolare la parete posteriore in 6 pazienti su 7 (86%). Il profilo di sicurezza acuto era eccellente senza complicazioni procedurali.
Figura 3
Figura 3
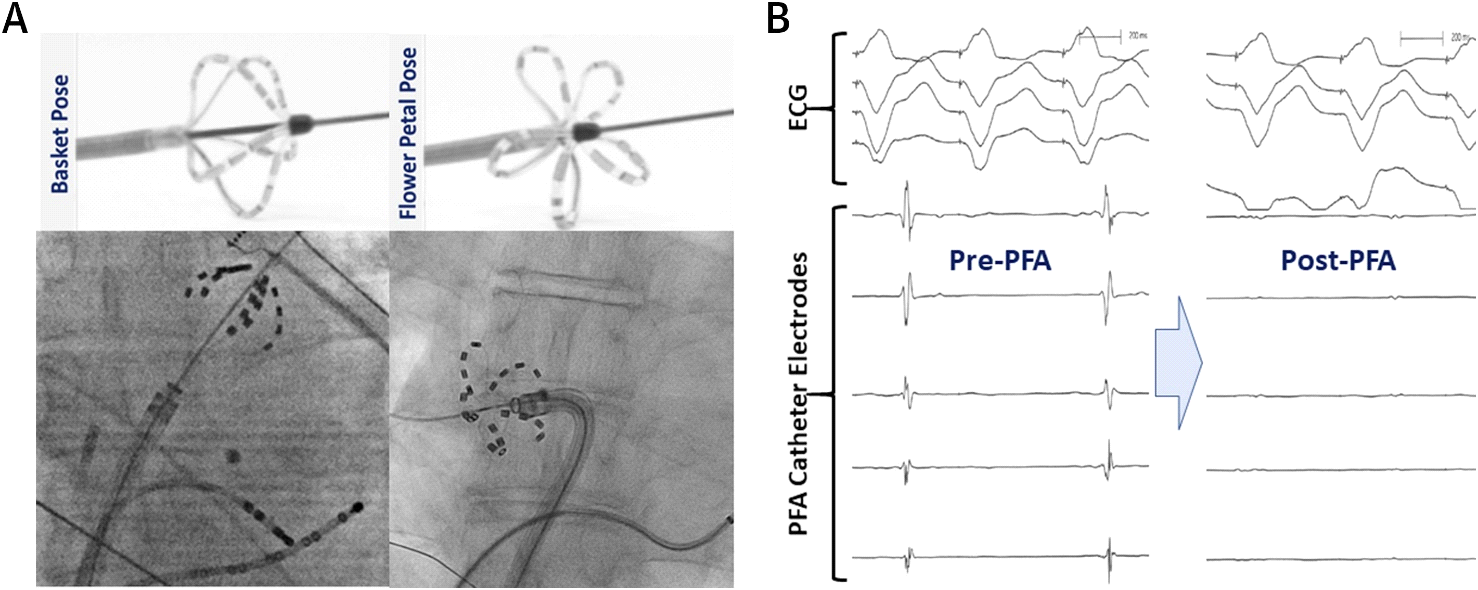
Successivamente, lo stesso gruppo ha recentemente pubblicato i dati combinati di due studi clinici non randomizzati di PFA basato su catetere in pazienti con AF parossistica.20 Insieme, questi studi hanno arruolato 81 pazienti con AF parossistica sintomatica resistente ai farmaci antiaritmici, con frazioni di eiezione ventricolare sinistra > 40% e con dimensione antero-posteriore atriale sinistra <5,5 cm. Gli impulsi PFA sono stati sincronizzati subito dopo l’inizio del QRS. Le forme d’onda bipolari PFA proprietarie sono state consegnate in modo monofasico (900-1000 V per applicazione; casi iniziali) o bifasico (1800-2000 V per applicazione; la maggior parte dei casi) utilizzando il catetere PFA endocardico (FARAWAVE). Il PVI acuto è stato raggiunto nel 100% dei pazienti. A causa della natura milliseconda degli impulsi, il tempo necessario per fornire energia non era superiore a 3 min / paziente con tempi di procedura pelle a pelle di 92,2 ± 27,4 min. La durata del PVI di tre mesi è aumentata progressivamente dal 18% con la forma d’onda monofasica iniziale al 100% con le forme d’onda bipolari più ottimizzate nell’ultima coorte in questo studio. La libertà stimata dall’aritmia a 12 mesi in questo studio è stata dell ‘ 87 ± 5,6%.
Dal punto di vista della sicurezza, è stato riportato un singolo tamponamento pericardico correlato alla procedura, ma non sono stati riportati altri eventi avversi nel periodo mediano di follow-up di 120 giorni. L’endoscopia è stata eseguita in 29 pazienti con una media di 3,4 giorni dopo l’ablazione e non ha rivelato alcuna evidenza di lesioni esofagee. Inoltre, 8 pazienti sono stati sottoposti a risonanza magnetica cardiovascolare a contrasto post-procedura in cui non è stato notato alcun miglioramento esofageo nonostante il miglioramento della parete atriale sinistra immediatamente adiacente. Questo supporta ulteriormente la mancanza di lesioni esofagee con PFA. Questa fonte di energia genera rapidamente risolvere micro bolle di gas subito dopo un impulso di consegna.21 In questa esperienza clinica non è stata osservata la possibilità teorica che queste bolle di gas ostruiscano il flusso sanguigno capillare causando ischemia d’organo e micro-emboli cerebrali.
Loh et al. ha anche studiato la fattibilità e la sicurezza dell’elettroporazione per PVI in una serie più piccola di 10 pazienti con AF parossistica o persistente utilizzando un catetere di ablazione circolare 14-polare personalizzato. Il PVI acuto è stato raggiunto in modo sicuro in 100% (40 PV) pazienti con un minimo di 2 applicazioni non ad arco 6 ms, 200 Joule per PV utilizzando una forma d’onda monofasica monopolare.22 I risultati di sicurezza e durabilità PVI di questa serie non sono ancora stati riportati.
In sintesi, PFA è in grado di isolare rapidamente il fotovoltaico con un eccellente profilo di sicurezza a breve termine e una lunga durata. Sebbene questo sia molto promettente, sono necessari studi più ampi con un follow-up più lungo.
Conclusione
PFA è una strategia ablativa non termica sorprendentemente promettente e innovativa che ha la capacità di superare alcune limitazioni delle moderne tecnologie di ablazione AF. I tempi di procedura brevi, la mancanza di lesioni collaterali e una migliore durata a lungo termine del PVI distinguono questa fonte di energia dagli altri. Il catetere di ablazione e il design degli impulsi hanno implicazioni sia di sicurezza che di efficacia. Questo deve essere tenuto a mente come nuove tecnologie PFA fanno la loro strada nel regno clinico.
- Hussein A, Das M, Riva S, et al. L’uso dell’ablazione guidata dall’indice di ablazione provoca alti tassi di isolamento della vena polmonare durevole e libertà dall’aritmia nei pazienti con fibrillazione atriale persistente. Circ Arrhythm Electrophysiol 2018;11: e006576.
- De Pooter J, Strisciuglio T, El Haddad M, et al. La riconnessione della vena polmonare non si verifica più nella maggior parte dei pazienti dopo una singola procedura di isolamento della vena polmonare. JACC Clin Electrophysiol 2019;5:295-305.
- Das M, Wynn GJ, Saeed Y, et al. Ri-isolamento della vena polmonare come strategia di routine indipendentemente dai sintomi: lo studio controllato randomizzato A PRESSIONE. JACC Clin Electrophysiol 2017;3:602-11.
- Wittkampf FHM, van Es R, Neven K. Elettroporazione e sua rilevanza per l’ablazione del catetere cardiaco. JACC Clin Electrophysiol 2018;4: 977-86.
- Reddy VY, Koruth J, Jais P, et al. Ablazione della Fibrillazione Atriale con campi elettrici pulsati: Modalità ultrarapida e selettiva tissutale per l’ablazione cardiaca. JACC Clin Electrophysiol 2018;4: 987-95.
- Darrat Y, Morales G, Di BL, Natale A, Elayi CS. Come ottenere un isolamento antrale della vena polmonare durevole? J Atr Fibrillazione 2014;6: 1039.
- Paiella S, Butturini G, Frigerio I, et al. Sicurezza e fattibilità dell’elettroporazione irreversibile (Irreversible) in pazienti con carcinoma pancreatico localmente avanzato: risultati di uno studio prospettico. Dig Surg 2015;32:90-7.
- Heller R, Heller LC. Gene electrotransfer studi clinici. Adv Genet 2015;89:235-62.
- Jais P, Takigawa M, Sacher F, et al. Confronto tra ablazione a campo pulsato bifasica e monofasica in un modello animale. J Cardiovasc Electrophysiol 2019;1-28 (abstr).
- Witt CM, Sugrue A, Padmanabhan D, et al. Ablazione della vena intrapolmonare senza stenosi: un nuovo approccio di elettroporazione a corrente continua basato su palloncino. J Am Cuore Assoc 2018;7: e009575.
- van Driel VJ, Neven KG, van Wessel H, et al. Stenosi venosa polmonare dopo ablazione con catetere: elettroporazione contro radiofrequenza. Circ Arrhythm Electrophysiol 2014;7: 734-8.
- Takigawa M, Vlachos K, Viswanathan R, et al. Risultati acuti della vena cava superiore e dell’isolamento della vena polmonare utilizzando l’ablazione del campo elettrico pulsato in un modello suino. Ritmo cardiaco 2018;15: S178 – 179 (abstr).
- Stewart MT, Haines DE, Verma A, et al. Ablazione in campo pulsato intracardiaco: prova di fattibilità in un modello suino cronico. Ritmo cardiaco 2019;16:754-64.
- Neven K, van Driel V, van Wessel H, van Es R, Doevendans PA, Wittkampf F. Dimensione della lesione miocardica dopo ablazione del catetere di elettroporazione epicardica dopo puntura subxifoidea. Circ Arrhythm Electrophysiol 2014;7: 728-33.
- Kuroki K, Koruth JS, Pare M, et al. Relazione iniziale dei risultati patologici dell’ablazione del campo pulsato endocardico nei suini. Cuore Rhyhtm 2019;16: S583.
- Neven K, van Es R, van Driel V, et al. Effetti acuti e a lungo termine dell’ablazione elettroporazione a piena potenza direttamente sull’esofago porcino. Circ Arrhythm Electrophysiol 2017;10: e004672.
- McElderry H, Walcott G, Viswanathan R, Long G, Sauter E, Mickelsen S. Sicurezza dell’ablazione del campo elettrico pulsato nell’applicazione diretta all’esofago suino. J Cardiovasc Electrophysiol 2018;29:657-78 (abstr).
- van Driel VJ, Neven K, van Wessel H, Vink A, Doevendans PA, Wittkampf FH. Bassa vulnerabilità del nervo frenico destro all’ablazione elettroporazione. Ritmo cardiaco 2015;12:1838-44.
- Kuroki K, Koruth J, Iwasawa J, et al. Isolamento della vena polmonare con ablazione a campo pulsato bifasico: Confronto preclinico con ablazione a radiofrequenza irrigata. J Cardiovasc Electrophysiol 2019;1-28 (abstr).
- Reddy VY, Neuzil P, Koruth JS, et al. Ablazione a campo pulsato per l’isolamento della vena polmonare nella fibrillazione atriale. J Am Coll Cardiol 2019;74: 315-26.
- van Es R, Groen MHA, Stehouwer M, Doevendans PA, Wittkampf FHM, Neven K. Analisi in vitro dell’origine e delle caratteristiche dei microemboli gassosi durante l’ablazione dell’elettroporazione del catetere. J Cardiovasc Electrophysiol 2019;30:2071-9.
- Loh P, van Es R, Groen MHA, et al. Isolamento della vena polmonare mediante elettroporazione irreversibile: prima esperienza umana. Ritmo cardiaco 2019;16:S579.
- Jourabchi N, Beroukhim K, Tafti BA, Kee ST, Lee EE. Elettroporazione irreversibile (NanoKnife) nel trattamento del cancro. Intervento gastrointestinale 2014; 3: 8-18.
- López-Alonso B, Hernáez A, Sarnago H, et al. Alterazioni istopatologiche e Ultrastrutturali dopo elettroporazione nel fegato di maiale mediante elettrodi a piastre parallele e Generatore ad alte prestazioni. Rep Sci 2019; 9: 2647.
Argomenti clinici: Aritmie e EP clinico, Cardiochirurgia, Dislipidemia, Angiografia e Intervento cardiovascolare invasivo, Imaging non invasivo, Malattia pericardica, EP Scienza di base, SCD/Aritmie ventricolari, Fibrillazione atriale/Aritmie sopraventricolari, Cardiochirurgia e aritmie, Metabolismo lipidico, Interventi e imaging, Risonanza magnetica
Parole chiave: Atrial Fibrillation, Cardiac Tamponade, Feasibility Studies, Follow-Up Studies, Stroke Volume, Catheter Ablation, Anti-Arrhythmia Agents, Endoscopy, Electroporation, Magnetic Resonance Imaging, Cohort Studies, Phrenic Nerve, Myocytes, Cardiac, Pulmonary Veins, Cicatrix, Microscopy, Electron, Scanning, Feasibility Studies, Prospective Studies, Tissue Scaffolds, Catheter Ablation, Constriction, Pathologic, Heart Atria, Heart Rate, Esophageal Fistula, Cryotherapy, Cardiac Surgical Procedures, Endocardium, Electroporation, Cell Membrane, Electrodes, Extracellular Matrix, Cell Death, Muscle, Scheletrico, fegato, Anestesia, Generale, Proliferazione cellulare, Ictus, Lipidi di membrana, Neoplasie
< Torna agli elenchi