più Grande Arenes
la Maggior parte arenes che contengono un singolo sei-membered anello sono liquidi volatili come benzene e xilene, anche se alcuni arenes con sostituenti sull’anello sono solidi a temperatura ambiente. Nella fase gassosa, il momento di dipolo del benzene è zero, ma la presenza di sostituenti elettronegativi o elettropositivi può provocare un momento di dipolo netto che aumenta le forze attrattive intermolecolari e aumenta i punti di fusione e di ebollizione. Ad esempio, 1,4-diclorobenzene, un composto utilizzato come alternativa al naftalene nella produzione di naftalina, ha un punto di fusione di 52,7°C, che è notevolmente maggiore del punto di fusione del benzene (5,5°C).
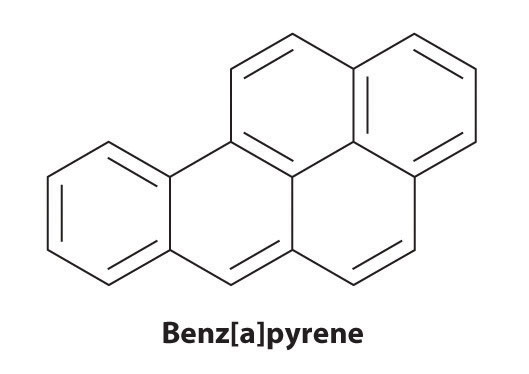
Alcuni idrocarburi aromatici, come il benzene e il benzopirene, sono potenti tossine epatiche e agenti cancerogeni. Nel 1775, un medico britannico, Percival Pott, descrisse l’alta incidenza di cancro dello scroto tra i piccoli ragazzi usati come spazzacamini e lo attribuì alla loro esposizione alla fuliggine. Le sue conclusioni erano corrette: il benzpirene, un componente della fuliggine del camino, delle carni grigliate al carbone e del fumo di sigaretta, fu il primo cancerogeno chimico ad essere identificato.
Sebbene gli areni siano solitamente disegnati con tre legami C=C, il benzene è circa 150 kJ / mol più stabile di quanto ci si aspetterebbe se contenesse tre doppi legami. Questa maggiore stabilità è dovuta alla delocalizzazione della densità elettronica π su tutti gli atomi dell’anello. Rispetto agli alcheni, gli areni sono poveri nucleofili. Di conseguenza, essi non subiscono reazioni di addizione come alcheni; invece, subiscono una varietà di reazioni di sostituzione aromatici elettrofili che comportano la sostituzione di –H sull’arene da un gruppo –E, come –NO2, –SO3H, un alogeno, o un gruppo alchilico, in un processo in due fasi. Il primo passo prevede l’aggiunta dell’elettrofilo (E) al sistema π del benzene, formando un carbocation. Nel secondo passaggio, un protone viene perso dal carbonio adiacente sull’anello:
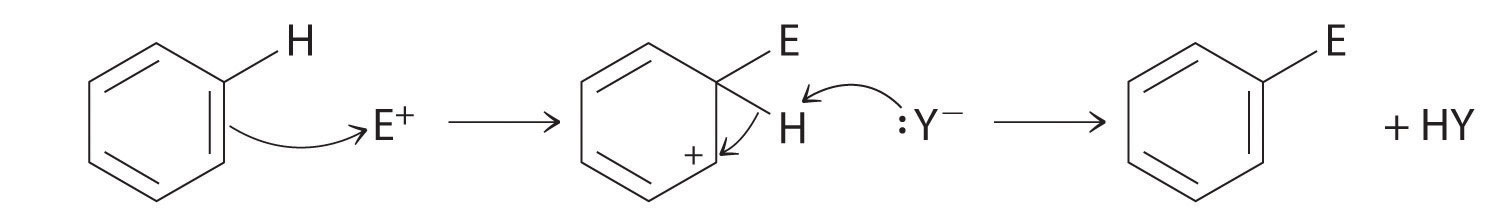
La carbocation formata nel primo passaggio è stabilizzata dalla risonanza.
Gli areni subiscono reazioni di sostituzione piuttosto che di eliminazione a causa della maggiore stabilità derivante dalla delocalizzazione della loro densità elettronica π.
Molti areni sostituiti hanno una potente attività biologica. Alcuni esempi includono farmaci e antibiotici comuni come l’aspirina e l’iprofene, droghe illecite come anfetamine e peyote, l’amminoacido fenilalanina e ormoni come l’adrenalina come mostrato di seguito.
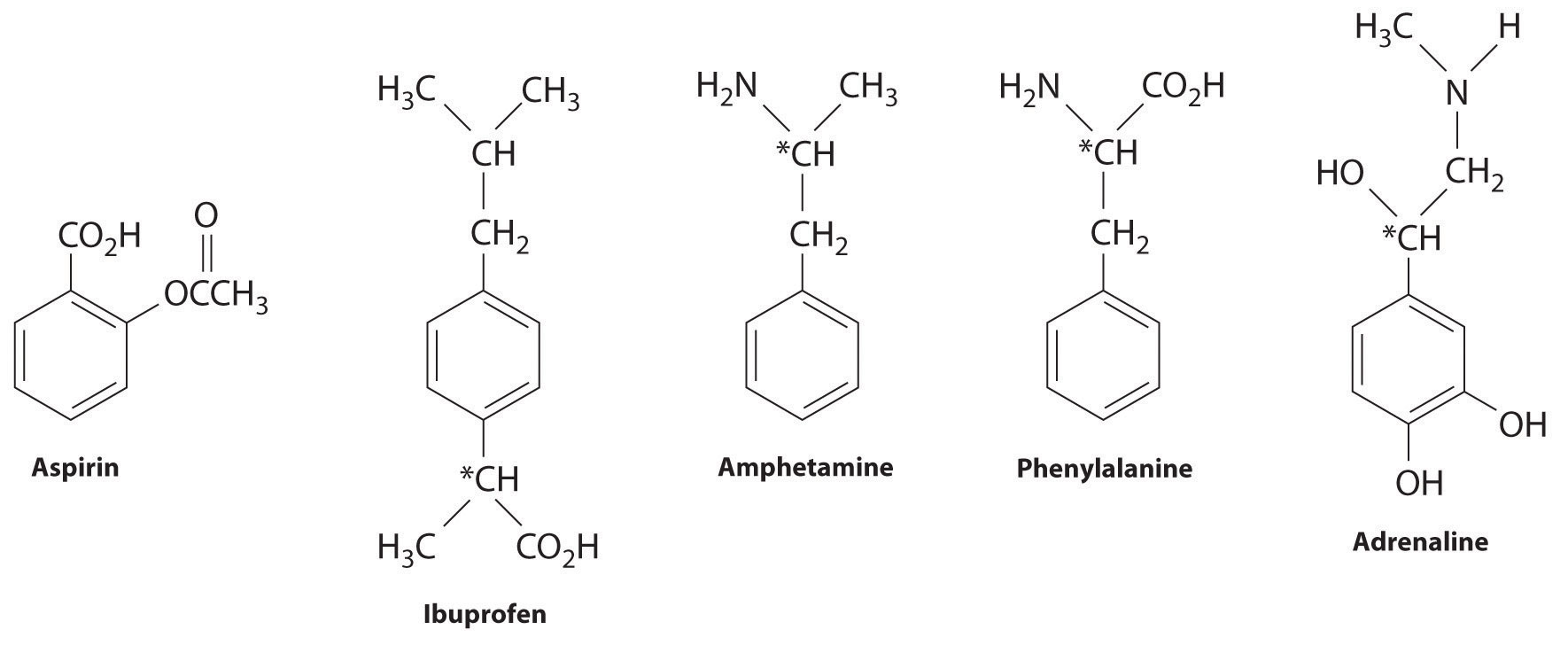
L’aspirina (attività antifever), l’antifprofene (attività antifever e antinfiammatoria) e l’anfetamina (stimolante) hanno effetti farmacologici. La fenilalanina è un amminoacido. L’adrenalina è un ormone che suscita la risposta “lotta o fuga” allo stress.