tiettyjen parametrien, kuten koon, pituuden ja kulman määrittäminen atomiasteikossa ei ole helppoa. Koska nämä parametrit ovat tärkeitä, tutkijat ovat kehittäneet menetelmiä, joilla parametrit voidaan päätellä tai laskea atomitasolla. Sidosjärjestys ja sidoksen pituus ovat kaksi tällaista tärkeää muuttujaa, jotka ilmaisevat atomiparin välisten sidosten tyypin ja lujuuden.
tässä artikkelissa selitetään,
1. Mitkä ovat joukkovelkakirjojen järjestys ja joukkovelkakirjojen Pituus
2. Miten lasketaan Bond Order ja Bond Length
– Miten lasketaan Bond Order
– Miten lasketaan Bond Length
mitkä ovat Bond Order ja Bond Length
Bond length ja bond order ovat kaksi parametria, jotka liittyvät kovalenttisiin sidoksiin. Sidosjärjestys on kahden atomin välisten kemiallisten sidosten lukumäärä ja sidoksen pituus on kahden kovalenttisesti yhteen sidotun atomiytimen välinen etäisyys. Tässä artikkelissa selitetään, miten sidosjärjestys ja sidoksen pituus lasketaan atomitasolla.
Miten lasketaan Sidosjärjestys
Sidosjärjestys on kahden atomin välisten kemiallisten sidosten lukumäärä. Se kertoo sidoksen vakaudesta. Kovalenttisissa sidoksissa sidosjärjestys on jaettujen elektronien lukumäärä. Esimerkiksi yhdellä sidoksella sidotun atomiparin sidosjärjestys on yksi, kun taas kaksoissidoksella sidotun atomiparin sidosjärjestys on kaksi. Nollasidosjärjestys osoittaa, että atomien välillä ei ole sidosta. Molekyylin stabiilisuus kasvaa sidosjärjestyksen kasvaessa. Molekyylien, joilla on resonanssisidos, ei tarvitse olla kokonaisluku. Kovalenttisissa yhdisteissä, joissa on kaksi atomia, atomiparin välinen sidosjärjestys määritetään ensin piirtämällä Lewis – rakenne ja sen jälkeen atomien välisten sidosten tyyppi-nollasidos, yksi -, kaksois-tai kolmoissidos. Esimerkiksi vetykaasun sidosjärjestys määritetään seuraavasti.
- Piirrä Lewis-rakenne
H: H
- Määritä sidosten lukumäärä/valenssielektronipari
yksi elektronipari, joten sidoksen järjestys on 1.
Jos atomeja on enemmän kuin kaksi, sidosjärjestys määräytyy seuraavasti Katso esimerkki: nitraatti-ioni.
- Piirrä Lewis-rakenne
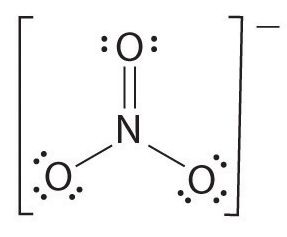
- laske sidosten kokonaismäärä (nitraatti-ionin mukaan, sen 4)
= 4/3
= 1,33
näin ollen nitraatti-ionin sidosjärjestys on 1.33
Miten lasketaan sidoksen pituus
sidoksen pituus on kahden kovalenttisesti yhteen sidotun atomiytimen välinen etäisyys. Sidoksen pituus on yleensä välillä 0,1-0,2 nm. Kun kaksi samanlaista atomia on sitoutunut toisiinsa, sidoksen pituudesta puolta kutsutaan kovalenttiseksi säteeksi. Sidoksen pituus riippuu kahden atomin sidoselektronien määrästä tai sidosjärjestyksestä. Korkeampi sidosjärjestys, lyhyempi sidoksen pituus johtuu positiivisesti varautuneiden ytimien voimakkaista vetovoimista. Sidoksen pituuden yksikkö on picometer. Yksi -, kaksois-ja kolmoissidoksissa sidoksen pituus kasvaa järjestyksessä
kolmoissidos<kaksoissidos<yksisidos
Elektronegatiivisuutta voidaan käyttää laskemaan sidoksen pituus kahden atomin välillä, joilla on eri elektronegatiivisuus. Shoemaker ja Stevenson ehdottivat seuraavaa empiiristä kaavaa sidoksen pituuden laskemiseksi.
dA-B = rA + rB – 0.09(xA – xB)
dA-B on kahden atomin A ja B välinen sidosetäisyys, rA ja rB ovat A: n ja B: n kovalenttisia säteitä ja
(xA – xB) on elektronegatiivisuusero A: n ja B: n välillä.
käytetään toista menetelmää sidoksen likimääräisen pituuden laskemiseksi. Tässä menetelmässä piirretään ensin Lewis-rakenne kovalenttisen sidostyypin määrittämiseksi. Sitten käyttäen kaavio* tehty tutkimuksia Cordero et al., ja Pyykkö ja Atsumi, määritetään kunkin atomin tekemien sidosten vastaavat säteet. Sitten sidoksen pituus määritetään ottamalla kahden säteen summa. Esimerkiksi hiilidioksidin sidoksen pituutta määritettäessä piirretään ensin Lewis-rakenne.
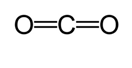
kaavion mukaan hiilen kaksoissidoksen kovalenttinen säde on 67 picometriä ja hapen kaksoissidoksen 57 picometriä. Näin ollen hiilidioksidin sidoksen pituus on noin 124 pikometriä (57 pm+ 67 pm).
*kovalenttinen kaavio löytyy täältä
viite:
cordero, Beatriz, et al. ”Kovalent radii revisited.”Dalton Transactions 21 (2008): 2832-2838.
Libretekstit. ”Sidosjärjestys ja pituudet.”Kemian Libretekstejä. Libretekstit, 05.12. 2016. Web. 10.tammikuuta. 2017.
Lister, Ted ja Janet Renshaw. Kemian ymmärtäminen edistyneelle tasolle. Nelson Thornes, 2000. Tulostaa.
Pratiyogita Darpan. ”Elementtien ominaisuudet suhteessa niiden elektroniseen rakenteeseen .”Kilpailutieteen Visio Aug. 1998: n. Tulostaa.
Pyykkö, Pekka ja Michiko Atsumi. ”Molekulaariset kaksoissidoksen kovalenttiset säteet alkuaineille Li-E112.”Chemistry-A European Journal 15.46 (2009): 12770-12779.
![]()