koska suurin osa uusista hydroksidi-ioneista poistuu, pH ei nouse kovin paljon.
hydroksidi-ionien poistaminen reagoimalla vetyionien kanssa
muista, että etaanihapon ionisoitumisessa esiintyy joitakin vetyioneja.
![]()
![]()
hydroksidi-ionit voivat yhdistyä näiden kanssa muodostaen vettä. Heti kun tämä tapahtuu, tasapaino vinkkejä korvata ne. Näin tapahtuu, kunnes suurin osa hydroksidi-ioneista poistuu.
![]()
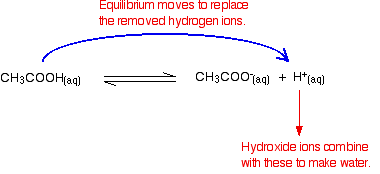
taas, koska mukana on tasapainotila, kaikki hydroksidi – ionit eivät poistu-vain suurin osa. Muodostuva vesi ionisoituu uudelleen hyvin vähäisessä määrin, jolloin syntyy muutamia vetyioneja ja hydroksidi-ioneja.
emäksiset puskuriliuokset
otamme tyypilliseksi ammoniakin ja ammoniumkloridiliuosten seoksen.
ammoniakki on heikko emäs, ja tämän tasapainon sijainti on hyvin vasemmalle:
![]()
![]()
ammoniumkloridin lisääminen tähän lisää runsaasti ylimääräisiä ammoniumioneja. Le Chatelierin periaatteen mukaan se kallistaisi tasapainon asentoa entisestään vasemmalle.
liuos sisältää siis nämä tärkeät asiat:
-
paljon reagoimatonta ammoniakkia;
-
tarpeeksi hydroksidi-ioneja, jotta liuos olisi emäksinen.
paljon ammoniumkloridin ammoniumioneja;
muut läsnä olevat asiat (kuten vesi ja kloridi-ionit) eivät ole argumentille tärkeitä.
lisäämällä happoa tähän puskuriliuokseen
on kaksi prosessia, joilla voidaan poistaa lisättävät vetyionit.
poistaminen reagoimalla ammoniakin kanssa
todennäköisin perusaine, johon vetyioni törmää, on ammoniakkimolekyyli. Ne reagoivat muodostaen ammoniumioneja.
![]()
![]()
suurin osa, mutta ei kaikki, vetyioneista poistuu. Ammoniumioni on heikosti hapan,joten osa vetyioneista vapautuu uudelleen.
vetyionien poistaminen reagoimalla hydroksidi-ionien kanssa
muista, että ammoniakin ja veden välisessä reaktiossa esiintyy jonkin verran hydroksidi-ioneja.
![]()
![]()
vetyionit voivat yhdistyä näiden hydroksidi-ionien kanssa muodostaen vettä. Heti kun tämä tapahtuu, tasapaino vinkkejä korvata hydroksidi-ionit. Näin tapahtuu, kunnes suurin osa vetyioneista on poistettu.
![]()
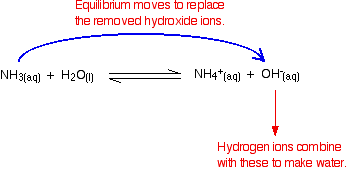
taas kaikki vetyionit eivät poistu – vain useimmat niistä.
lisäämällä emästä tähän puskuriliuokseen
emäksen hydroksidi-ionit poistetaan yksinkertaisella reaktiolla ammoniumionien kanssa.
![]()
![]()
koska muodostunut ammoniakki on heikko emäs, se voi reagoida veden kanssa – ja näin reaktio on hieman reversiibeli. Tämä tarkoittaa, että taas suurin osa (mutta ei kaikki) hydroksidi-ioneista poistuu liuoksesta.
puskuriliuoksia koskevat laskelmat
Tämä on vain lyhyt johdanto. On enemmän esimerkkejä, mukaan lukien useita muunnelmia, yli 10 sivua minun chemistry calculations kirja.
happamat puskuriliuokset
Tämä on helpompi nähdä erityisellä esimerkillä. Muista, että happopuskuri voidaan valmistaa heikosta haposta ja yhdestä sen suoloista.
oletetaan, että sinulla oli puskuriliuos, joka sisälsi 0,10 mol dm-3 etaanihappoa ja 0.20 mol dm-3 natriumetanoaattia. Miten sen pH lasketaan?
missä tahansa heikkoa happoa sisältävässä liuoksessa ionisoimattoman hapon ja sen ionien välillä vallitsee tasapaino. Etaanihapolle on siis olemassa tasapaino:
![]()
![]()
etanoaatti-ionien läsnäolo natriumetanoaatista on siirtänyt tasapainoa vasemmalle, mutta tasapaino on edelleen olemassa.
tämä tarkoittaa, että sille voidaan kirjoittaa tasapainovakio, Ka,:
![]()
![]()
Jos olet tehnyt laskelmia käyttäen tätä yhtälöä aiemmin heikolla hapolla, oletat vetyionien ja etanoaatti-ionien pitoisuuksien olevan samat. Jokainen etaanihappomolekyyli, joka hajoaa, antaa yhden kunkin ionin.
Tämä ei enää päde puskuriliuoksessa:
![]()
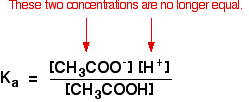
Jos tasapainotilaa on työnnetty vielä pidemmälle vasemmalle, etaanihaposta tulevien etanoaatti-ionien määrä on täysin merkityksetön verrattuna natriumetanoaatista saatuihin ioneihin.
näin ollen oletamme, että etanoaatti – ionin konsentraatio on sama kuin natriumetanoaatin konsentraatio-tässä tapauksessa 0,20 mol dm-3.
heikon hapon laskennassa oletetaan normaalisti, että haposta on ionisoitunut niin vähän, että hapon konsentraatio tasapainotilassa on sama kuin käyttämämme hapon konsentraatio. Tämä pitää vielä enemmän paikkansa nyt, kun tasapainoa on siirretty entistä enemmän vasemmalle.
näin ollen puskuriliuokselle tekemämme oletukset ovat:
![]()
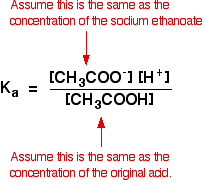
nyt, Jos tiedämme ka: n arvon, voimme laskea vetyionikonsentraation ja siksi pH.
ka etaanihapolle on 1,74 x 10-5 mol dm-3.
muista, että haluamme laskea puskuriliuoksen pH: n, joka sisältää 0,10 mol dm-3 etaanihappoa ja 0,20 mol dm-3 natriumetanoaattia.
![]()
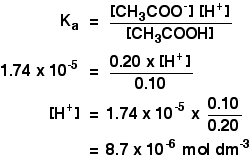
silloin sinun tarvitsee vain löytää pH lausekkeella
pH = -log10
vetyionikonsentraation arvo on edelleen laskimessasi, joten paina lokinäppäintä ja ohita negatiivinen merkki (jotta pH-lausekkeessa on miinusmerkki).
saat vastauksen 5,1 kahteen merkitsevään lukuun. Tarkempaa tietoa ei voi antaa, sillä pitoisuudet annettiin vain kaksinumeroisina.