9.5 Oktettisäännön rikkominen
Oppimistavoite
- tunnistaa oktettisäännön kolme päätyyppiä.
niin tärkeä ja hyödyllinen kuin oktettisääntö on kemiallisessa sidoksessa, on joitakin tunnettuja rikkomuksia. Tämä ei tarkoita, että oktettisääntö olisi hyödytön—päinvastoin. Kuten monissa säännöissä, on poikkeuksia tai rikkomuksia.
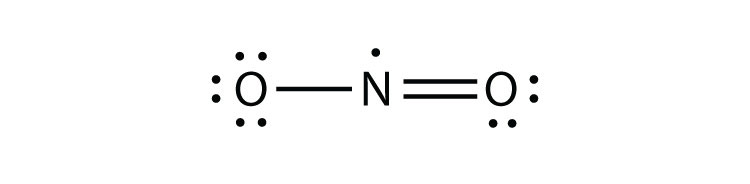
oktettisäännössä on kolme rikkomusta. Pariton-elektroni molekulesa molekyyli, jossa on pariton määrä elektroneja atomin valenssikuoressa. edustaa ensimmäinen rike oktetti sääntö. Vaikka niitä on vähän, joillakin vakailla yhdisteillä on pariton määrä elektroneja valenssikuorissaan. Kun elektroneja on pariton määrä, ainakin yksi atomi molekyylissä joutuu rikkomaan oktettisääntöä. Esimerkkejä stabiileista parittomista elektronimolekyyleistä ovat NO, NO2 ja ClO2. Lewisin elektronin pistekaavio NO: lle on seuraava:
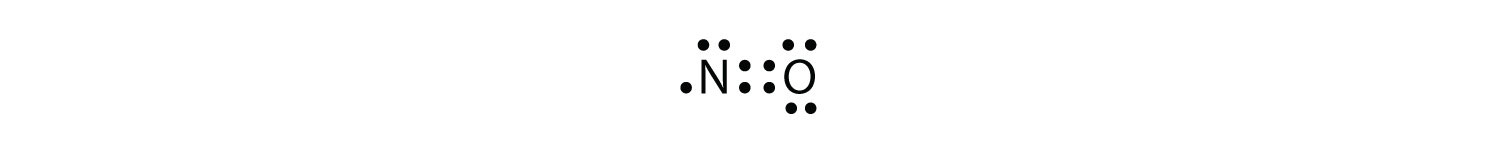
vaikka O-atomilla on oktetti elektroneja, N-atomilla on valenssikuoressaan vain seitsemän elektronia. Vaikka NO on stabiili yhdiste, se on hyvin kemiallisesti reaktiivinen, kuten useimmat muutkin parittomat elektroniyhdisteet.
Elektronipuutos molekulesa molekyyli, jossa atomin valenssikuoressa on vähemmän kuin kahdeksan elektronia. edustaa toinen rike oktetti sääntö. Näillä stabiileilla yhdisteillä on molekyylissä alle kahdeksan elektronia atomin ympärillä. Yleisimpiä esimerkkejä ovat berylliumin ja boorin kovalenttiset yhdisteet. Esimerkiksi beryllium voi muodostaa kaksi kovalenttista sidosta, jolloin sen valenssikuoressa on vain neljä elektronia:
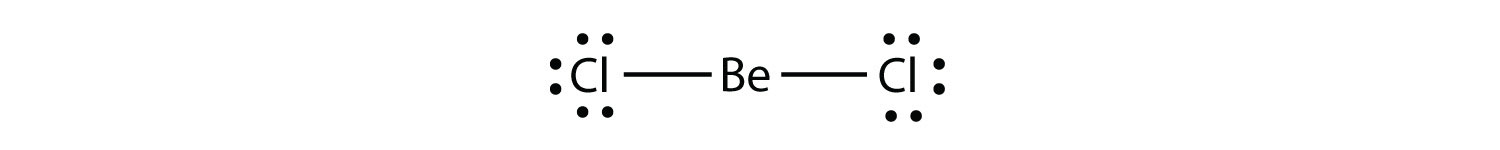
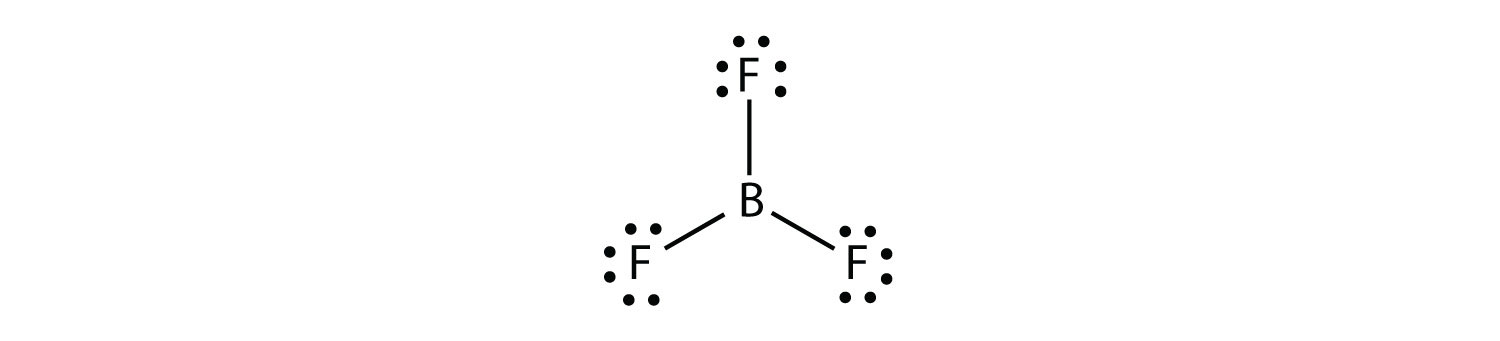
boori muodostaa yleisesti vain kolme kovalenttista sidosta, jolloin B-atomin ympärillä on vain kuusi valenssielektronia. Tunnettu esimerkki on BF3:
kolmas oktettisäännön rikkominen löytyy niistä yhdisteistä, joiden valenssikuorelle on osoitettu yli kahdeksan elektronia. Näitä kutsutaan laajennetuksi valenssikuoreksi molekulesa-molekyyliksi, jossa on enemmän kuin kahdeksan elektronia atomin valenssikuoressa.. Tällaisia yhdisteitä muodostuu vain jaksollisen järjestelmän kolmannella rivillä tai sen ulkopuolella olevista keskusatomeista, joiden valenssikuorissa on tyhjiä d-orbitaaleja, jotka voivat osallistua kovalenttiseen sidokseen. Yksi tällainen yhdiste on PF5. Ainoa järkevä Lewis-elektronin pistekaavio tälle yhdisteelle on, että P-atomi tekee viisi kovalenttista sidosta:
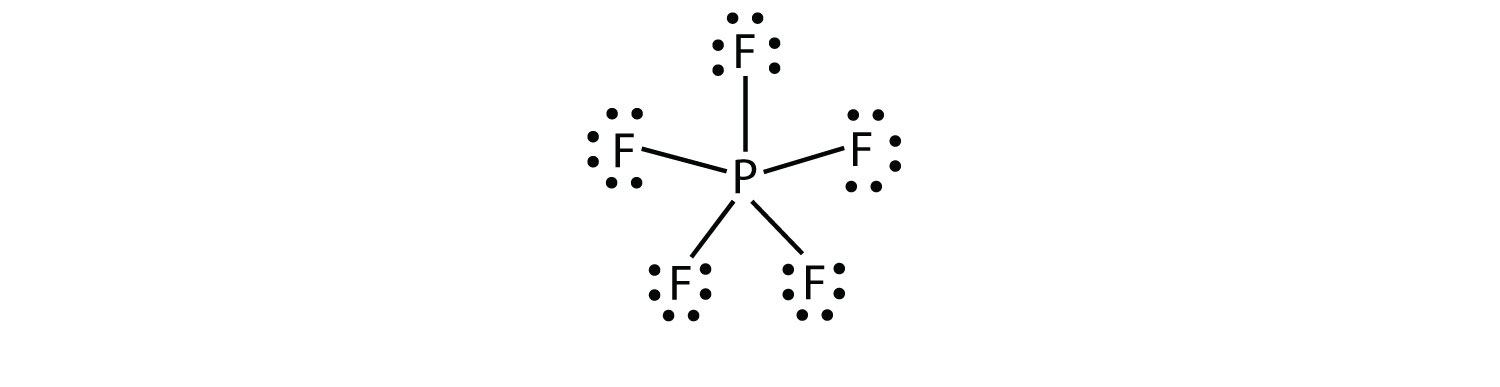
muodollisesti P-atomilla on valenssikuoressaan 10 elektronia.
esimerkki 9
tunnista jokainen oktettisäännön rikkominen piirtämällä Lewisin elektronin pistekaavio.
- CLO
- SF6
liuos
yhden Cl-atomin ja yhden O-atomin kanssa tällä molekyylillä on 6 + 7 = 13 valenssielektronia, joten se on pariton elektronimolekyyli. Lewis-elektronin pistekaavio tälle molekyylille on seuraava:

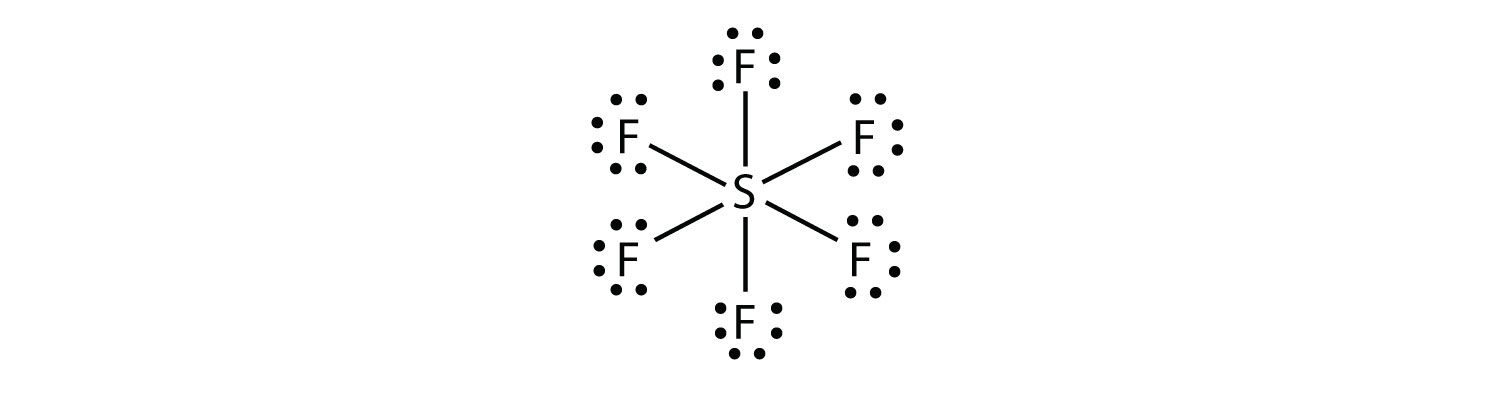
SF6: ssa keskus-S-atomi tekee kuusi kovalenttista sidosta kuuteen ympäröivään F-atomiin, joten se on laajentunut valenssikuorimolekyyli. Sen Lewisin elektronin pistekaavio on seuraava:
Testaa itse
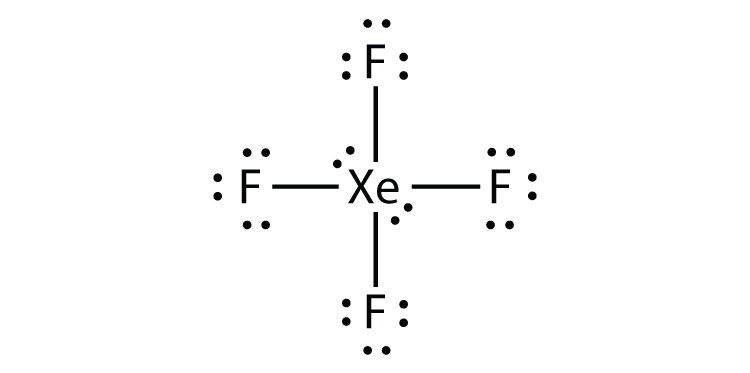
tunnista Oktettisäännön rikkominen xef2: ssa piirtämällä Lewisin elektronin pistekaavio.
vastaus
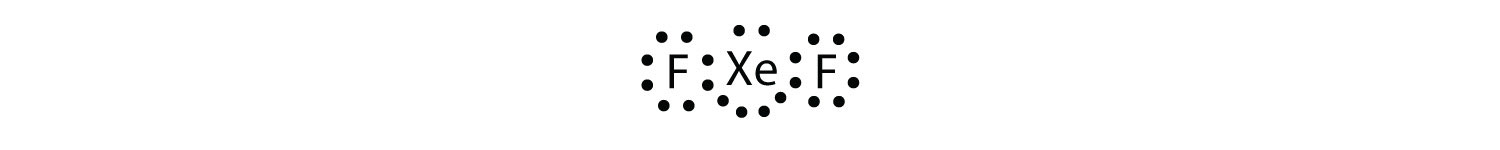
Xe-atomilla on laajentunut valenssikuori, jonka ympärillä on yli kahdeksan elektronia.
Key Takeaway
- oktettisäännössä on kolme rikkomusta: parittomat elektronimolekyylit, elektronipuutteiset molekyylit ja laajentuneet valenssikuorimolekyylit.
harjoitukset
-
miksi pariton elektronimolekyyli ei täytä oktettisääntöä?
-
miksi jaksollisen järjestelmän toisen rivin atomi ei voi muodostaa laajentuneita valenssikuorimolekyylejä?
-
Piirrä hyväksyttävä Lewis-elektronin pistekaavio näille molekyyleille, jotka rikkovat oktettisääntöä.
- NO2
- XeF4
-
Piirrä hyväksyttävä Lewis-elektronin pistekaavio näille molekyyleille, jotka rikkovat oktettisääntöä.
- Bcl3
- ClO2
-
Piirrä hyväksyttävä Lewis-elektronin pistekaavio näille molekyyleille, jotka rikkovat oktettisääntöä.
- POF3
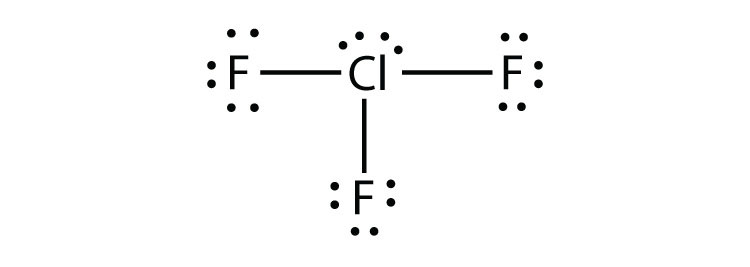
- ClF3
-
Piirrä hyväksyttävä Lewis-elektronin pistekaavio näille molekyyleille, jotka rikkovat oktettisääntöä.
- SF4
- BeH2
-
kaikkia elektroneja ei voi parittaa, jos niitä on pariton määrä.
-

vastauksia