1960-luvun alussa biologit alkoivat tutkia, miten eri lajien proteiinit kehittyvät sekvenssitasolla (zuckerkandl 1962, margoliash 1963, Doolittle & blombäck 1964). Analysoituja proteiineja olivat hemoglobiini (Zuckerkandl & Pauling 1962), sytokromi C (Margoliash 1963) ja fibrinopeptidit (Doolittle & Blombäck 1964). Nämä varhaiset tutkimukset johtivat merkittävään löytöön: näytti siltä, että eri lajien proteiinisekvenssien erojen määrä oli suurin piirtein verrannollinen lajien erojen jälkeiseen aikaan (kuva 1).
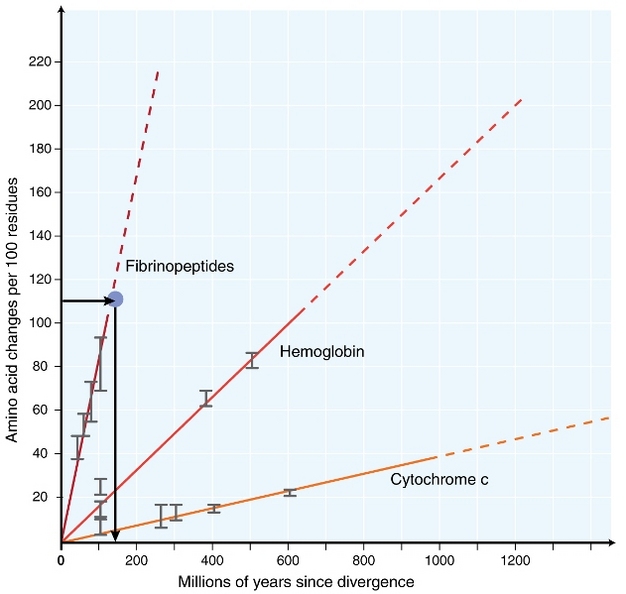
Zuckerkandl & Pauling (1965) vertasi aminohapposubstituutioiden jatkuvaa kertymistä ajan kuluessa kellojen säännöllisiin ”tikkeihin” ja totesi, että ”molekyylievoluution kello voi olla olemassa”. Termi ”molekyylikello” keksittiinkin alun perin kuvaamaan aminohappojen muutoksia, jotka ovat tapahtuneet suhteessa aikaan lajien hajaantumisen jälkeen.
termiä ”molekyylikello” on ensimmäisestä käytöstään lähtien käytetty monissa eri yhteyksissä. Nykyään sillä viitataan usein vain DNA: n tai proteiinien sekvenssiin kertyneiden muutosten eli ”substituutioiden” määrään tietyssä sukulinjassa. Substituutioiden määrää määriteltyä aikayksikköä kohti voidaan kuvata molekyylikellon ”nopeudeksi”, joka tässä yhteydessä vastaa ”evoluutionopeutta”. Huomaa, että alkuperäinen mielleyhtymä pätee edelleen joissakin tapauksissa. Esimerkiksi kun ihmiset toteavat ”oletimme molekyylikellon” (erityisesti fylogeneettisissä analyyseissä), se tarkoittaa, että substituutioiden määrän oletettiin tapahtuvan jatkuvasti ajan kuluessa.
jatkuvan molekyylikellon käsitteellä on poikkeuksellisia seurauksia evoluutiobiologeille. Jos alun perin ehdotettu jatkuva molekyylikello todella olisi olemassa, evolutionaaristen tapahtumien päättelevästä ajoituksesta tulisi melko suoraviivainen ongelma (Kuva 1). On kuitenkin käynyt täysin selväksi, että substituutioita ei tapahdu jatkuvasti ajan mittaan eri sukulinjoissa (Kumar 2005). Molekyylikellon käsitteellä on kuitenkin ollut erittäin suuri vaikutus molekyylievoluution alalla. Yksi tärkeimmistä molekyylikellon käsitteen innoittamista ajatuksista on molekyylievoluution neutraali teoria.
Molekyylikello ja neutraalisuus
kun ajatus jatkuvasta molekyylikellosta syntyi, ajateltiin, että vallitseva evoluutiovoima aminohappo-tai nukleotidisubstituutioiden taustalla oli luonnonvalinta. Tätä ajattelutapaa noudattamalla jatkuva molekyylikello osoittaisi, että eri lajien adaptiivisia substituutioita tapahtuu jatkuvasti ajan kuluessa. On kuitenkin vaikea selittää, miten Adaptiiviset korvautumiset tapahtuisivat näin kellomaisesti. Teoreettisesti adaptiivisten mutaatioiden kohtalot määräytyvät useiden evoluutioparametrien mukaan, kuten kyseisen mutaation selektiivisen edun vahvuus, efektiivisen populaation koko ja adaptiivisten mutaatioiden määrä (Kimura 1983). Nämä parametrit todennäköisesti eroavat toisistaan lajien välillä ja jopa lajin sisällä riippuen tietyistä mutaatioista ja niiden vuorovaikutuksesta ympäristöjen kanssa.
sen sijaan Kimura (1968, 1969) esitti, että useimmilla molekyylitason muutoksilla on vain vähän toiminnallisia seurauksia eli ne ovat ”neutraaleja”. Jos mutaatiolla ei ole kuntoseuraamusta, sen kohtalo populaatiossa määräytyy täysin sattumanvaraisesti. Tämä tarkoittaa, että emme voi ennustaa, onko tietty neutraali mutaatio lopulta vahvistettu populaatiossa. Neutraalien substituutioiden esiintymisnopeus populaatiossa voidaan kuitenkin ennustaa, koska se riippuu yhdestä parametrista eli mutaationopeudesta (Kimura 1968).
kuvitellaan populaatio, jossa on N määrä haploideja yksilöitä. Jos neutraaleja mutaatioita tapahtuu nopeudella u yksilöä kohti sukupolvea kohti, yhden sukupolven mutaatioiden kokonaismäärä on N kertaa u. koska kaikki nämä uudet mutaatiot ovat neutraaleja, niiden kohtalot määräytyvät täysin sattumalta. Toisin sanoen kaikilla mutaatioilla on yhtäläiset mahdollisuudet saavuttaa fiksaatio (joka johtaa ”substituutioon”). Todennäköisyys sille, että jokainen uusi neutraali mutaatio saavuttaa fiksaation, kun otetaan huomioon, että substituutio tapahtui, on yksinkertaisesti 1/N. Substituutionopeus lasketaan siten, että uusien mutaatioiden määrä kussakin sukupolvessa (Nu) kerrotaan todennäköisyydellä, että jokainen uusi mutaatio saavuttaa fiksaation (1/N), joka on yhtä suuri kuin u. toisin sanoen neutraalien mutaatioiden kohdalla substituutionopeus on yhtä suuri kuin mutaation nopeus!
näin ollen, jos useimmat mutaatiot ovat neutraaleja (kuten neutraaliteoriassa on ehdotettu) ja jos mutaationopeus on ajan mittaan vakio, myös substituutioita tulee esiintyä jatkuvasti ajan mittaan. Meidän pitäisi sitten tarkkailla kellomainen säännöllinen määrä substituutioita molekyylitasolla. Kimura (1969) pitikin suhteellisen jatkuvan molekyylikellon havainnointia proteiinisekvensseissä vahvana tukena neutraalille molekyylievoluution teorialle.
testaamalla, miten neutraali Molekyylikello kulkee
neutraalin teorian mukaan kysymys siitä, ovatko substituutionopeudet ajan mittaan vakio vai eivät, vastaa sitä, ovatko neutraalit mutaationopeudet ajan mittaan vakio. Tästä syystä monet myöhemmät tutkimukset keskittyivät analysoimaan neutraaleilta alueilta saatuja tietoja sen määrittämiseksi, ovatko neutraalit mutaationopeudet todellakin ajan mittaan vakio. Tarkastelemme lyhyesti, miten nämä tutkimukset toteutetaan, ennen kuin keskustelemme teoreettisista keskusteluista molekyylikelloista. Myös proteiinimolekyylikellojen analyysit jatkuivat, mutta proteiinimolekyylikellojen vaihteluun liittyvät keskustelut ovat hyvin erilaisia kuin neutraaleja molekyylikelloja koskevat keskustelut, eikä niitä sisällytetä tähän artikkeliin. Kiinnostuneiden lukijoiden tulisi kääntyä Gillespien (1991), Kumarin (2005), Kimin ja Yin (2008) ja Bedfordin ym.puoleen. (2008).
useimmat neutraalien molekyylikellojen empiiriset analyysit perustuvat teoreemaan, jonka mukaan neutraalit mutaationopeudet voidaan päätellä neutraaleista substituutionopeuksista (Kimura 1968, 1969). Käytännössä jokainen tutkimus määrittelee tietyntyyppiset kohteet perimässä neutraaleiksi paikoiksi ja vertaa niiden korvausasteita sukulinjojen välillä.
sitä, mitkä paikat perimässä ovat todella neutraaleja, ei voida täysin määrittää, mutta tutkijat keksivät useita hyödyllisiä prokseja. Ennen genomin sekvensoinnin aikakautta saatavilla oli eniten sekvenssitietoa proteiinia koodaavista DNA-sekvensseistä. Tutkimukset jakavat usein proteiineja koodaavat DNA-sekvenssit kahdentyyppisiin paikkoihin (Wu & Li 1985). Ensimmäiseen tyyppikohtaan kuuluvat sellaiset paikat, joissa mikä tahansa muutos johtaisi aminohapposubstituutioihin eli ns. Toinen paikkatyyppi, ”synonyymiset paikat”, sisältää ne, jotka koodaavat kodonitaulukon ”degeneroituneita” paikkoja, joissa muutos ei johda aminohapposubstituutioon. Esimerkiksi TCT ja TCC molemmat koodaavat seriiniä. Jos näiden kodonien kolmas asema muuttuu, ne tuottavat edelleen samoja aminohappoja. Tällaiset sijamuodot eivät näkyisi yhtä hyvin luonnonvalinnassa. Näin ollen molekyylikellojen tulisi synonyymeillä paikoilla olla lähempänä neutraalia molekyylikelloa kuin ei-samannimisiä kelloja.
sekvensointitekniikoiden kehittyessä joissakin tutkimuksissa käytettiin introneja proksioina neutraaleille alueille, koska ne eivät sisälly kypsään mRNAs: ään ja ovat siten todennäköisemmin neutraaleja (Yi et al. 2002). Sekvenssit inaktiivisia transposable elementtejä, jotka lisättiin kauan ennen lajien eroja olivat myös usein käytetty (näitä kutsutaan usein ”ancestral toistaa”, esim., Thomas et al., 2003). Lopuksi joissakin tutkimuksissa käytettiin ei-koodaavia DNA-sekvenssejä (kaikki sekvenssit sen jälkeen, kun proteiini-koodaava DNA-sekvenssit on poistettu), jotka on uutettu koko genomin linjauksista neutraalien molekyylikellojen testaamiseksi (Elango et al. 2006, Huttley ym. 2007).
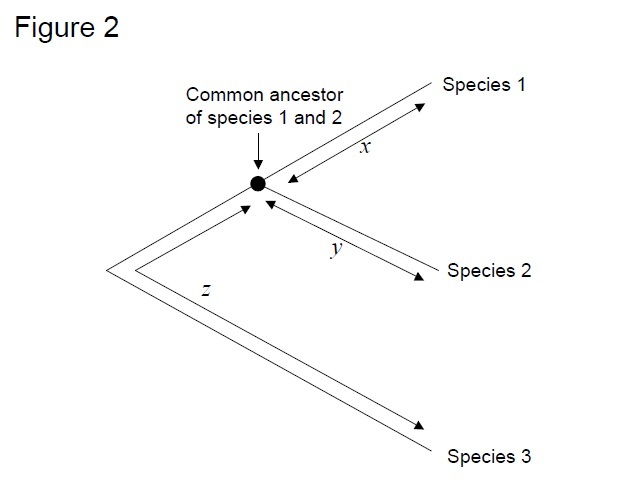
yleisimmin käytetty testi on niin sanottu suhteellinen nopeustesti (Sarich & Wilson 1973). Alun perin korvautumisasteet aikayksikköä kohti arvioitiin jakamalla eri lajien proteiinien välisten erojen (substituutioiden) kokonaismäärä fossiiliaineistojen perusteella arvioidulla divergenssiajalla (Kuva 1). Fossiiliaineistoja ei kuitenkaan ole saatavilla moneen vertailuun, ja niihin liittyy suuria virhemarginaaleja. Suhteellisella nopeustestillä kumotaan fossiiliaineistojen tarve (kuva 2). Niin kauan kuin outgroup jono kaksi lineages kiinnostaa olemassa, voimme määrittää, onko kaksi haaraa seurata samaa tai eri molekyylikellot, ilman tietoa absoluuttinen aika divergenssi (kuva 2).
mitkä ovat neutraalien Molekyylikellojen taustatekijät?
lähes kaikki neutraaleja molekyylikelloja koskevien keskustelujen ytimessä olevat kiistat johtuvat siitä, mitkä ovat tärkeimmät mutaatioiden lähteet. Tämä kysymys liittyy suoraan mutaatiomallien ymmärtämiseen, jotka ovat evolutiivisen muutoksen ja geneettisen sairauden perimmäinen lähde. Lisäksi sen ymmärtäminen, miten mutaationopeudet vaihtelevat sukulinjojen välillä ja genomien sisällä, on keskeinen kysymys vertailevassa genomiikassa, jossa pyritään sekvenssivertailujen avulla tunnistamaan toiminnallisesti tärkeitä genomialueita.
mikä siis määrittää neutraalit mutaationopeudet? Yksi tärkeimmistä neutraalien molekyylikellojen edistäjistä on sukusukupolvikohtainen vaihtelu sukupolviajoissa. Jo varhain ajatuksena jatkuvasta neutraalista molekyylikellosta koettiin olevan ristiriidassa itulinjan mutaation molekyylimekanismien kanssa. On pitkään katsottu, että useimmat mutaatiot johtuvat DNA: n replikaation virheistä itulinjoissa (Haldane 1947, Muller 1954). Koska mutaatiot tapahtuvat sukusolujen DNA: n monistuessa seuraavalle sukupolvelle, niiden pitäisi kertyä suhteessa sukupolvien määrään eikä absoluuttiseen aikaan. Jos siis vertaisimme niiden substituutioiden lukumäärää, jotka ovat kertyneet kahteen sukulinjaan niiden eroamisen jälkeen, sukulinjassa, jossa on pidempi sukupolviaika ja joka on käynyt läpi vähemmän DNA: n replikaatiotapahtumia, olisi vähemmän substituutioita verrattuna sukulinjaan, jossa on lyhyempi sukupolviaika. Tämän vuoksi molekyylikellon pitäisi kulkea hitaammin lajeilla, joilla on pidempi sukupolviaika. Tästä ajatuksesta käytetään nimitystä ”sukupolvi-aika-efekti”.
itse asiassa sukupolviaikavaikutus havaittiin ensimmäisen kerran kädellisillä tehdyissä tutkimuksissa jo ennen molekyylikellosta käytyä keskustelua. Morris Goodman, joka käytti immunologisia menetelmiä tutkiessaan lajisidonnaisuutta, havaitsi, että apinoilla, erityisesti ihmisillä, joidenkin proteiinien erilaistumisnopeus näytti hidastuvan verrattuna vanhan maailman apinoihin (Goodman 1961, 1962, 1963). Tätä vaikutusta kutsutaan ”hominoidinopeuden hidastumiseksi”. Koska hominoideilla on pidempi sukupolviaika kuin vanhan maailman apinoilla, tämä havainto voidaan selittää sukupolviaikaisella vaikutuksella.
Wu & Li (1985) testasivat ensimmäisenä generaatioajan vaikutushypoteesia DNA-sekvenssitietojen avulla. He käyttivät tietoja kädellisten ja jyrsijöiden 11 geenistä. Koska kädellisten sukupolviaika on paljon pidempi kuin jyrsijöiden, molekyylikellon pitäisi olla jyrsijöillä nopeampi kuin kädellisillä. He havaitsivatkin, että synonyymeillä paikoilla jyrsijät osoittavat noin kaksi kertaa molekyylitason evoluution nopeuden verrattuna kädellisiin (Wu & Li 1985). Ei-nimisille sivustoille tällaista vaikutusta ei kuitenkaan löytynyt. Toisin sanoen neutraali molekyylikello, mutta ei aminohappomolekyylikello, tikittää nopeammin jyrsijälinjassa kädellisten sukuun verrattuna, mikä sopii hyvin ajatukseen sukupolvivaikutuksesta.
myöhemmät tutkimukset antoivat lisätukea hominoidinopeuden hidastumiselle (Li & Tanimura 1987, Bailey et al. 1991) ja jyrsijöiden ja kädellisten sukuhaarojen välinen erotus (Gu & Li 1992, Huttley et al. 2007). Lisäksi nopeusero havaittiin vielä pienemmissä fylogeneettisissä asteikoissa, erityisesti kädellisillä: esimerkiksi ihmisen molekyylikello kulkee hitaammin kuin simpanssin molekyylikello (Elango et al. 2006); uuden maailman apinoiden määrät ovat nopeampia kuin hominoidien ja vanhan maailman apinoiden (Steiper & Young 2006). Näissä tutkimuksissa havaitut molekyylikellojen eri nopeudet ovat laadullisesti yhteneväisiä sukupolvivaikutuksen kanssa.
lineaarien väliset todelliset erot eivät kuitenkaan ole kvantitatiivisesti yhtäpitäviä generaatioaikojen erojen kanssa. Esimerkiksi Kumar & Subramanian (2002) osoitti, että vaikka kädellisten ja jyrsijöiden sukupolvien välinen ero on paljon suurempi kuin ihmisten ja vanhan maailman apinoiden, molekyylikellojen havaitut erot ovat näissä kahdessa vertailussa samanlaisia. On syytä huomata, että Kumar & Subramanian (2002) käytti erityisiä tilastollisia suodattimia poistaakseen tietoja, jotka osoittivat ”heterogeenisiä” substituutiomalleja, jotka saattoivat aiheuttaa harhaa hitaasti kehittyviin sekvensseihin (Yi et al. 2002). Kädellisten ja jyrsijöiden molekyylikellojen ero näyttää kuitenkin paljon vähäisemmältä kuin Wu & Li (1985) alun perin ehdotti. Esimerkiksi Huttley et al. (2007) analysoitiin koko genomin linjauksia useita lajeja, kuten opossum, ja osoitti, että nopeusero eutherian lineages ja opossum lineage (~30%) on paljon suurempi kuin nopeusero ihmisen ja hiiren lineages (~14%). Nämä esimerkit osoittavat, että molekyylikellojen erojen aste vaihtelee merkittävästi eri tutkimusten välillä johtuen tietokokonaisuuksien ja tilastollisten menetelmien eroista. Ne osoittavat myös, että linjojen välisiä nopeuseroja ei voida täysin selittää pelkästään sukupolvenvaihdosten eroilla. Neutraaleille molekyylikelloille on selvästikin muitakin antajia.
muutkin elämänhistorialliset piirteet kuin sukupolviaika näyttävätkin vaihtelevan molekyylikellojen kanssa. Martin & Palumbi (1993) osoitti, että DNA-molekyylikellot kulkevat nopeammin lajeissa, joilla on pieni ruumiinkoko. Tämä havainto johti olettamukseen, että aineenvaihduntanopeudet ovat tärkeitä molekyylikellojen taustatekijöitä. Korkea aineenvaihdunta tuottaa suuria määriä mutageenisia happiradikaaleja, mikä lisäisi mutaationopeuksia (Rand 1994). Koska aineenvaihduntanopeus ja ruumiinkoko vaihtelevat yleensä sukupolvenvaihdosten mukaan, on ollut vaikea erottaa, mikä näistä on molekyylikellonopeuden tärkein määrittäjä. Tsantes & Steiper (2009) on ehdottanut kädellisistä saatujen tietojen perusteella, että molekyylikellojen tärkein määrittäjä on ensimmäisen lisääntymisen ikä eikä ruumiin koko. Koska ikä ensimmäisessä lisääntymisessä heijastaa sukupolviaikavaikutusta, tämä tutkimus tukee ajatusta siitä, että sukupolviaikavaikutus on molekyylikellon tärkein determinantti. Tämä tutkimus perustuu kuitenkin edelleen rajalliseen sukujuurten määrään (käytettiin neljää lajiparia). Näin ollen ruumiin koon, sukupolvenaikaisen vaikutuksen ja aineenvaihduntanopeuden erottaminen toisistaan on edelleen tärkeä kysymys neutraalien molekyylikellojen yleistämisessä ja ymmärtämisessä.
myös sellaisten tekijöiden merkitystä, jotka eivät vaihtele yhdessä sukupolvenvaihdosten kanssa, kuten DNA: n metylaatio, on alettu arvostaa yhä enemmän. DNA-metylaatio on monimuotoisista taksoneista löytyvän genomisen DNA: n kemiallinen muunnos. Eläinten genomeissa DNA-metylaatio tapahtuu lähes yksinomaan sytosiineilla, joita seuraa guaniinit (ns. Metyloidut sytosiinit puolestaan mutatoituvat nopeasti tymiineiksi kemiallisen epävakauden vuoksi (Bird 1980). Ihmisen genomissa DNA-metylaation aiheuttamia mutaatioita tapahtuukin suuruusluokkaa useammin kuin muita mutaatioita (Nachman & Crowell 2000, Elango et al. 2008). Koska DNA: n metylaation aiheuttamat mutaatiot tapahtuvat pitkälti DNA: n replikaatiosta riippumatta, tällaiset mutaatiot saattavat seurata eri molekyylikelloja kuin muut. Erityisesti sukupolven aikariippuvuuden sijaan DNA: n metylaation aiheuttamat mutaatiot voivat seurata ajasta riippuvaista molekyylikelloa, joka on samankaltainen kuin mitä Zuckerkandl & Pauling (Kim et al. 2006)!
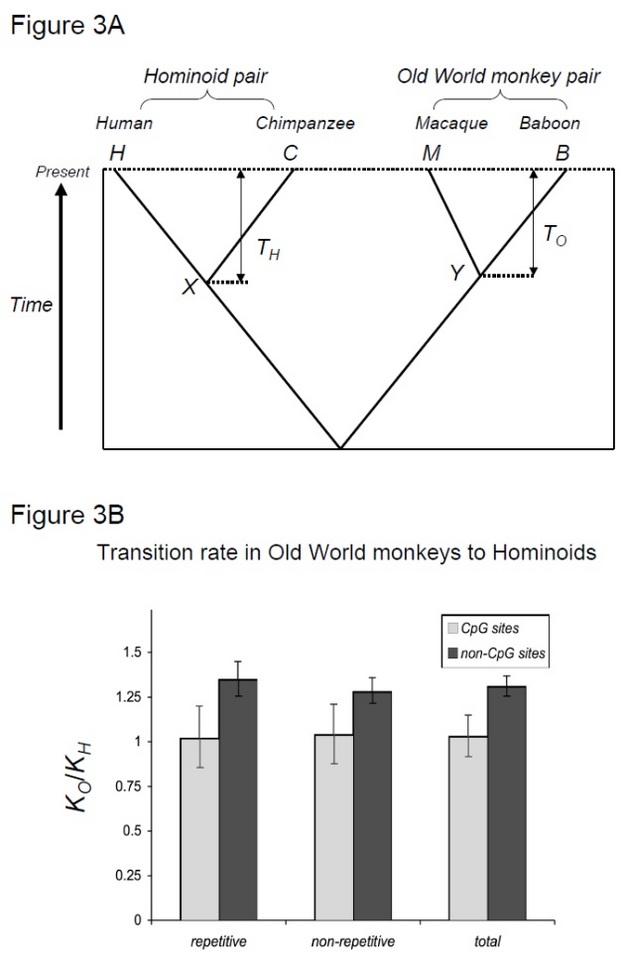
tämän hypoteesin testaamiseksi, Kim et al. (2006)verrattiin ihmisen ja simpanssin divergenssiä makaki-paviaanin divergenssiin, kahteen lajipariin, joilla on samanlainen divergenssiaika mutta eri sukupolviaika (Steiper et al. 2004). Ihmisen ja simpanssin parilla (hominoidiparilla) on paljon pidempi sukupolviaika verrattuna makaki-paviaanipariin (vanhan maailman apinapariin). Tämä tutkimus osoitti, että muilla kuin CpG-alueilla vanhan maailman apinapari keräsi noin 30% enemmän substituutioita, mikä voidaan selittää edellä mainitulla hominoidinopeuden hidastumisvaikutuksella. Sen sijaan Molekyylikelloissa CpG-paikoissa oli yhtä paljon substituutioita hominoidi-ja vanhan maailman apinapareilla (kuva 3). Aikariippuvaiset ja sukupolvesta riippuvat molekyylikellot ovat siis rinnakkain samojen genomien sisällä. Oletus siitä, että tietylle sukujuurelle voi olla olemassa yksi molekyylikello, ei ole enää pätevä, koska vallitseva mutaatiovoima vaihtelee genomialueiden välillä.
päätelmät
vakiintuneen molekyylikellon käsitettä ehdotettiin alun perin perustuen rajalliseen määrään proteiinisekvenssitietoja. Vaikka myöhemmät tutkimukset osoittivat, että tällainen havainto ei ole yleinen kaava aminohapoissa, sillä on ollut merkittävä vaikutus molekyylievoluution alaan, erityisesti DNA-sekvenssitietojen neutraalin molekyylievoluutioteorian kehittymiseen. Neutraalin teorian jälkeen tutkimukset keskittyivät selvittämään neutraalien mutaationopeuksien vaihtelumalleja. Viimeisten vuosikymmenten aikana olemme havainneet, että molekyylikellot kulkevat eri tahtia eri linjojen välillä. Lisäksi vaihtelun aste voi vaihdella riippuen erityyppisistä tiedoista ja käytetyistä tilastollisista menetelmistä. Sukupolviaikavaikutus pysyy edelleen laadullisella tasolla, mutta se ei riitä selittämään neutraalien mutaationopeuksien kvantitatiivista vaihtelua sukulinjojen välillä. Myös elämänhistorialliset piirteet ja replikaatiosta riippuvaiset mutaatiot, kuten DNA: n metylaation aiheuttamat mutaatiot, ovat tärkeitä genomisten molekyylikellojen edistäjiä. Itse asiassa erilaisia molekyylikelloja havaitaan jopa genomin sisällä, koska vallitsevat mutaatiotulokset vaihtelevat eri genomialueiden välillä. Näin ollen sen sijaan, että olettaisi yhden neutraalin molekyylikellon kullekin genomille, tulevien tutkimusten tulisi pyrkiä paljastamaan genomineutraalien molekyylikellojen vaihtelu, jotta saataisiin tietoa genomien mutaatiomaisemista. Tällaiset tiedot eivät ole ainoastaan hyödyllisiä molekyylievoluutiota ja geneettistä sairautta hallitsevan raaka-aineen ymmärtämisessä, vaan ne muodostavat myös kriittisen komponentin, joka vaikuttaa vertaileviin ja funktionaalisiin genomianalyyseihin funktionaalisten genomialueiden tunnistamiseksi.