joten kuten tiedätte, Dmitri Mendelejev on jaksollisen järjestelmän isä. Mutta tiesitkö, että nykyaikaisen jaksollisen järjestelmän, jota käytämme, kehitti tiedemies nimeltä Henry Moseley? Tutustukaamme jaksollisen järjestelmän kiehtovaan historiaan.
Suggested Videos
moderni Jaksollinen järjestelmä
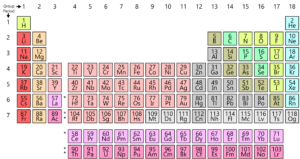
kuten tiedätte, kaikki maasta löydetyt alkuaineet ovat järjestäytyneet ruudukkoon tai matriisiin, jota kutsutaan nykyaikaiseksi jaksolliseksi järjestelmäksi. Näiden elementtien järjestely on kaavan mukainen. Jaksollisen järjestelmän kehitti itse asiassa Mendelejev 1800-luvun alussa. Englantilaisen fyysikon Henry Moseleyn vuonna 1913 viimeistelemä teos oli kuitenkin todellinen. Tekemällä muutoksia jaksolliseen lakiin hän paransi kaikkia Mendelejevin taulukon puutteita. Tarkastelkaamme tätä kehitystä.
Selaa lisää aiheita alkuaineiden jaksollisessa luokittelussa
- aikaisemmat yritykset luokitella alkuaineet
- alkuaineiden asema nykyaikaisessa jaksollisessa järjestelmässä
- trendit nykyaikaisessa jaksollisessa järjestelmässä
käyttäen Järjestyslukua
Tarkastellaanpa ensin atomin rakennetta. Jokainen atomi koostuu ytimestä, joka koostuu protoneista ja neutroneista. Tässä protoneilla on positiivinen varaus ja neutronilla ei ole varausta. Nyt elektronit (joilla on negatiivinen varaus) ympäröivät ydintä. Atomimassaluku on atomissa olevien protonien ja neutronien kokonaismäärä. Järjestysluku on atomin protonien lukumäärä. Tämä järjestysluku on täysin ainutlaatuinen jokaiselle alkuaineelle, mikä tarkoittaa, että jokaisella alkuaineella planeetalla on oma yksilöllinen järjestyslukunsa.
Henry Moseley ehdotti Mendelejeviä parempaa järjestelyä. Hän järjesti alkuaineet niiden järjestysluvun eikä niiden atomimassan mukaan. Tekemällä niin hän paransi edellisen taulukon ja poistaa joitakin sen vaikeuksia ja poikkeavuuksia.
vedyn sijainti
Mendelejev ei koskaan saanut selville vedyn oikeaa sijaintia taulukossaan. Koska vety voi joko saada tai menettää elektronin, se voi löytää paikan ryhmässä 1 tai 17. Sen elektroninen konfiguraatio muistuttaa alkalimetallien rakennetta. Tosin se voi myös yhdistyä metallien ja epämetallien kanssa muodostaen kovalenttisia sidoksia kuten halogeenit.
mutta nykyaikaisessa jaksollisessa järjestelmässä dilemmaa ei ole. Koska vedyn järjestysluku on 1, se löytää sille sopivan paikkansa taulukon alussa.
isotoopit
isotoopit ovat alkuaineen eri atomeja, joilla kullakin on sama määrä protoneja, mutta eri määrä neutroneja ytimissään. Tämä merkitsee sitä, että vaikka niiden atomimassa vaihtelee, niiden järjestysluku on sama. Kuten esimerkiksi hiili-14 on hiiliatomin radioaktiivinen isotooppi, jolla on kahdeksan neutronia.
vaikka tämä esitti Mendelejeville ongelman, koska taulukko riippui atomimassasta, se ei ole nykyaikaisen jaksollisen järjestelmän ongelma. Alkuaineiden kaikilla isotoopeilla ei ole erillisiä paikkoja pöydällä.
tiettyjen alkuaineiden Järjestys
Mendelejevin käyttäessä atomimassaa alkuaineiden järjestämiseen kohtasi toinen ongelma. Oli tiettyjä tapauksia, joissa oli rikkoa tämän järjestelyn niin elementtejä, joilla on samanlaisia ominaisuuksia olivat ryhmässä yhdessä. Otetaan esimerkiksi jodi ja telluuri. Nyt jodin atomimassa on pienempi kuin telluurin. Silti Mendelejev laittoi sen telluurin perään, jotta se voisi olla samassa ryhmässä fluorin ja kloorin kanssa.
nykyaikaisessa jaksollisessa järjestelmässä atomimassa muuttuu merkityksettömäksi ja alkuaineet ryhmitellään samanlaisiin alkuaineisiin niiden järjestysluvun perusteella.
harvinaiset maametallit
nykyaikainen Jaksollinen järjestelmä ratkaisi toisen ongelman sijoittamalla harvinaiset maametallit kuten ceriumin, lantaanin, erbiumin jne.erilliseen taulukkoon jaksollisen järjestelmän pohjalle, jotteivät ne häiritsisi jaksollista lakia.
ratkaistu esimerkki sinulle
Q: Kuinka monta 118: sta tunnetusta alkuaineesta esiintyy luonnollisesti?