kuinka paljon energiaa vapautuu ATP: n hydrolyysissä?
Reader Mode
ATP: tä kutsutaan usein solun energiavaluutaksi. Solussa tapahtuvat sadat reaktiot metabolisista muunnoksista signalointitapahtumiin kytkeytyvät ATP: n hydrolyysiin (kirjaimellisesti ”veden irtoaminen”) veden avulla . Reaktio ATP + H2O <> ADP + Pi muuntaa adenosiinitrifosfaatin (ATP) adenosiinidifosfaatiksi (ADP) ja epäorgaaniseksi fosfaatiksi (pi). Tähän reaktioon liittyvä vapaa energiamuutos ajaa suuren osan solureaktioista kalvopotentiaalin ja pelkistävän tehon ollessa kaksi muuta hallitsevaa energianlähdettä. Mutta minkä arvoinen tämä energiavaluutta tarkalleen ottaen on ja mitä se paljastaa kemikaalikaupoista, joita voi ostaa? Tähän kysymykseen ei tietenkään ole yhtä vastausta, koska tämän hydrolyysireaktion vapauttaman energian määrä riippuu solunsisäisistä olosuhteista, mutta on mahdollista saada käsitys tämän valuutan likimääräisestä ”arvosta” käyttämällä joitakin yksinkertaisia arvioita.

kuva 1: ATP: n hydrolyysin Gibbsin vapaan energian suhde standardiolosuhteissa tasapainovakioon ja hydrolyysin vapaan energian suhde fysiologisissa olosuhteissa fysiologisiin reaktanttien pitoisuuksiin.
ATP: n hydrolyysin aiheuttama Gibbsin vapaan energian muutos (ΔG) riippuu reaktion eri osallistujien pitoisuuksista Kuvan 1 mukaisesti. Kun pitoisuudet ovat kauempana tasapainoarvoistaan, ΔG: n itseisarvo on suurempi. ”Vakio-olosuhteissa” (ts. 1M: n pitoisuudet kaikkien reaktanttien osalta lukuun ottamatta vettä, joka otetaan sille ominaisella konsentraatiolla 55M) ATP: n hydrolyysin Gibbsin vapaa energia vaihtelee välillä -28 ja -34 kJ/mol (ts. ≈12 kBT, BNID 101989) kationin MG2+konsentraatiosta riippuen. Riippuvuus Mg-ioneista johtuu siitä, että positiivisesti varautuneet magnesiumionit auttavat stabiloimaan ATP-molekyyliä. Solussa olosuhteet eivät kuitenkaan koskaan ole edes lähellä normaalitilanarvoja. Esimerkiksi 1 m ATP: n pitoisuus tarkoittaisi, että liuottimen massa olisi samanlainen kuin itse vesiliuoksessa. Kuvassa 1 esitetään fysiologisen vapaan energian (ΔG) usein hämmentävä derivointi, kun otetaan huomioon pitoisuuksien suhde standardiarvosta (ΔGo). Jaottelu termeillä, joita tarvitaan, jotta voidaan huolehtia yksiköistä logaritmina, tulee aina sisältää yksikitön termi. Joskus on yllättävää ajatella, että jos solu olisi ollut tasapainotilassa, ΔG: n arvo olisi ollut nolla, eikä ATP: n hydrolyysillä olisi saatu energiaa. Onneksi näin ei ole koskaan elävien organismien kohdalla. .
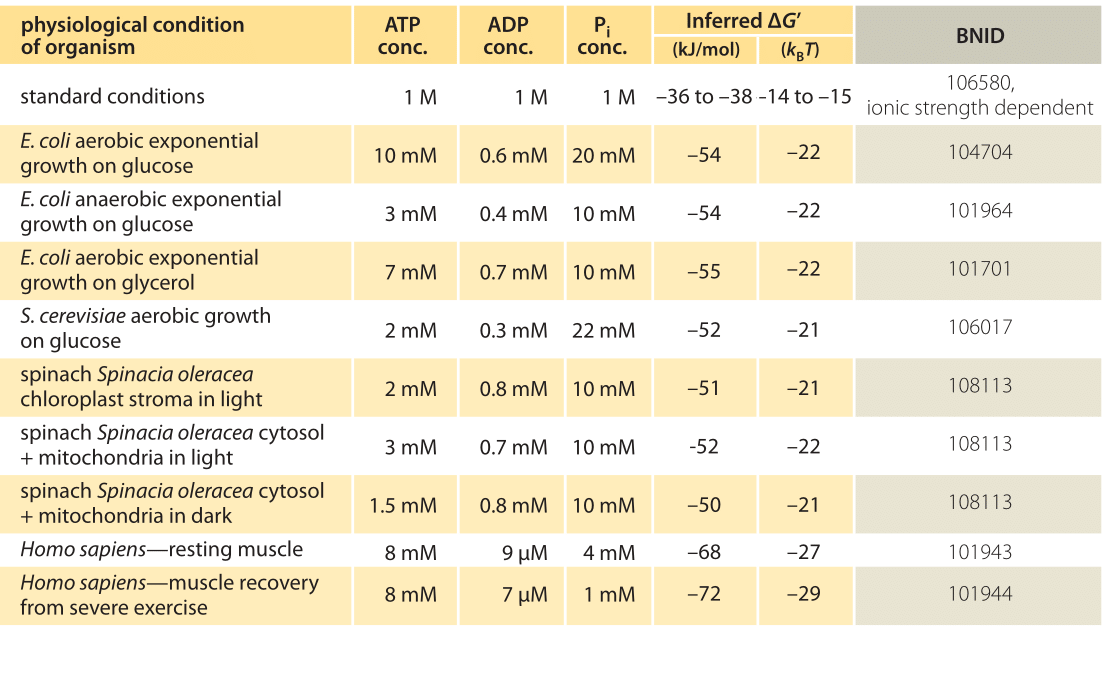
Taulukko 1: vapaa energia ATP: n hydrolyysiin eri eliöissä ja erilaisissa fysiologisissa olosuhteissa. Päätellyt ΔG ”- laskelmat, jotka perustuvat -37,6 kJ/mol: n arvoon ΔG’0. Tämä tekee taulukon arvoista keskenään yhdenmukaisia, mutta aiheuttaa pieniä poikkeamia PRIMAARILÄHTEISSÄ ilmoitetuista ΔG’ – arvoista. Tällaiset poikkeamat voivat johtua ionilujuuden, pH: n ja mittausmenetelmien harhojen vaihteluista. Arvot pyöristetään yhteen tai kahteen merkitsevään numeroon. Pinaatissa, jonka Piipitoisuuksia ei ilmoitettu, käytettiin 10 mM: n ominaisarvoa (BNID 103984, 103983, 111358, 105540).
käytännössä fysiologiset olosuhteet riippuvat tutkittavasta organismista, tutkittavan solun kudoksesta tai lokerosta sekä nykyisistä metabolisten ja muiden reaktioiden energiantarpeista. Esimerkiksi perfusoidussa rotan maksassa ATP:n ja ADP:n suhteen havaittiin olevan sytosolissa noin 10: 1 mutta mitokondrioissa 1: 10 korkeassa glykolyysissä, ja alhaisessa glykolyysissä molemmat suhteet olivat paljon lähellä 1: tä (BNID 111357). Tästä syystä ΔG: lle on odotettavissa vaihteluväli. Avain tämän vaihteluvälin ymmärtämiseen on saada käsitys siitä, kuinka paljon Q eroaa K: sta eli miten pitoisuudet eroavat standardiolosuhteista. Kaikkien merkityksellisten aineosien (ATP, ADP ja Pi) tyypilliset solunsisäiset pitoisuudet ovat mM-alueella, paljon pienempiä kuin standardiolosuhteissa. Suhde / pitoisuuksien kanssa mM-alueella on paljon pienempi kuin yksi, ja reaktio on energeettisesti suotuisampi kuin standardiolosuhteissa, kuten taulukossa 1 esitetään. Korkein arvo ≈-70 kJ / mol (≈30kbt) laskettiin rasituksesta toipuvien urheilijoiden ihmislihasten arvoista (BNID 101944). Glukoosiin kasvavissa E. coli-soluissa raportoitiin arvo -47 kJ / mol (≈20kbt, BNID 101964). Jotta nämä luvut saataisiin oikeisiin mittasuhteisiin, molekyylimoottori, joka tuottaa noin 5 pN: n (BNID 101832) voiman 10 nm: n (bnid 101857) porraskoon aikana, toimii 50 PN nm: n suuruisena ja vaatii hieman yli 10 KBT: n energiaa, hyvin sillä alueella, mitä yksi ATP voi tuottaa.
ΔG: n laskeminen edellyttää merkityksellisten solunsisäisten pitoisuuksien tarkkaa mittaamista. Tällaiset pitoisuudet mitataan in vivo ihmisillä ydinmagneettisella resonanssilla. Fosforin luonnollisella muodolla (31P) on magneettisia ominaisuuksia, joten mitään ulkoista ainetta ei tarvitse lisätä. Kiinnostava kudos, kuten lihas, on sijoitettu voimakkaaseen magneettikenttään ja radiopulssien taajuuden muutoksia käytetään päättelemään ATP: n ja pii: n pitoisuudet suoraan NMR-spektrien piikeistä. E. coli, ATP: n pitoisuudet voidaan mitata suoremmin ATP: n BIOLUMINESENSSIMÄÄRITYKSELLÄ. Viljelmästä poistetuista kasvavista bakteereista saatu näyte voidaan määrittää käyttämällä luciferaasia, joka on proteiini bakteereista, jotka elävät symbioosissa kalmukkien kanssa, mutta joka on tähän mennessä liittynyt biologien työkalupakkiin molekyylireportterina. Lusiferaasientsyymi käyttää reaktiossa ATP: tä, joka tuottaa valoa, joka voidaan mitata luminometrillä ja ATP-pitoisuus voidaan päätellä signaalin voimakkuudesta. Eli meillä on solusisältö syötteenä, lusiferaasi ”laitteena”, joka muuttaa ATP: n määrän valosäteilyksi, joka toimii mitattuna ulostulona. Tällaisten välineiden avulla voidaan todeta, että” tosielämässä ”ATP: n arvo on noin kaksi kertaa niin suuri kuin” normaaliolosuhteissa”, koska pitoisuudet ovat suotuisampia eteenpäin tapahtuvalle reaktiolle.
lopuksi toteamme, että on pysyvä kysymys, miksi adeniininukleotidi valittiin tärkeimmäksi energiavaluutaksi GTP: n ja muiden nukleotidien palvellessa paljon pienemmässä roolissa. Onko kyseessä sattumanvarainen valinta, joka myöhemmin muuttui ”jäätyneeksi onnettomuudeksi” vai oliko ATP: llä valikoiva etu verrattuna GTP: hen, CTP: hen, UTP: hen ja TTP: hen?




