- Introduction
- materiaalit ja menetelmät
- kannat
- DNA-uutto
- STX1 ja stx2 PCR-Amplifikaatiot
- DNA-sekvensointi
- Mikrotiitterilevyvalmisteet
- Soluttomat bakteerivalmisteet
- sytotoksinen määritys ja LD50-määritys
- salpaus-ja Toksiinineutralisaatiokoe
- OMVs: n hankinta ja DNA: n uuttaminen OMVs: stä
- tulokset
- stx1-ja stx2-geenin PCR-vahvistukset
- DNA-sekvensointi
- sytotoksinen määritys ja LD50-määritys
- toksiinin neutralisaatio
- stx1-geenin PCR-vahvistukset omvs: stä
- Keskustelu
- Tekijäosuudet
- Rahoitus
- Eturistiriitalausunto
- Kiitämme tohtori Patricia Arzate Barbosaa kannan isolaattien antamisesta ja tohtori Armando Navarroa monoklonaalisten vasta-aineiden antamisesta. lyhenteet
Introduction
useiden vuosien ajan, Aeromonas spp., koska ihmisen ripulia aiheuttava aine oli kiistanalainen; useat tutkimukset osoittivat, että aeromonasin patogeeninen mekanismi on monitekijäinen, koska monet virulenssitekijät ovat mukana, mukaan lukien sytotoksiinien tuotanto (Castro-Escarpulli et al., 2002, 2003). Nämä toksiinit voivat aiheuttaa ripulia tai hemorragista koliittia, ja niillä voi olla merkittävä rooli hemolyyttis-ureemisessa oireyhtymässä (HUS) ja TTP: n kehityksessä (Bogdanović et al., 1991; Fang et al., 1999; Monforte-Cirac ym., 2010).
näihin sairauksiin liittyviä sytotoksiineja ovat Shigatoksiini ja siihen läheisesti liittyvä Stx. Stx-variantteja ilmaistaan Shigella -, Enterobacter -, Citrobacter -, Acinetobacter -, Campylobacter-ja Hamiltonella-bakteerilajeilla (Mauro and Koudelka, 2011). Alperi and Figueras (2010) kuvaili Stx1: n ja Stx2: n esiintymistä Aeromonas spp: n kliinisissä isolaateissa., liittyy gastroenteriitti, hemorraginen koliitti, ja HUS. Näitä toksiineja koodaavat geenit sijaitsevat eri lambdoidisissa bakteriofageissa, jotka lysogenoivat tätä kantaa. Lisäksi ”Aeromonas” -suvulla on omvs-niminen nollaeritteinen järjestelmä. OMV: t voivat olla keino, jolla jotkin proteiinit, RNA, periplasmiset tilakomponentit ja muut virulenssiin liittyvät komponentit voidaan siirtää vaakasuoraan muihin sukuihin; siksi OMV: llä uskotaan olevan tärkeä rooli patogeenisyydessä (Guerrero-Mandujano ym., 2015a, b).
tästä syystä tämän tutkimuksen tavoitteena oli arvioida Mexico Cityn lapsista eristettyjen kantojen aiheuttaman Stx: n tuotannon aiheuttamia vaurioita Vero-soluviljelmissä.
materiaalit ja menetelmät
kannat
Tämä tutkimus sisälsi 66 kliinistä isolaattia INP: stä, 54 intestinaalista ja 12 suoliston ulkopuolisista infektioista. Kantoja eristettiin näytteistä, jotka oli saatu rutiinitestausta varten mainitussa sairaalassa, joten lasten vanhemmilta tai laillisilta huoltajilta ei vaadittu tietoon perustuvaa suostumusta. Kaikki kannat tunnistettiin geneettisesti 16S rDNA-RFLP: llä (Hernández-Cortez et al., 2011). Positiivisena kontrollina käytettiin Escherichia coli O157:H7 CECT 4076-bakteerin tyypitettyä kantaa ja toksiinin tuotannon negatiivisena kontrollina E. coli K12-kantaa (5512 ENCB) lääketieteellisen bakteriologisen laboratorion (Escuela Nacional de Ciencias Biologicas, IPN) kokoelmasta. Kannat säilytettiin lyhyitä aikoja huoneenlämmössä veriagaripohjaisilla vinoilla; pitempää säilytystä varten ne joko jäädytettiin -70°C: ssa 20%: ssa (w/v) glyseroli-Todd-Hewitt-lientä (Oksoidi, Meksiko) tai kylmäkuivattiin 7.5% hevosen glukoosiseerumia.
DNA-uutto
kaikki viljelmät kasvatettiin tryptisellä soija-agarilla 30°C: ssa 18 tunnin ajan. kunkin kannan genominen DNA saatiin InstaGene-matriisin (BioRad®, Meksiko) kautta valmistajan antamien ohjeiden mukaisesti. DNA: n puhtaus ja määrä määritettiin Ampli Quant Aq-07-spektrofotometrillä. DNA säilytettiin -20°C: ssa käyttöön asti.
STX1 ja stx2 PCR-Amplifikaatiot
stx1 ja stx2 PCR-Amplifikaatiot
stx1 ja stx2 havaittiin yksittäisillä PCR-reaktioilla käyttäen alukkeita STX1F/STX1R ja STXF / STXR 144 ja 217 bp tuotteella.nämä alukkeet suunniteltiin alayksikön a sekvenssin perusteella. alukkeet, reaktio ja amplifikaatio-olosuhteet käsiteltiin Hernández-Cortezin aiemmin kuvaamalla tavalla. et al. (2013) positiivisilla (E. coli O157:H7) ja negatiivisilla (E. coli K12) kontrolleilla.
DNA-sekvensointi
Polymeraasiketjureaktiotuotteet puhdistettiin PureLink Quick Gel Extraction Kit-Valmisteella (Invitrogen®, Meksiko) valmistajan ohjeiden mukaan. Tuotteet sekvensoitiin suoraan Abi-PRISM 310 Genetic Analyzer-laitteella (Applied Biosystems, Foster City, CA, USA) käyttäen PCR: ssä käytettyjä eteen-ja käänteisalusaineita valmistajan ohjeiden mukaisesti. Sekvensointi suoritettiin Instituto de Biología, UNAM (Meksiko). Sekvenssianalyysi tehtiin National Center for Biotechnology Informationin (NCBI) tarjoaman paikallisen linjauksen perustyökalun (BLAST) avulla.
Mikrotiitterilevyvalmisteet
tämä toimenpide tehtiin 96-kuoppaisissa Mikrotiittereissä Vero (ATCC CCL81) – solumonolikerroksella, jossa oli 80% yhtymäkohtaa, lisäämällä minimaalista välttämätöntä väliainetta (mem; Invitro®, Meksiko) täydennettynä 10% v / v sikiön naudan seerumilla (FBS; Invitro®, Meksiko).
solususpensio homogenoitiin ja säädettiin 105-106 soluun / mL Neubauer-kammiolla. Säätämisen jälkeen suspensio talletettiin 200 µL: n kuoppaan. Mikromuoveja inkuboitiin 37°C: n lämpötilassa 5% CO2: n alapuolella 24 tunnin ajan (CO2 Incubator, VWR Scientific, USA) (Giono-Cerezo et al., 1994).
Soluttomat bakteerivalmisteet
viisi pesäkettä jokaisesta veren agar-levystä inokuloitiin 3 mL: aan Craig-väliainetta (0, 4% hiivauutetta, 3% casamino-happoja, 0, 05% K2HPO4). Näitä inkuboitiin 24 tuntia 37°C: n lämpötilassa ja käytetyn bakteeriviljelmän optinen tiheys oli 0,25 600 nm: ssä. Soluttomat valmisteet tehtiin sentrifugoimalla viljelmiä 14 000 g: n lämpötilassa 10 minuutin ajan 4°C: ssa, minkä jälkeen supernatantti suodatettiin kalvosuodattimen läpi (huokoskoko 0,45 pm, Sartorius Minisart NML). Soluttomat supernatantit varastoitiin -20°C:ssa.näin saatiin yhteensä 66 solutonta bakteerivalmistetta; positiivinen kontrolli (E. coli O157: H7) ja negatiivinen kontrolli (E. coli K12) saatiin myös samalla tavalla (Giono-Cerezo et al., 1994).
sytotoksinen määritys ja LD50-määritys
soluton suodos (20 µL) inokuloitiin soluja sisältäviin kuoppiin ja vastaavaan kasvualustaan ilman antibiootteja. Inokuloituja soluja inkuboitiin 96 tunnin ajan 37°C: ssa 5% CO2: lla, ja ne havaittiin 24 tunnin välein käänteisellä mikroskoopilla. Sytotoksisen vaikutuksen odotettiin näyttäytyvän solujen pyöristymisenä ja kutistumisena paksulla rakeistumisella ja lopulta yksikerroksisen etenevänä ja peruuttamattomana tuhoutumisena. Kaikki testit tehtiin kahtena kappaleena; elinkelpoisuuskontrolleja tehtiin myös MEM: llä ja Craig-mediumilla (Giono-Cerezo et al., 1994).
LD50 määritettiin Aeromonas-kannoista, joiden todettiin aiheuttavan sytotoksisia vaurioita Vero-soluissa. Standardi 96-kuoppainen Mikrotiitteri, jossa oli Vero-kennoja, valmistettiin 2.6 kohdan mukaisesti, mutta väliaine muutettiin 100 µL: aan MEM: tä 1% BFS: llä. Valmisteelle altistettiin 100 µL solutonta bakteerivalmistetta, ja sarjalaimennoksia tehtiin koko levyriville. LD50 määritettiin käänteisellä mikroskoopilla 24 tunnin inkubaation jälkeen 37°C: ssa, jossa on 5% CO2: ta. LD50 määrättiin kaivoon, jossa 50% Vero-soluista oli vaurioitunut ja 50% vahingoittumaton (Marques et al., 1986).
salpaus-ja Toksiinineutralisaatiokoe
toksiinin neutralisointikoe tehtiin kannoille, jotka aiheuttivat sytotoksisia vaurioita Vero-soluissa, koska tämä vaurio viittaa Stx: ään. Tätä testiä varten valmistettiin mikrotiitteri, jossa Vero-solu kasvoi 90-100%: n yhtymäkohtaan kunkin soluttoman bakteerivalmisteen LD50: n kanssa. Neutralisaatiokokeessa, jossa osoitettiin Stx:n vaikutuksesta syntyneitä soluvaurioita, käytettiin kahta E. coli O157: H7: stä saatua monoklonaalista vasta-ainetta (Universidad Nacional Autónoma de México).
kunkin Ab: n osalta Bradford-proteiinin määritys tehtiin valmistajan ohjeiden (Bioradi) mukaisesti, ja tuloksena oli vastaavasti anti-Stx1 ja anti-stx2 a 78, 2 µg / µL.väkevöity Ab työstettiin ja Ab laimennettiin kaksinkertaiseksi. Tämän jälkeen 10 µL Ab: ta (anti-STX1 tai anti-stx2) inkuboitiin 190 µL: lla solutonta supernatanttia LD50-pitoisuutena 1 tunnin ajan 37°C: ssa.tämän jälkeen 200 µL jälkimmäistä inokuloitiin Vero-soluihin 90%: n yhtymäkohdassa ja inkuboitiin 24 tunnin ajan 37°C: ssa 5%: n CO2: lla (Marques et al., 1986).
OMVs: n hankinta ja DNA: n uuttaminen OMVs: stä
Ulkokalvorakkulat saatiin Aeromonas hydrophila F-0050: stä. Protokolla suoritettiin kuten Guerrero-Mandujano et al. (2015a).
OMVs: n DNA saatiin InstaGene-matriisin (BioRad®, Meksiko) kautta valmistajan antamien ohjeiden mukaisesti. Tämän jälkeen OMVs: n DNA puhdistettiin DNA-uuttamalla fenoli-kloroformitekniikalla (Guerrero-Mandujano et al., 2015b).
tulokset
stx1-ja stx2-geenin PCR-vahvistukset
Polymeraasiketjureaktioseulonta 66 kliinisestä Aeromonas-kannasta osoitti, että 22/66 (33, 3%) kanta sisälsi stx1-geenin, 42/66 (63, 6%) kanta sisälsi molemmat geenit, yksikään kanta ei sisältänyt vain stx2-geeniä ja 2/66 (3%) kanta oli negatiivinen molempien geenien osalta.
DNA-sekvensointi
BLASTn-analyysi osoitti 79-99%: n samankaltaisuuden ja odotusarvon 3e-16/2e-97 E. coli O157: H7: n STX-1 / stx-2-geenien ja Aeromonas spp: n amplikonin välillä., kanta.
sytotoksinen määritys ja LD50-määritys
Vero-soluviljelmillä tehty sytotoksisuustesti osoitti, että 17/66 (25, 7%) soluttomat bakteerivalmisteet aiheuttivat sytotoksisia vaurioita, mikä viittaa aktiivisen Stx: n muodostumiseen (Kuva 1), mikä ilmenee Stx: n aiheuttamasta ominaisvauriosta.
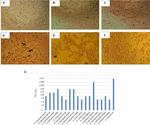
kuva 1. Sytotoksisuusmääritys ja LD50-määritys Vero-soluviljelmillä. A) Vero-soluviljelmä minimaalisella välttämättömällä väliaineella (Elinkelpoisuustesti). B) Vero cell culture with Craig Medium (Elinkelpoisuustesti). C) negatiivinen kontrolli E. coli K12: lla. (D) positiivinen kontrolli E. coli O157: H7: llä, sytotoksinen vaurio osoitetaan (nuolet) tuhoamalla solun yksikerros ja ”vanha pitsi” – vaikutus. (E) A. hydophila F-0050-kannan sytotoksinen vaurio. F) A. caviae 421423-kannan sytotoksinen vaurio. G) graafinen esitys kaikkien kantojen LD50-titteristä.
LD50-titterin määritystulokset olivat seuraavat: 6 / 17 (35, 2%) soluttomien bakteerivalmisteiden titteri oli 1:16; 5 / 17 (29, 4%) soluttomien bakteerivalmisteiden titteri oli 1:8; 3 / 17 (17, 6%) soluttomien bakteerivalmisteiden titteri oli 1:64; 2 / 17 (11, 7%) soluttomien bakteerivalmisteiden titteri oli 1:1:32; ja 1/17 (5, 8%) soluttomia bakteerivalmisteita, joiden titteri on 1: 256 (kuva 1g).
toksiinin neutralisaatio
anti-STX1 Ab: n käyttö 11/17 (64.7%) kannat supernatantin soluvauriot estyivät täysin pitoisuudella 39, 1 µg/µL Ab; 4/17 (23, 5%) soluttomilla bakteerivalmisteilla havaittiin soluvaurioiden vähentymistä samalla pitoisuudella; ja 2/17 (11, 7%) soluttomilla bakteerivalmisteilla soluvauriot estyivät täysin pitoisuudella 78, 2 µg/µL. AB anti-STX2: n käyttö osoitti, että 9/17: ssä (52,9%) soluttomissa bakteerivalmisteissa soluvauriot estyivät täysin 37,4 µg/µL: ssa ja 6/17: ssä (35,2%) soluttomissa bakteerivalmisteissa soluvauriot vähenivät samalla pitoisuudella; ja 2/17: ssä (11.7%) soluttomat bakteerivalmisteet, soluvauriot estyivät täysin Ab-pitoisuudella 74, 8 µg/µL (Kuvat 2 ja 3).

kuva 2. Aeromonas spp: n soluttomien bakteerivalmisteiden aiheuttama sytotoksisen vaikutuksen estäminen Vero-soluviljelmässä. kantoja, joissa on stx1 – tai stx2-geeni.
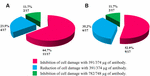
kuva 3. Niiden kantojen prosenttiosuus, jotka estivät tai vähensivät soluvaurioita. (A) neutralisointi anti-Stx1 Ab: llä. (B) neutralisointi anti-Stx2 Ab: llä.
stx1-geenin PCR-vahvistukset omvs: stä
polymeraasiketjureaktio OMVs: n DNA: sta A. hydrophila F-0050 paljasti OMVs: n sisältävän gen stx1: n; näin OMVs saattaa olla potentiaalinen kantaja horisontaalisessa virulenssigeenien siirrossa (Kuva 4).
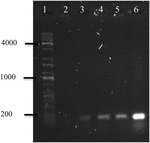
kuva 4. Elektroferogrammi Stx1-geenin amplifikaatiosta OMV: n DNA: sta. (1) Kapa Universal Ladder, (2) Negative control, (3) omvs of A. hydrophila F-0050, (4) A. hydrophila F-0050, (5) OMVs of E. coli O157:H7 ja (6) E. coli O157:H7.
Keskustelu
suku Aeromonas voi Stx: n tuottajana olla emergentti patogeeni, joka aiheuttaa ripulia lähinnä lapsipotilailla (Hernández-Cortez ym., 2011; Figueras ja Baez-Hidalgo, 2014). Kuitenkin tämä suku on tullut enemmän merkitystä lääketieteen alalla, koska se on taudinaiheuttaja aiheuttaa HUS (San Joaquín ja Pickett, 1988; Bogdanović et al., 1991; Robson ym., 1992; Fang et al., 1999; Monforte-Cirac ym., 2010).
tässä tutkimuksessa havaittiin STX1-ja stx2-geenien PCR-monistuksella, että 22/66 (33.3%) aeromonadin kannoista sisälsi stx1-geenin, 42/66 (63,6%) kannat sisälsivät molemmat geenit, eikä yhtäkään kantaa sisältänyt pelkästään stx2: ta. Tämä voi johtaa siihen, että geeni leviää laajalti lapsipotilailta eristetyissä Aeromonas-kannoissa ja että nämä potilaat voivat olla vaarassa sairastua HUS: iin.
on vain yksi aikaisempi raportti, jossa stx-geenejä tutkittiin Aeromonas-kannoissa, jotka on eristetty eri sairaaloista Espanjassa; saadut tulokset olivat, että 19/80 (23, 7%) kannassa oli stx1-geeni ja vain 1/80 (1.25%) kanta oli positiivinen molemmille geeneille (Alperi ja Figueras, 2010). Nämä tulokset osoittavat, että geeni jakautuu enemmän meksikolaisiin kantoihin.meidän olisi kuitenkin otettava huomioon, että Espanjassa Aeromonas-suku on tunnettu maha-suolikanavan taudinaiheuttaja, joka eristetään rutiininomaisesti potilailla, joilla on maha-suolikanavan profiili.
Meksikossa tämä suku ei sisälly ripulia aiheuttavien taudinaiheuttajien luetteloon, eikä sitä eristetä rutiininomaisesti; tämän vuoksi potilaille on vaikea antaa minkäänlaista hoitoa ja hyvää elämänlaatua; lisäksi sen yleisyydestä ei ole tilastoja. Lisäksi suvun merkitys kasvaa Meksikolaisväestön sosioekonomisten olojen, joihin kuuluu vesipula, vuoksi; tämä helpottaa sen leviämistä ja lisää Husin mahdollisuutta tulla kansanterveydelliseksi ongelmaksi.
amplikonit sekvensoitiin ja suoritettiin Blastitutkimus, jossa todettiin 79-99% samankaltaisuus ja odotusarvo 3e-16/2e-97 geenien stx1 / stx2 välillä verrattuna E. coli O157:H7-bakteeriin.
LD50 määritettiin sytotoksisten vaurioiden arvioimiseksi Vero-soluviljelmässä; tämän parametrin perusteella ja perustuen Marquesiin et al. (1986), kannat voidaan ryhmitellä Alhainen (2 × 101-6 × 102), kohtalainen (103-104), ja korkea (105-108) tuotanto (Kuva 1G). Marques ym. (1986) teki tutkimuksen, jossa he tekivät samanlaisen määrityksen kuin tässä tutkimuksessa, mutta STEC: n eri kannoilla he saivat selville, että 262/400 (63%) kantaa oli ryhmitelty alhaisen Stx: n tuottajiksi ja 48% aiheutti sytotoksisia vaurioita.; tästä huolimatta 40%: ssa näistä kannoista sytotoksiset vauriot estettiin anti-Stx-vasta-aineilla.
tässä tutkimuksessa 25, 7% bakteerittomista valmisteista aiheutti Stx: lle ominaisia sytotoksisia vaurioita Vero-soluissa, mikä viittaa aktiivisen Stx: n tuottamiseen, kaikki Aeromonas-kannat ryhmiteltiin STX: n tuottajiksi, jotka olivat alhaisia; kuitenkin 50-70%: ssa soluttomista supernatanteista soluvaurio estyi ja 20-30%: ssa soluttomista supernatanteista soluvauriot vähenivät (kuva 3). Soluttomat supernatantit, joissa soluvauriot vähenivät, saattoivat johtua supernatantissa olevan toksiinin kahdesta muunnoksesta, joten koska ne ovat erilaisia immunologisesti, Stx: ää ei voitu täysin estää ja soluvauriot säilyivät (Marques et al., 1986).
kaksi aiempaa tutkimusta (Haque et al., 1996; Alperi ja Figueras, 2010) stx1: tä tuottavista Aeromonas-kannoista saatiin 10,2% ja 10,53%. Syy aktiivista Stx-bakteeria tuottavien Aeromonas-kantojen suurempaan prosenttiosuuteen voi johtua STX-bakteriofagin korkeasta saatavuudesta viljelmän sisällä, sillä joitakin STX-bakteriofagia kantavia STEC-kantoja on eristetty yhdyskuntajätevedestä puhdistamoista, jätevedestä teurastamoista ja karjan ulosteista (García-Aljaro ym., 2004, 2009). Samoin transduktiotutkimuksia on tehty in vivo E. coli-bakteerin Stx-fageilla, jotka voivat infektoida suoliston mikrobeja, mikä antaa toksigeenisen ominaisuuden kannoille, jotka eivät olleet infektoituneet aiemmin (Acheson ym., 1998; Schmidt et al., 1999; Gamage et al., 2003). Sama voisi tapahtua Aeromonas-suvulle, kun se indusoi ruoansulatuskanavan Profiilin, minkä jälkeen se, että Aeromonas-suvulla on kyky kaapata ja integroida virulenssitekijöitä genomiinsa, ja yksi näistä on Stx-koodaava geeni.
loput kannat aiheuttivat sytotonisia vaurioita solussa, mikä mahdollisesti viittaa muiden toksiinien kuin Stx: n tuotantoon, koska Aeromonas on suku, joka kykenee tuottamaan kahta Sytotonista enterotoksiinia, thermostable (ASAT) ja thermolabile (ALT) (Figueras and Baez-Hidalgo, 2014), jotka voivat aiheuttaa sytotonisia vaurioita Vero-soluissa.; toinen mahdollisuus on, että Aeromonas-kannoilla on enemmän kuin yksi bakteriofagi niiden genomissa, koska on osoitettu, että STEC-kannat, joilla on kaksinkertainen lysogenia, pystyvät säätelemään bakteriofageja estämään lystisen syklin induktion kapasiteettia, mikä johtaa STX: n tuotannon vähenemiseen, mutta geenin menettämättä (García-Aljaro et al., 2004; Imamovic ja Muniesa, 2011). Sen vuoksi on tarpeen määrittää, kuinka monta bakteriofagia Aeromonas-kannat sisältävät, myös tässä tutkimuksessa, jotta voidaan korreloida Stx-bakteriofagien esiintyminen ja tuotettu Stx-määrä.
toisaalta STX-bakteriofagien esiintyminen indusoituvassa Aeromonasissa edustaa STX-geenin horisontaalista siirtomekanismia, mutta se ei ole ainoa. Uudemmissa tutkimuksissa on todettu, että Aeromonat kykenevät tuottamaan OMV: tä (Guerrero-Mandujano et al., 2015a) ja nämä OMV: t pystyvät kuljettamaan integroitua DNA: ta (Guerrero-Mandujano et al., 2015b). Tässä tutkimuksessa vahvistimme stx1-geenin kliinistä alkuperää olevan A. hydrophila-kannan OMVs: stä erotetusta DNA: sta, joka aiheutti sytotoksisia vaurioita Vero-soluissa, ja tämä vaurio estettiin anti-Stx-vasta-aineilla. Tämä osoittaa, että STX-bakteriofagi on STX-geenin kuljetusmekanismi; lisäksi OMV: t ja äskettäin kutsuttu Kuljetusjärjestelmätyyppi 0 kykenevät levittämään STX-geenin lajien välistä eli intraspecies-geeniä. On kuitenkin varmistettava, onko OMVs: n sisältämä geeni täydellinen. Tässä tutkimuksessa saadut tulokset tukevat hypoteesia, jonka mukaan stx-geeni on toinen aeromonasin oletettu virulenssitekijä, joka saattaa siirtyä OMV: n kautta. Se voisi edustaa toista mekanismia, jolla stx-geeni siirtyy horisontaalisesti muihin Aeromonas-kantoihin ja/tai muihin bakteerisukuihin.
tästä syystä tämä suku tulisi sisällyttää gastroenteriitin mahdollisena aiheuttajana pyrittäessä tunnistamaan syy-aiheuttajia, ja se tulisi ilmoittaa osana tavanomaisia terveydentilan seurantamenetelmiä.
Tekijäosuudet
IP-M ja AG-m suorittivat kokeet ja MR-R suorittivat bioinformatiikan analyysit ja laativat käsikirjoituksen; CH-C suunnitteli pohjustuksen; VB-G ja JM-L kommentoivat ja tarkistivat käsikirjoitusta kriittisesti; GC-E suunnitteli tutkimuksen, osallistui sen suunnitteluun ja koordinointiin, arvioi tiedot ja laati käsikirjoituksen. Kaikki kirjoittajat lukivat ja hyväksyivät lopullisen käsikirjoituksen. Haluamme kiittää Sofia Marteli Mulia siitä, että hän on ystävällisesti korjannut käsikirjoituksen tyylin.
Rahoitus
GC-E ja VB-g saivat tukea Estímulos al Desempeño en Investigaciónilta ja Comisión y Fomento de Actividades Académicasilta (Instituto Politécnico Nacional) ja Sistema Nacional de Investigadoresilta (SNI, CONACyT). Tutkimuksen rahoitti kansallisen polyteknisen instituutin tutkimus-ja jatko-Opintosihteeristö (SIP 20160609). SIP-IPN ei osallistunut tutkimuksen suunnittelun kehittämiseen, tietojen keräämiseen, analysointiin ja tulkintaan, raportin kirjoittamiseen eikä päätökseen toimittaa paperi julkaistavaksi. IP-M ja AG-M saivat stipendin Conacytilta ja BEIFILTÄ.
Eturistiriitalausunto
kirjoittajat toteavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, joita voitaisiin pitää mahdollisena eturistiriitana.
Ab, vasta-aine; Hus, hemolyyttis-ureeminen oireyhtymä; INP, Instituto Nacional de Pediatria Mexico; LD50, letaalin annoksen mediaani; OMVs, Outer membrane vesicles; PCR, Polymerase chain reaction; STEC, Shiga toxin-producing E. coli; Stx, Shiga-like toxin; TTP, Thrombotic thrombocytopenic purpura.
Acheson, D. W., Reidl, J., Zhang, X., Keusch, G. T., Mekalanos, J. J., and Waldor, M. K. (1998). In vivo transduction with shiga toxin 1-encoding phage. Infect. Immun. 66, 4496–4498.
Google Scholar
Alperi, A., and Figueras, M. J. (2010). Ihmisen isolaatit Aeromonas omistaa shiga toksiini geenit ovat (stx1 ja stx2) hyvin samanlaisia bridge virulent geenimuunnokset Escherichia coli. Clin. Mikrobiolia. Tartuttaa. 16, 1563-1567. doi: 10.1111 / j.1469-0691.2010. 03203.x
CrossRef Full Text | Google Scholar
Bogdanovic, R., Čobeljić, M., Markovic, M., Nikolic, V., Ognjanović, M., Sarjanović, L., et al. (1991). Hemolyyttis-ureeminen oireyhtymä, johon liittyy Aeromonas hydrofila enterokoliitti. Pediatr. Nefrolia. 5, 293-295. doi: 10.1007
CrossRef Full Text | Google Scholar
Castro-Escarpulli, G., Aguilera-Arreola, M. G., Giono-Cerezo, S., Hernández-Rodríguez, C. H., Rodriguez-Chacon, M., Soler, F. L. ym. (2002). Suku Aeromonas > tärkeä taudinaiheuttaja Meksikossa? Enf. Infec. Mike. 22, 206–216.
Google Scholar
Castro-Escarpulli, G., Figueras, M. J., Aguilera-Arreola, M. G., Soler, L., Fernández-Rendón, E., Aparicio, G. O., et al. (2003). Aeromonas spp: n Luonnehdinta eristetty ihmisravinnoksi tarkoitetusta jäädytetystä kalasta Meksikossa. Int. J. Elintarvikemikrobioli. 84, 41–49. doi: 10.1016/S0168-1605(02)00393-8
CrossRef Full Text | Google Scholar
Fang, J. S., Chen, J. B., Chen, W. J., and Hsu, K. T. (1999). Hemolyyttis-ureeminen oireyhtymä aikuisella miehellä, jolla on Aeromonas hydrophila enterokoliitti. Nefrolia. Pikavalinta. Elinsiirto. 14, 439–440. doi: 10.1093/ndt/14.2.439
CrossRef Full Text | Google Scholar
Figueras, M. J., and Baez-Hidalgo, R. (2014). ”Aeromonas”, teoksessa Encyclopedia of Food Microbiology, eds C. A. Batt ja M. L. Tortorello (Cambridge, MA: Academic Press), 24-30.
Gamage, S. D., Strasser, J. E., Chalk, C. L., and Weiss, A. A. (2003). Nonpatogeeninen Escherichia coli voi edistää shigatoksiinin tuotantoa. Tartuttaa. Immun. 71, 3107–3115. doi: 10.1128 / IAI.71.6.3107-3115.2003
CrossRef Full Text | Google Scholar
García-Aljaro, C., Muniesa, M., Jofre, J., and Blanch, A. R. (2004). Stx2-geenin esiintyvyys vesiympäristöistä peräisin olevissa koliformisissa populaatioissa. Appl. Environ. Mikrobiolia. 70, 3535–3540. doi: 10.1128 / AEM.70.6.3535-3540.2004
CrossRef Full Text | Google Scholar
García-Aljaro, C., Muniesa, M., Jofre, J., and Blanch, A. R. (2009). Genotyyppi-ja fenotyyppidiversiteetti ympäristön Escherichia coli-kannoista peräisin olevien indusoitujen, stx2: ta kantavien bakteriofagien keskuudessa. Appl. Environ. Mikrobiolia. 75, 329–336. doi: 10.1128 / AEM.01367-08
CrossRef Full Text/Google Scholar
Giono-Cerezo, S., Rodríguez-Ángeles, M. G., Rodríguez-Cadena, M. J., and Valdespino-Gómez, J. L. (1994). Escherichia coli-bakteerin enterotoksiinien ja sytotoksiinien tunnistaminen vero-soluviljelmällä ja solid-faasi-hybridisaatiolla (colony blot). Pastori Latinoam. Mikrobiolia. 36, 231–241.
Google Scholar
Guerrero-Mandujano, A., López-Villegas, E. O., Longa-Briseño, A., and Castro-Escarpulli, G. (2015a). Ulompien kalvorakkuloiden tuotanto Aeromonas hydrophila-bakteerin kliinisessä kannassa. EC Microbiol. 1, 113–117.
Google Scholar
Guerrero-Mandujano, A., Palma-Martínez, I., and Castro-Escarpulli, G. (2015b). Kuljettaa DNA: ta Aeromonas hydrophilan ulkokalvorakkuloiden avulla. EC Microbiol. 2, 354–357.
Google Scholar
Haque, Q. M., Sugiyama, A., Iwade, Y., Midorikawa, Y., and Yamauchi, T. (1996). Aeromonas spp.: n ripulitaudit ja ympäristö isolaatit tuottaa Shigan kaltaista toksiinia muistuttavaa toksiinia 1. Kurr. Mikrobiolia. 32, 239–245. doi: 10.1007/s002849900043
CrossRef Full Text | Google Scholar
Hernández-Cortez, C., Aguilera-Arreola, M. G., Chávez-Méndez, Y., Arzate-Barbosa, P., Lara-Hernandez, A., and Castro-escarpulli, G. (2011). Aeromonas spp: n kantojen geneettinen tunnistaminen eristettynä National institute of pediatricsissa. Pastori Enfer. Infecc. Lapsipotilas. 24, 157–165.
Google Scholar
Hernández-Cortez, C., Méndez-Tenorio, A., Aguilera-Arreola, M. G., and Castro-Escarpulli, G. (2013). Neljän multiplex-polymeraasiketjureaktion suunnittelu ja standardointi ruoansulatuskanavan sairauksia aiheuttavien bakteerien havaitsemiseksi. Afr. J. Microbiol. Res. 7, 2673-2681. doi: 10.5897/AJMR2013.5452
CrossRef Full Text | Google Scholar
Imamovic, L., and Muniesa, M. (2011). Quantification and evaluation of infectivity of shiga toxin-encoding bacteriophages in beef and salad. Appl. Environ. Mikrobiolia. 77, 3536–3540. doi: 10.1128 / AEM.02703-10
CrossRef Full Text / Google Scholar
Marques, L. R. M., Moore, M. A., Wells, J. G., Wachsmuth, I. K., and O ’ Brien, A. D. (1986). Escherichia coli tuottaa Shigan kaltaista toksiinia. J. Infect. Tämä. 154, 338–341. doi: 10.1093/infdis/154.2.338
CrossRef Full Text | Google Scholar
Mauro, S. A., and Koudelka, G. B. (2011). Shiga toxin: ilmaisu, jakelu, ja sen rooli ympäristössä. Toksiinit 3, 608-625. doi: 10.3390 / toxins3060608
CrossRef Full Text / Google Scholar
Monforte-Cirac, M. L., Palacian-Ruiz, M. P., Aisa-Iriarte, M. L., ja Espuelas-Monge, M. (2010). Hemolyyttinen ureeminen oireyhtymä Aeromonas: noin kliininen tapaus. Pastori Clin. Henki. 210, 206–207. doi: 10.1016 / J. cer.2009.08.002
CrossRef Full Text/Google Scholar
Robson, W. L. M., Leung, A. K. C., and Trevenen, C. L. (1992). Hemolyyttis-ureeminen oireyhtymä, johon liittyy Aeromonas hydrofila enterokoliitti. Lapsipotilas. Nefrolia. 6, 221–222. doi: 10.1007
CrossRef Full Text / Google Scholar
San Joaquin, V. H., and Pickett, D. A. (1988). Aeromonas – liittyvä gastroenteriitti lapsilla. Pediatr. Tartuttaa. Tämä. J. 7, 53-57. doi: 10.1097/00006454-198801000-00013
CrossRef Full Text | Google Scholar
Schmidt, H., Bielaszewska, M., and Karch, H. (1999). Enteristen Escherichia coli-isolaattien transduktio, joka sisältää Escherichia coli O157:H7-bakteerista eristetyn shigatoksiinia 2 koodaavan bakteriofagin f3538 johdannaisen. Appl. Environ. Mikrobiolia. 65, 3855–3861.
Google Scholar