det er ikke let at bestemme visse parametre såsom størrelse, længde og vinkel i atomskala. På grund af de vigtige af disse parametre har forskere udviklet metoder til at udlede eller beregne parametrene i atomniveau. Bindingsrækkefølge og bindingslængde er to så vigtige parametre, der angiver typen og styrken af bindinger mellem et par atomer.
denne artikel forklarer,
1. Hvad er Obligationsrækkefølge og Obligationslængde
2. Sådan beregnes Obligationsordre og Obligationslængde
– Sådan beregnes Obligationsordre
– Sådan beregnes Obligationslængde
Hvad er Obligationsordre og Obligationslængde
Obligationslængde og obligationsordre er to parametre, der er forbundet med kovalente bindinger. Bindingsrækkefølge er antallet af kemiske bindinger mellem to atomer, og bindingslængden er afstanden mellem to kerner af atomer, der er kovalent bundet sammen. Denne artikel forklarer, hvordan man beregner bindingsrækkefølge og bindingslængde på et atomniveau.
Sådan beregnes Bindingsrækkefølge
Bindingsrækkefølge er antallet af kemiske bindinger mellem to atomer. Det angiver stabiliteten af en binding. I kovalente bindinger er bindingsrækkefølgen antallet af delte elektroner. For eksempel er bindingsrækkefølgen af et par atomer bundet af en enkelt binding En, mens bindingsrækkefølgen af et par atomer bundet af en dobbeltbinding er to. Nulbindingsrækkefølge indikerer, at der ikke er nogen binding mellem atomer. Stabiliteten af et molekyle øges med stigende bindingsrækkefølge. Molekylerne med resonansbinding behøver ikke at være et heltal. I kovalente forbindelser med to atomer bestemmes bindingsrækkefølgen mellem et par atomer ved først at tegne strukturen og derefter bestemme typen af bindinger mellem atomerne – nulbinding, enkelt, dobbelt eller tredobbelt binding. For eksempel bestemmes bindingsrækkefølgen af hydrogengas som følger.
- tegn strukturen
H: H
- Bestem antallet af bindinger/par valenselektroner
et par elektroner, derfor er bindingsrækkefølgen 1.
hvis der er mere end to atomer, bestemmes bindingsordren som følger. Se eksemplet: nitration.
- tegn strukturen
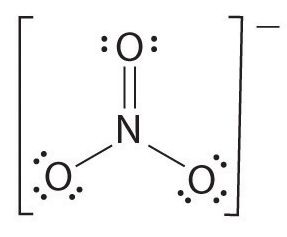
- Tæl det samlede antal obligationer (ifølge nitration, dets 4)
- antallet af bindingsgrupper mellem individuelle atomer (ifølge ammoniak, dets 3)
- derfor er bindingsrækkefølgen = samlet antal bindinger/ antal bindingsgrupper
= 4/3
= 1,33
derfor er bindingsrækkefølgen for nitration 1.33
Sådan beregnes Bindingslængde
Bindingslængde er afstanden mellem to kerner af atomer, der er kovalent bundet sammen. Bond længde er normalt i området fra 0,1 til 0,2 nm. Når to lignende atomer er bundet sammen, kaldes halvdelen af bindingslængden kovalent radius. Bindingslængden afhænger af antallet af bundne elektroner af to atomer eller bindingsrækkefølgen. Højere bindingsrækkefølgen, kortere bindingslængden skyldes stærke trækkræfter af positivt ladede kerner. Enheden af bindingslængde er picometer. I enkelt -, dobbelt-og tredobbeltbindinger øges bindingslængden i størrelsesordenen
tredobbelt binding<dobbeltbinding<enkeltbinding
elektronegativitet kan bruges til at beregne bindingslængde mellem to atomer med forskellige elektronegativiteter. Følgende empiriske formel blev foreslået af Shoemaker og Stevenson for at beregne bindingslængden.
dA-b = rA + rB-0.Da – B er bindingsafstand mellem to atomer A og B, rA og rB er kovalente radier af A og B, og
er elektronegativitetsforskel mellem A og B.
en anden metode bruges til at beregne den omtrentlige bindingslængde. I denne metode tegnes den første struktur for at bestemme den kovalente bindingstype. Brug derefter et diagram* lavet på undersøgelserne udført af Cordero et al. og Atsumi, bestemmes de tilsvarende radier af bindingerne lavet af hvert atom. Derefter bestemmes bindingslængden ved at tage summen af de to radier. For eksempel, når man bestemmer bindingslængden af kulsyre, tegnes den første Luvisstruktur.
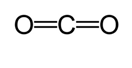
ifølge diagrammet er den kovalente radius af carbon dobbeltbinding 67 picometre, og den af ilt dobbeltbinding er 57 picometre. 124 picometre (57 pm+ 67 pm).
*kovalent diagram findes her
Reference:
Cordero, Beatrice, et al. “Kovalente radier revisited.”Dalton Transaktioner 21 (2008): 2832-2838.
Libretekster. “Bond orden og længder.”Kemi Libretekster. Bøger, 05 Dec. 2016. Web. 10 Jan. 2017.
Lister, Ted og Janet Rensha. Forståelse af kemi til avanceret niveau. N. p.: Nelson Thornes, 2000. Udskrive.
Pratiyogita Darpan. “Egenskaber af elementer i forhold til deres elektroniske struktur .”Konkurrence Videnskab Vision Aug. 1998: n. pag. Udskrive.Pyykk, Pekka og Michiko Atsumi. “Molekylær dobbeltbinding kovalente radier for grundstoffer Li-E112.”Kemi-Et Europæisk Tidsskrift 15.46 (2009): 12770-12779.
![]()