den primære struktur af et protein defineres som sekvensen af aminosyrer, som den er sammensat af. Denne sekvens bestemmer i sidste ende den form, som proteinet vedtager, i henhold til de rumlige begrænsninger på arrangementet af atomerne i proteinet, de kemiske egenskaber af komponentens aminosyrerester og proteinets miljø.
peptidbindingerne, der forbinder aminosyrerester i et polypeptid, dannes i en kondensationsreaktion mellem den sure carboksyl-gruppe af en aminosyre og den basiske aminogruppe af en anden aminosyre. I forbindelse med et peptid kaldes amidgruppen (CO–NH) peptidgruppen.
afgørende for en forståelse af proteinstruktur er en viden om strukturen af peptidbindingen. Linus Pauling brugte i 1930 ‘ erne røntgendiffraktion til at undersøge arten af peptidbindingen dannet mellem to aminosyrer. Han rapporterede, at peptidgruppen (CO–NH) har en stiv plan struktur. Denne struktur skyldes interaktioner mellem elektroner af carbonylgruppens dobbeltbinding og C–N-bindingens (figur 2), således at sidstnævnte erhverver delvise (ca.40%) dobbeltbindingsegenskaber.

denne effekt er et eksempel på resonans, som kan betragtes som en deling af elektroner mellem bindinger. Da enkeltbindinger mellem to atomer er længere end dobbeltbindinger mellem de samme to atomer, adskiller længderne af C–N og C=O bindingerne i peptidgruppen sig fra dem, der observeres for disse bindinger i andre sammenhænge, hvor resonans ikke forekommer. Således betyder den delvise dobbeltbindingskarakter af C–N i peptidgruppen, at denne binding er kortere end forventet for en C–N-enkeltbinding, mens C=O-bindingen, der har en delvis enkeltbindingskarakter på grund af resonans, er længere end forventet for en c=o-dobbeltbinding. Bindingslængderne i peptidgruppen er angivet i figur 3. C–n-bindingen af peptidgruppen sammenlignes med den mellem N og Ca (C-atomet, som aminogruppen og carboksyl-gruppen er bundet til).

Der er to mulige konformationer af den plane peptidbinding: i trans-peptidgruppen er Ca-atomerne på modsatte sider af peptidbindingen (figur 3a), og i cis-peptidgruppen er Ca-atomerne på samme side af peptidbindingen (figur 3b).
-
i betragtning af det rumlige arrangement og nærheden af atomerne i cis og trans konformationerne af peptidbindingen, hvilken konformation tror du ville blive foretrukket?
-
trans-konformationen ville være energisk gunstigere end cis-konformationen, da den minimerer sterisk hindring.
generelt er peptidbindinger i transkonformationen. Imidlertid kan cis-former forekomme i peptidbindinger, der går forud for en prolinrest. I sådanne tilfælde er cis-formen mere stabil end normalt, da prolin-sidekæden giver mindre hindring. Ikke desto mindre forekommer cis-peptidbindinger kun i ca.10% af forekomster af peptidbindinger forud for prolinrester.
under hensyntagen til peptidgruppens plane natur kan en polypeptidkæde ses at have en rygrad, der består af en række stive plane peptidgrupper bundet af Ca-atomerne. Figur 4 viser en del af et polypeptid med to plane peptidgrupper i transkonformationen. Bemærk, at selvom rotation ikke er tilladt om peptidbindingerne, er der potentiale for rotation omkring Ca–N og Ca–C bindingerne. Rotationsvinklerne, betegnet torsionsvinkler, om disse bindinger specificerer konformationen af en polypeptid rygrad. Torsionsvinklerne omkring Ca-N og Ca–C-bindingerne betegnes som KRP (phi) og KRP. (psi), henholdsvis og de er defineret som 180 liter, når polypeptidet er i den udvidede plane konformation, som illustreret i figur 4.
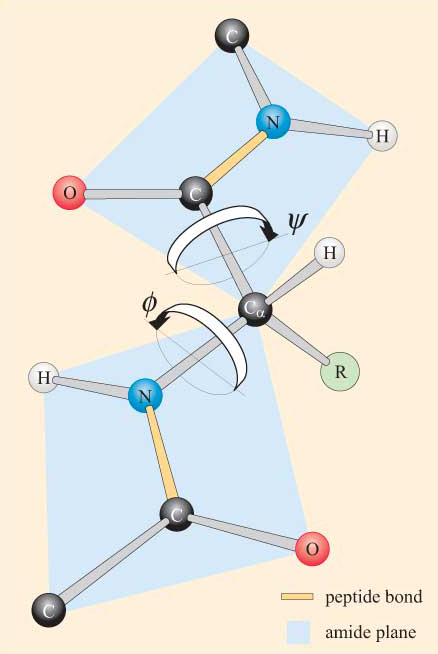
du vil ikke blive overrasket over at erfare, at steriske begrænsninger gælder for Prip og Prip.
som et resultat af disse steriske begrænsninger er kun visse værdier af kurr og kurr og dermed konformationer af peptidet tilladt, mens andre ikke er det.
det er muligt at beregne disse tilladte værdier for en given Rest i forbindelse med et polypeptid. Denne beregning udføres ved først at bestemme afstanden mellem alle de ikke-bindende atomer i to nabopeptidgrupper (såsom dem i figur 4) ved alle mulige værdier af KRP og KRP. Det gøres mest let for et polypeptid, der kun indeholder en slags aminosyre. Et konformationsplot af Kristian mod Kristian for en bestemt Rest er kendt som et Ramachandran-plot (efter dets opfinder, G. N. Ramachandran). Et sådant plot gør det muligt for os at identificere de konformationer (dvs.for en bestemt værdi af kr. og KR.), der er sterisk gunstige eller ugunstige (som i figur 5), i henhold til følgende kriterier:
-
hvor der ikke er nogen konflikt mellem Van Der-radierne for ikke-bindende atomer, er en konformation ’tilladt’. Disse konformationer ligger i de blå områder i figur 5.
-
konformationer, der kræver interatomiske afstande ved grænsen for det, der er tilladt, defineres som ‘ydre grænse’ konformationer. De ligger i de grønne områder i figur 5.teoretiske konformationer, der kræver, at to ikke-bindende atomer er tættere på hinanden end deres Van Der-radier tillader, er sterisk ‘forbudt’. Disse ligger i de hvide områder i figur 5.
Bemærk, at værdierne for KRP og KRP i figur 5 spænder fra −180 KRP til +180 KRP. Ved at dreje peptidgruppen gennem 360 liter vil det naturligvis bringe det tilbage til sin startposition, og −180 liter og +180 liter svarer til den samme position. Således er den grønne strimmel i nederste venstre hjørne af plottet i figur 5 sammenhængende med feltet i øverste venstre hjørne.

-
Brug Figur 5 til at afgøre, om den følgende værdier af ɸ og ψ er sterically positiv eller negativ: (a) ɸ = 90º og ψ = 90º; (b) ɸ = −90º og ψ = 90º.
-
(a) ugunstig; B) positiv.
Ramachandran-plots kan konstrueres til polymerer af hver af de 20 aminosyrer. Det er vigtigt at bemærke, at Ramachandran-plottene for mange aminosyrerester generelt er meget ens og kun har tre regioner med gunstige eller tolererede konformationer (mærket 1-3 i plottet for poly-l-alanin i figur 5). Forskelle forekommer dog. For eksempel, hvor sidekæden (R i figur 4) er forgrenet nær Ca, som i tilfældet med threonin, optager den mere plads tæt på peptidrygraden og begrænser tilgangen af atomer i de nærliggende peptidgrupper. Som et resultat er tilladte konformationer (Kurt-og kurvvinkler) mere begrænsede for polypeptider af forgrenede aminosyrer.
-
prolin er også meget forskellig fra andre aminosyrer med hensyn til tilladte konformationer, og for polyprolin tolereres kun liter −værdier fra −85 liter til-35 liter. Når du tænker på prolins struktur, hvordan kan du forklare dette relativt snævre interval af tilladte pris-værdier?
-
sidekæden af prolin er kovalent bundet til n af aminogruppen, så i polyprolin vil der være mindre rotationsfrihed omkring Ca-n–bindingen end med andre aminosyrer. Som følge heraf vil de tilladte værdier være relativt begrænsede sammenlignet med andre aminosyrer.
-
figur 6 viser Ramachandran-plottet for glycinrester i en polypeptidkæde. Regionerne er farvekodede som i figur 5. Hvad kan du sige om de konformationer, som glycin vedtager? Overvej strukturen af glycin. Hvorfor adskiller glycin sig fra de andre rester med hensyn til dets konformationer?
-
glycin har meget større konformationsfrihed end andre aminosyrerester, fordi det er mindre sterisk forhindret.

Ramachandran-plottene i figur 5 og 6 er blevet genereret for henholdsvis L-alanin og l-glycin på grundlag af tilladte og ydre grænseafstande for interatomiske kontakter, bestemt ud fra kendte værdier for atomernes Van-Der-radier (tabel 1).
tabel 1 Van der Vaals afstande for interatomiske kontakter.
| kontakttype | normalt tilladt / list | ydre grænse / list | |
|---|---|---|---|
| H···h | 2.0 | 1.9 |
3.0 |
de er derfor forudsigelige snarere end faktiske konformationsplaner. Vi kan selvfølgelig bruge røntgendiffraktion til eksperimentelt at bestemme de’ virkelige ‘ værdier af KRP og KRP for rester i et polypeptid. I Figur 7 er værdierne for alle rester (med undtagelse af glycin og prolin) i en række forskellige strukturer bestemt ved røntgendiffraktion med høj opløsning og afbildet på et Ramachandran-plot. Vi kan se, at der er en slående korrespondance mellem forudsagte og faktiske konformationer. Bemærk dog, at der er nogle rester, hvis konformationer kortlægger de ‘forbudte’ områder. De fleste af disse rester kortlægges i regionen mellem ’tilladte’ regioner 2 og 3, omkring kr = 0.

-
se igen på figur 4 og forestil dig, at du kan vride den øverste peptidgruppe gennem 180-div, så at-DIV = 0. Hvilke grupper vil sandsynligvis være i konflikt i denne konformation?
-
n–h-grupperne af tilstødende peptidgrupper vil være i konflikt med hinanden og blive tvunget i nærheden.
konflikten forbundet med disse konformationer kan rummes ved en lille grad af vridning af peptidbindingen. I sådanne konformationer vrides peptidgruppen således ud af sin sædvanlige plane konformation.
et begrænset antal ‘forbudte’ konformationer af bestemte rester kan tolereres i et polypeptid, hvis den vedtagne konformation som helhed er energisk gunstig. Et polypeptid vil have tendens til at folde sådan, at det vedtager den mest stabile konformation. I denne konformation minimerer polypeptidet sin frie energi. I de næste afsnit skal vi se på dette højere niveau af proteinstruktur.