9.5 overtrædelser af Oktetreglen
læringsmål
- Genkend de tre hovedtyper af overtrædelser af oktetreglen.
så vigtig og nyttig som oktetreglen er i kemisk binding, er der nogle velkendte overtrædelser. Dette betyder ikke, at oktetreglen er ubrugelig—tværtimod. Som med mange regler er der undtagelser eller overtrædelser.
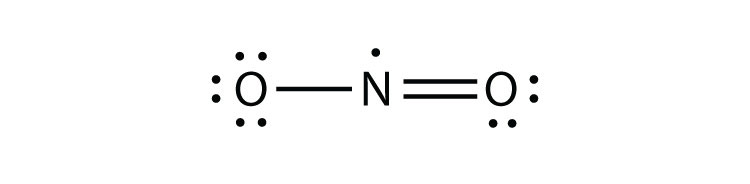
der er tre Overtrædelser af oktetreglen. Odd-elektronmolekyleret molekyle med et ulige antal elektroner i et atoms valensskal. repræsenterer den første overtrædelse af oktetreglen. Selvom de er få, har nogle stabile forbindelser et ulige antal elektroner i deres valensskaller. Med et ulige antal elektroner skal mindst et atom i molekylet overtræde oktetreglen. Eksempler på stabile ulige elektronmolekyler er NO, NO2 og ClO2.
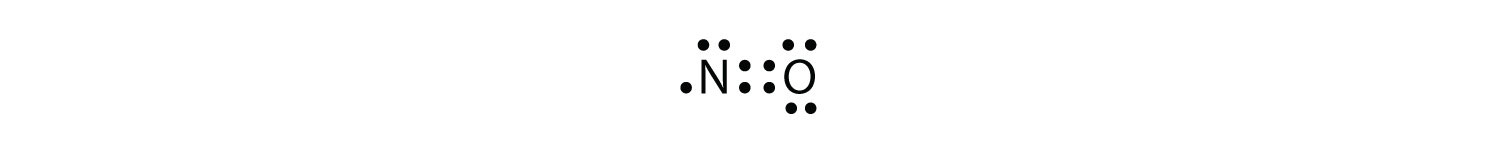
selvom O-atomet har en oktet af elektroner, har n-atomet kun syv elektroner i sin valensskal. Selvom NO er en stabil forbindelse, er den meget kemisk reaktiv, ligesom de fleste andre ulige elektronforbindelser.
Elektronmangelmolekyleret molekyle med mindre end otte elektroner i et atoms valensskal. repræsenterer den anden overtrædelse af oktetreglen. Disse stabile forbindelser har mindre end otte elektroner omkring et atom i molekylet. De mest almindelige eksempler er de kovalente forbindelser af beryllium og bor. For eksempel kan beryllium danne to kovalente bindinger, hvilket resulterer i kun fire elektroner i dens valensskal:
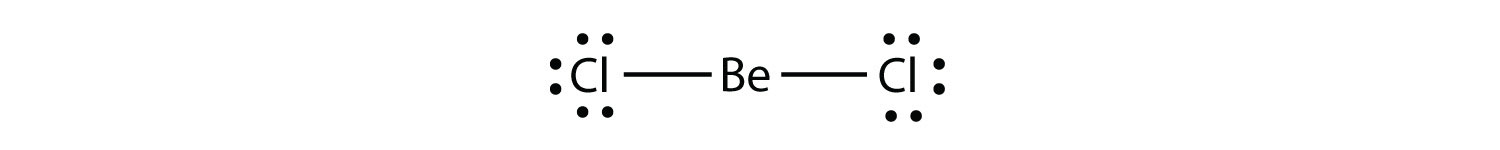
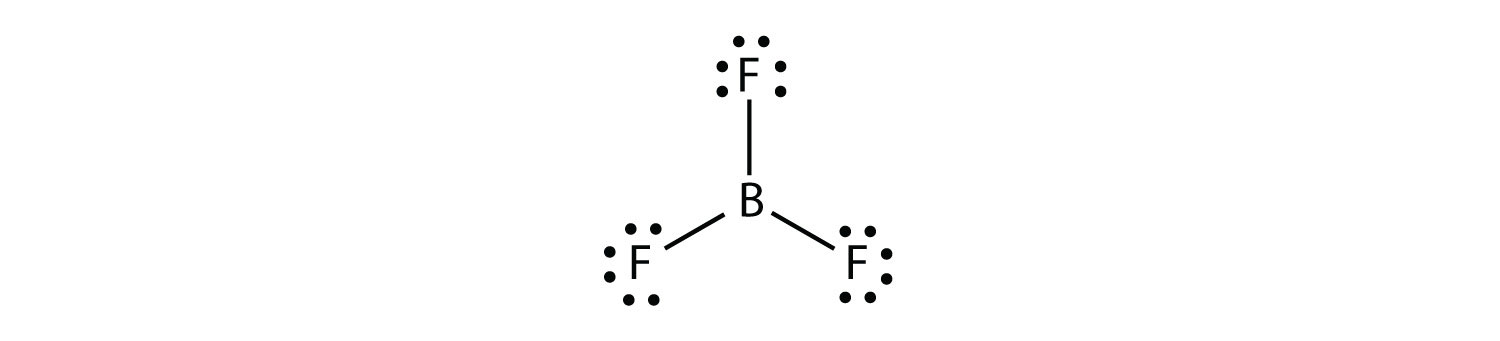
bor fremstiller almindeligvis kun tre kovalente bindinger, hvilket resulterer i kun seks valenselektroner omkring B-atomet. Et velkendt eksempel er BF3:
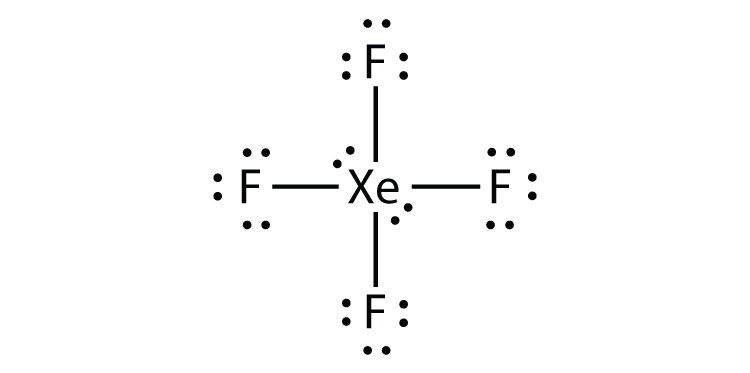
den tredje overtrædelse af oktetreglen findes i de forbindelser med mere end otte elektroner tildelt deres valensskal. Disse kaldes udvidede valensskalmolekyleret molekyle med mere end otte elektroner i et atoms valensskal.. Sådanne forbindelser dannes kun af centrale atomer i den tredje række i det periodiske system eller derover, der har tomme d-orbitaler i deres valensskaller, der kan deltage i kovalent binding. En sådan forbindelse er PF5. Det eneste rimelige elektronprik-diagram for denne forbindelse har p-atomet, der fremstiller fem kovalente bindinger:
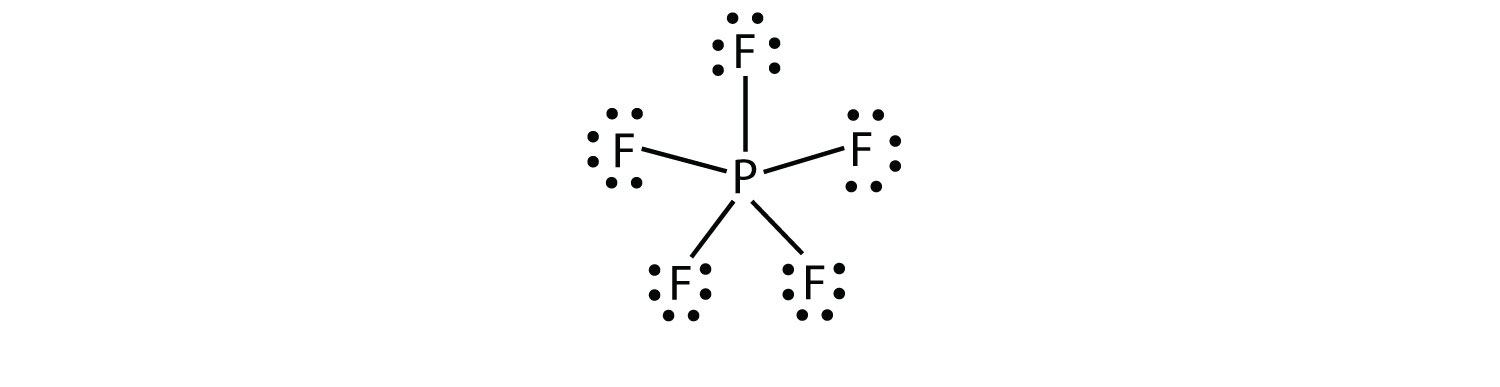
formelt har P-atomet 10 elektroner i sin valensskal.
eksempel 9
Identificer hver overtrædelse af oktetreglen ved at tegne et elektronprik-diagram.
- ClO
- SF6
opløsning
-
Med et Cl-atom og et O-atom har dette molekyle 6 + 7 = 13 valenselektroner, så det er et ulige elektronmolekyle. Dette molekyle er som følger:

-
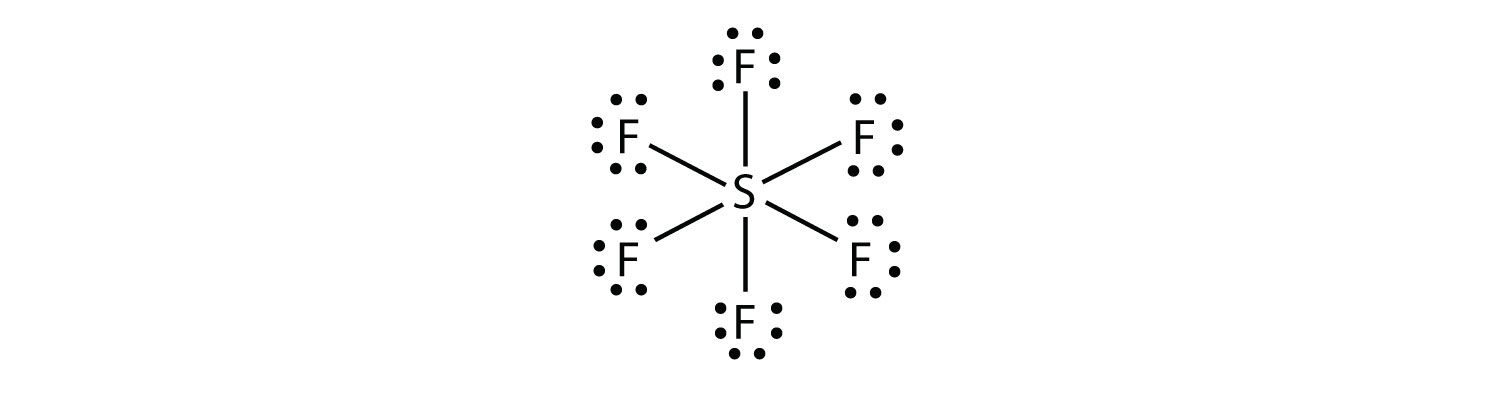
i SF6 udgør det centrale s-atom seks kovalente bindinger til de seks omgivende f-atomer, så det er et udvidet valensskalmolekyle. Dens elektron dot diagram er som følger:
Test dig selv
Identificer overtrædelsen til oktetreglen i Ksef2 ved at tegne et Lyvis elektronprik diagram.
svar
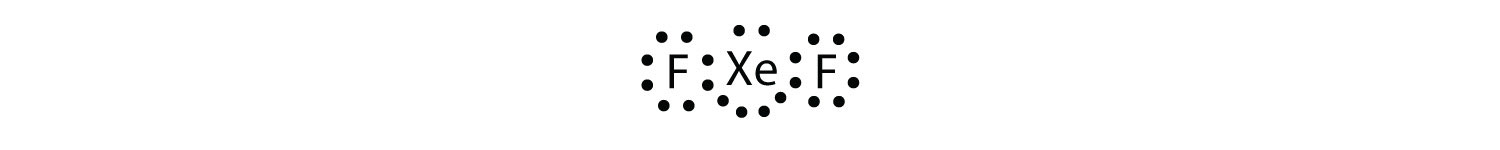
HSE-atomet har en udvidet valensskal med mere end otte elektroner omkring det.
Nøgleudtag
- Der er tre Overtrædelser af oktetreglen: ulige elektronmolekyler, elektronmangel molekyler og ekspanderede valensskalmolekyler.
øvelser
-
hvorfor kan et ulige elektronmolekyle ikke tilfredsstille oktetreglen?
-
hvorfor kan et atom i den anden række i det periodiske bord ikke danne udvidede valensskalmolekyler?
-
Tegn et acceptabelt diagram for disse molekyler, der overtræder oktetreglen.
- NO2
- Ksef4
-
Tegn et acceptabelt diagram for disse molekyler, der overtræder oktetreglen.
- BCl3
- ClO2
-
Tegn et acceptabelt diagram for disse molekyler, der overtræder oktetreglen.
- POF3
- ClF3
-
Tegn et acceptabelt diagram for disse molekyler, der overtræder oktetreglen.
- SF4
- BeH2
svar
-
Der er ingen måde, at alle elektroner kan parres, hvis der er et ulige antal af dem.
-
-