så som du ved, er Dmitri Mendeleev far til det periodiske system. Men vidste du, at det moderne periodiske system, vi bruger, faktisk blev udviklet af en videnskabsmand ved navn Henry Moseley? Lad os lære den fascinerende historie bag det periodiske system.
Suggested Videos
moderne periodiske system
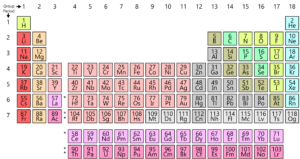
som du ved, er alle de elementer, der findes på jorden, arrangeret i et gitter eller en matrice kaldet det moderne periodiske system. Disse elementers arrangement er i overensstemmelse med et mønster. Det periodiske system blev faktisk udviklet og af Mendeleev i begyndelsen af 1800-tallet. Imidlertid blev det faktisk perfektioneret af Henry Moseley, en engelsk fysiker i 1913. Ved at foretage justeringer af den periodiske lov forbedrede han alle fejlene i Mendeleev-bordet. Lad os se på denne udvikling.
gennemse flere emner under periodisk klassificering af elementer
- tidligere forsøg på klassificering af elementer
- placering af elementer i det moderne periodiske system
- tendenser i det moderne periodiske system
brug af atomnummer
lad os først se på et atoms struktur. Hvert atom består af en kerne, der består af protoner og neutroner. Her har protonerne en positiv ladning, og en neutron har ingen ladning. Nu omgiver elektroner (der bærer en negativ ladning) kernen. Nu er atommassetallet det samlede antal protoner og neutroner i et atom. Atomnummeret er antallet af protoner i et atom. Dette atomnummer er helt unikt for hvert element, hvilket betyder, at hvert element på planeten har sit eget unikke atomnummer.det var Henry Moseley, der foreslog et bedre arrangement end Mendeleev. Han arrangerede elementerne i henhold til deres atomnummer snarere end deres atommasse. Ved at gøre det forbedrede han den forrige tabel og fjernede nogle af dens vanskeligheder og uregelmæssigheder.
position af brint
Mendeleev kunne aldrig finde ud af den korrekte position af brint i hans bord. Da brint enten kan vinde eller miste en elektron, kan den finde et sted i gruppe 1 eller 17. Dens elektroniske konfiguration ligner den af alkalimetaller. Selvom det også kan kombineres med metaller og ikke-metaller, der danner kovalente bindinger som halogener.
men i det moderne periodiske system er der ikke noget dilemma. Da atomnummeret af hydrogen er 1, er det her, hvor det finder sit passende sted i starten af bordet.
isotoper
isotoper er forskellige atomer af et element, der hver har det samme antal protoner, men et andet antal neutroner i deres kerner. Dette indebærer, at selv om deres atommasse varierer, er deres atomnummer det samme. Som for eksempel er Carbon-14 en radioaktiv isotop af carbonatomet, der har otte neutroner.
mens dette udgjorde et problem for Mendeleev, da tabellen var afhængig af atommasse, er det ikke et problem med det moderne periodiske system. Alle isotoper af elementerne har ikke separate steder på bordet.
rækkefølge af visse elementer
Mendeleev ved brug af atommasse til at arrangere elementer står over for et andet problem. Der var visse tilfælde, hvor der var en brud på dette arrangement, så elementer med lignende egenskaber var i en gruppe sammen. Tag eksemplet med jod og tellur. Nu er jodens atommasse lavere end tellurium. Og alligevel satte Mendeleev det efter tellurium, så det kunne være i samme gruppe som fluor og klor.
i det moderne periodiske system bliver atommassen irrelevant, og elementer grupperes med lignende elementer baseret på deres atomnummer.
sjældne jordarter
det moderne periodiske system løste et andet problem ved at placere de sjældne jordarter som Cerium, lanthan, Erbium osv.
løst eksempel for dig
spørgsmål: Ud af alle de 118 elementer, vi kender, hvor mange elementer forekommer naturligt?