nøgleudtryk
sørg for, at du kan definere og bruge i sammenhæng nedenstående nøgleudtryk.
- Adams’ katalysator
- hydrogenering
Studienoter
kemiske reaktioner, der er heterogene, har reaktanter, der er i mindst to forskellige faser (f.eks. gas med et fast stof), mens homogene reaktioner forekommer i en enkelt fase (f. eks. gas med en anden gas).
der kan opstå en vis forvirring fra beskrivelsen af katalysatoren anvendt i reaktionen mellem alkener og hydrogen. Tre metaller-nikkel, platin og palladium—bruges ofte, men en kemiker kan ikke blot placere et stykke af et af disse metaller i en blanding af alken og brint og få en reaktion. Hver metalkatalysator skal fremstilles på en særlig måde:
- nikkel anvendes normalt i en findelt form kaldet “Raney nikkel.”Det fremstilles ved at reagere en Ni-Al-legering med NaOH.
- palladium opnås kommercielt “understøttet” på et inert stof, såsom trækul, (Pd / C). Alken opløses sædvanligvis i ethanol, når Pd/C anvendes som katalysator.
- platin bruges som PtO2, Adams ‘ katalysator, selvom det faktisk er platinmetal, der er katalysatoren. Det hydrogen, der bruges til at tilføje til carbon-carbon-dobbeltbindingen, reducerer også platin(IV) – iltet til fint opdelt platinmetal. Ethanol eller eddikesyre anvendes som opløsningsmiddel til Alken.
andre typer forbindelser, der indeholder flere bindinger, såsom ketoner, estere og nitriler, reagerer ikke med hydrogen under de betingelser, der anvendes til hydrogenering af alkener. Eksemplerne nedenfor viser reduktion af en alken, men de tilstedeværende keton-og nitrilgrupper forbliver intakte og reduceres ikke.

aromatiske ringe reduceres heller ikke under de betingelser, der anvendes til at reducere alkener, selvom disse ringe ser ud til at indeholde tre carbon-carbon dobbeltbindinger. Som du vil se senere, indeholder aromatiske ringe ikke rigtig nogen dobbeltbindinger, og mange kemikere foretrækker at repræsentere bensenringen som en sekskant med en cirkel inde i den

snarere end som en sekskant med tre skiftende dobbeltbindinger.
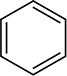
repræsentationen af bensene-ringen vil blive diskuteret yderligere i afsnit 15.2.
reaktionen mellem carbon-carbon dobbeltbindinger og hydrogen tilvejebringer en metode til bestemmelse af antallet af dobbeltbindinger, der er til stede i en forbindelse. For eksempel reagerer en mol cycloheksen med en mol hydrogen for at producere en mol cycloheksen:

men en mol 1,4-cycloheksaden reagerer med to mol hydrogen for at danne en mol cycloheksen:
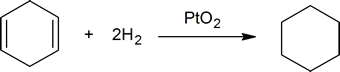
en kemiker ville sige, at cycloheksen reagerer med en ækvivalent af hydrogen, og 1,4-cycloheksaden reagerer med to ækvivalenter af hydrogen. Hvis du tager en kendt mængde af et ukendt, umættet carbonhydrid og bestemmer, hvor meget hydrogen det vil absorbere, kan du let bestemme antallet af dobbeltbindinger, der er til stede i carbonhydridet (se spørgsmål 2 nedenfor).
tilsætning af hydrogen til en carbon-carbon dobbeltbinding kaldes hydrogenering. Den samlede virkning af en sådan tilsætning er den reduktive fjernelse af dobbeltbindingsfunktionsgruppen. Regioselektivitet er ikke et problem, da den samme gruppe (et hydrogenatom) er bundet til hver af dobbeltbindingskulstofferne. Den enkleste kilde til to hydrogenatomer er molekylært hydrogen (H2), men blanding af alkener med hydrogen resulterer ikke i nogen mærkbar reaktion. Selvom den samlede hydrogeneringsreaktion er eksoterm, forhindrer en høj aktiveringsenergi den i at finde sted under normale forhold. Denne begrænsning kan omgås ved anvendelse af en katalysator, som vist i det følgende diagram.
et eksempel på en alken additionsreaktion er en proces kaldet hydrogenation.In en hydrogeneringsreaktion, to hydrogenatomer tilsættes over dobbeltbindingen af en alken, hvilket resulterer i en mættet Alkan. Hydrogenering af en dobbeltbinding er en termodynamisk gunstig reaktion, fordi den danner et mere stabilt (lavere energi) produkt. Med andre ord er produktets energi lavere end reaktantens energi; således er den eksoterm (varme frigives). Den frigivne varme kaldes hydrogeneringsvarmen, som er en indikator for et molekyles stabilitet.


katalysatorer er stoffer, der ændrer hastigheden (hastigheden) af en kemisk reaktion uden at blive forbrugt eller vises som en del af produktet. Katalysatorer virker ved at sænke reaktionsaktiveringsenergien, men de ændrer ikke den relative potentielle energi af reaktanterne og produkterne. Fininddelte metaller, såsom platin, palladium og nikkel, er blandt de mest anvendte hydrogeneringskatalysatorer. Katalytisk hydrogenering finder sted i mindst to trin, som vist i diagrammet. For det første skal Alken adsorberes på overfladen af katalysatoren sammen med noget af hydrogenet. Derefter skifter to hydrogener fra metaloverfladen til carbonhydriderne i dobbeltbindingen, og det resulterende mættede carbonhydrid, som er mere svagt adsorberet, forlader katalysatoroverfladen. Den nøjagtige karakter og timing af de sidste begivenheder forstås ikke godt.

som vist i energidiagrammet er hydrogeneringen af alkener eksoterm, og der frigives varme svarende til Karte (farvet grøn) i diagrammet. Denne reaktionsvarme kan bruges til at evaluere den termodynamiske stabilitet af alkener med forskellige antal alkylsubstituenter på dobbeltbindingen. For eksempel viser den følgende tabel opvarmningen af hydrogenering for tre C5H10 alkener, der giver det samme Alkan-produkt (2-methylbutan). Da en stor reaktionsvarme indikerer en reaktant med høj energi, er disse heats omvendt proportional med stabiliteterne af Alken-isomerer. Til en grov tilnærmelse ser vi, at hver alkylsubstituent på en dobbeltbinding stabiliserer denne funktionelle gruppe med lidt mere end 1 kcal/mol.
| Alkene Isomer | (CH3)2CHCH=CH2 3-methyl-1-butene |
CH2=C(CH3)CH2CH3 2-methyl-1-butene |
(CH3)2C=CHCH3 2-methyl-2-butene |
|---|---|---|---|
| Heat of Reaction ( ΔHº ) |
–30.3 kcal/mole | –28.5 kcal/mole | –26.9 kcal/mole |

fra den mekanisme, der er vist her, forventer vi, at tilsætningen af hydrogen forekommer med syn-stereoselektivitet. Dette er ofte sandt, men hydrogeneringskatalysatorerne kan også forårsage isomerisering af dobbeltbindingen inden hydrogentilsætning, i hvilket tilfælde stereoselektivitet kan være usikker.

øvelser
- i reaktionen
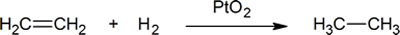
- 0,500 mol ethen reagerer med _______ mol hydrogen. Således kan en kemiker sige, at ethen reagerer med en _______ af hydrogen.
- ethen bliver_______; mens _ _ _ _ _ _ _ bliver iltet.
- iltning antallet af kulstof i ethen er _______; i ethan er det _______.
- når 1.000 g af et bestemt triglycerid (fedt) behandles med hydrogengas i nærvær af Adams’ katalysator, konstateres det, at volumenet af hydrogengas, der forbruges ved 99,8 kPa og 25,0 liter C, er 162 mL. Et separat eksperiment indikerer, at fedtets molære masse er 914 g mol−1. Hvor mange carbon-carbon dobbeltbindinger indeholder forbindelsen?
svar:
-
-
Vis svar
-
Vis svar
-
Vis svar
-
-
Vis Svar
Examples
Question
Predict the products if the following alkenes were reacted with catalytic hydrogen.

Solution

Contributors
- Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
- Prof. Steven Farmer (Sonoma State University)
- organisk kemi med en biologisk vægt af Tim Soderberg (University of Minnesota, Morris)