Vivo Patofysiologi
insulinsyntese og-sekretion
Insulin er et lille protein med en molekylvægt på ca.6000 Dalton. Den består af to kæder, der holdes sammen af disulfidbindinger. Figuren til højre viser en molekylær model af bovint insulin, med A-kæden farvet blå og den større B-kæde grøn. Du kan få en bedre forståelse for strukturen af insulin ved at manipulere en sådan model selv.aminosyresekvensen er stærkt konserveret blandt hvirveldyr, og insulin fra et pattedyr er næsten helt sikkert biologisk aktivt i et andet. Selv i dag behandles mange diabetespatienter med insulin ekstraheret fra svinepancreas.
biosyntese af Insulin
Insulin syntetiseres kun i betydelige mængder i betaceller i bugspytkirtlen. Insulin-mRNA ‘ et oversættes som en enkeltkædeprecursor kaldet preproinsulin, og fjernelse af dets signalpeptid under indsættelse i det endoplasmatiske retikulum genererer proinsulin.
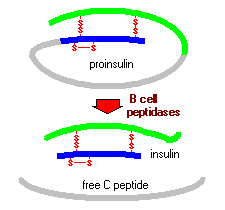 Proinsulin består af tre domæner: en amino-terminal B-kæde, en carboksy-terminal A-kæde og et forbindende peptid i midten kendt som C-peptidet. Inden for det endoplasmatiske retikulum udsættes proinsulin for flere specifikke endopeptidaser, som punktafgifter C-peptidet og derved genererer den modne form af insulin. Insulin og frit C-peptid pakkes i Golgi i sekretoriske granuler, der akkumuleres i cytoplasmaet.
Proinsulin består af tre domæner: en amino-terminal B-kæde, en carboksy-terminal A-kæde og et forbindende peptid i midten kendt som C-peptidet. Inden for det endoplasmatiske retikulum udsættes proinsulin for flere specifikke endopeptidaser, som punktafgifter C-peptidet og derved genererer den modne form af insulin. Insulin og frit C-peptid pakkes i Golgi i sekretoriske granuler, der akkumuleres i cytoplasmaet.
når betacellen stimuleres passende, udskilles insulin fra cellen ved eksocytose og diffunderer ind i ølkapillært blod. C-peptid udskilles også i blod, men har ingen kendt biologisk aktivitet.
kontrol af insulinsekretion
Insulin udskilles primært som reaktion på forhøjede blodkoncentrationer af glucose. Dette giver mening, fordi insulin er “ansvarlig” for at lette glukoseindtrængning i celler. Nogle neurale stimuli (f. eks. syn og smag af mad) og øgede blodkoncentrationer af andre brændstofmolekyler, herunder aminosyrer og fedtsyrer, fremmer også insulinsekretion.
vores forståelse af mekanismerne bag insulinsekretion forbliver noget fragmentarisk. Ikke desto mindre er visse træk ved denne proces blevet tydeligt og gentagne gange demonstreret, hvilket giver følgende model:
- glukose transporteres ind i betacellen ved lettere diffusion gennem en glukosetransportør; forhøjede koncentrationer af glukose i ekstracellulær væske fører til forhøjede koncentrationer af glukose i betacellen.
- forhøjede koncentrationer af glucose i betacellen fører i sidste ende til membran depolarisering og en tilstrømning af ekstracellulært calcium. Den resulterende stigning i intracellulært calcium menes at være en af de primære udløsere for eksocytose af insulinholdige sekretoriske granulater. De mekanismer, hvormed forhøjede glukoseniveauer i betacellen forårsager depolarisering, er ikke klart fastlagt, men synes at være resultatet af metabolisme af glukose og andre brændstofmolekyler i cellen, måske fornemmet som en ændring af ATP:ADP-forhold og transduceret til ændringer i membranledningsevne.
- forhøjede niveauer af glukose i betaceller synes også at aktivere calciumuafhængige veje, der deltager i insulinsekretion.
 stimulering af insulinfrigivelse observeres let hos hele dyr eller mennesker. Den normale fastende blodglukosekoncentration hos mennesker og de fleste pattedyr er 80 til 90 mg pr.100 ml, forbundet med meget lave niveauer af insulinsekretion.
stimulering af insulinfrigivelse observeres let hos hele dyr eller mennesker. Den normale fastende blodglukosekoncentration hos mennesker og de fleste pattedyr er 80 til 90 mg pr.100 ml, forbundet med meget lave niveauer af insulinsekretion.
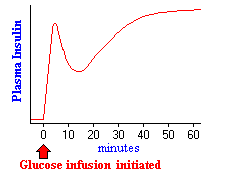
figuren til højre viser virkningerne på insulinsekretion, når der tilføres tilstrækkelig glukose til at opretholde blodniveauerne to til tre gange fastende niveau i en time. Næsten umiddelbart efter infusionen begynder, øges plasmainsulinniveauerne dramatisk. Denne indledende stigning skyldes sekretion af præformet insulin, som snart er signifikant udtømt. Den sekundære stigning i insulin afspejler den betydelige mængde nyligt syntetiseret insulin, der frigives straks. Det er klart, at forhøjet glukose ikke kun simulerer insulinsekretion, men også transkription af insulingenet og translation af dets mRNA.
avancerede og supplerende emner
- strukturen af Insulin