en vektorbåren sygdom (specifikt en biologisk overførsel snarere end mekanisk) er en, hvor transmission af infektion i en population (værtspopulationen) kun sker via en anden population (vektorer). Vektorer er normalt hæmatofagøse (blodfodrende) leddyr såsom myg, sandfluer eller flåter. Der er mange sådanne sygdomme, hvis dynamik er af stor interesse med hensyn til at kontrollere infektion. Malaria, leishmaniasis, denguefeber og vestnilvirus er kun for at nævne nogle få, der i øjeblikket har en enorm social indvirkning på menneskelige befolkninger.
hvert år i regionen 225 millioner mennesker er inficeret med malariaparasitten, og i 2009 resulterede omkring 781.000 af disse i sygdomsinduceret dødelighed. Historien ligner leishmaniasis, hvor der er omkring 12 millioner mennesker globalt, der menes at være inficeret til enhver tid, og omkring 80.000 mennesker dør årligt af den mest alvorlige form, visceral leishmaniasis. Sådanne sygdomme er udbredt i udviklingslandene; en kombination af optimal habitat for vektorer i tropiske regioner og mangel på medicinsk hjælp fører til store endemier der.
menneskelige sygdomme er ikke den eneste bekymring; der er mange andre, der inficerer andre klasser af værter, som også er af interesse, især med hensyn til bevarelse af truede arter.
det typiske infektionsforløb for vektorbåren transmission, ignorering af sygdom, vært eller vektorspecifik, starter med en inficeret vektor (en blodfodring eller sugende voksen leddyr), der tager et blodmåltid fra et modtageligt medlem af værtspopulationen. Når den er bidt, har værten en chance for at blive inficeret med sygdommen. På dette stadium, hvis inficeret, værten betragtes som udsat, men sagsøger ingen negative eekter fra infektionen og kan ikke overføre sygdommen. Tiden efter at være blevet inficeret, men inden den bliver smitsom, er kendt som latensperioden. Når parasitten har nået et bestemt stadium i sin reproduktive cyklus, bliver værten smitsom, hvorefter den, hvis den er bidt, kan overføre sygdommen til en modtagelig vektor gennem sit parasitinficerede blod og afslutte transmissionscyklussen (vist i nedenstående figur).
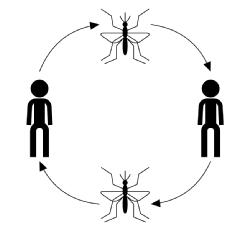
sygdomsoverførsel er normalt karakteriseret ved:
- overflod og rumlig spredning af både værter og vektorer
- demografi
- en fodringshastighed eller vektor ønske om at bide
- succes eller fiasko af transmission
typisk matematiske modeller af vektorbårne sygdomme er baseret på en to-population SI(R) model, der udviser “kryds og tværs” infektionsbetingelser, hvor og
er kraften af infektion af udtryk for værter og vektorer henholdsvis:
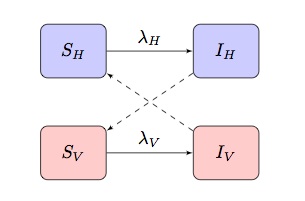
afhængig af sygdommen og populationen, der modelleres, kan dette tilpasses til at inkorporere andre mere specifikke træk.
modellering af dynamikken i vektorbårne sygdomme
der er mange forskellige typer matematisk model til transmission af vektorbåren sygdom; ideelt set søges disse at blive holdt matematisk traktable og så enkle som muligt, samtidig med at den generelle dynamik i det biologiske system bevares. Ikke overraskende modeller fra litteraturen spænder meget; fra deterministisk til stokastisk, endemisk (inklusive fødsels-og dødsrater) eller epidemi (et udbrud af begrænset varighed), der inkorporerer rumlig spredning, rumlig heterogenitet, latensperioder, aldersstruktur, erhvervelse og tab af immunitet, flere stammer og mange andre. Selv når man kun overvejer en bestemt sygdom, kan variationerne i sygdommen inden for forskellige populationer føre til ændringer i ikke kun parameteriseringen, men også af, hvordan man måske ønsker at tage modelleringsmetoden.
Nogle af Kats arbejde fokuserer på de forenklinger, der ofte gøres for at reducere modellernes kompleksitet. Dette arbejde overvejer virkningerne af at bruge “kun vært” transmissionsmodeller såsom kvasi-ligevægtsantagelsen på sygdomsdynamik og også effekten af at udelade latensperioden ved epidemiske forudsigelser.
Leishmaniasis
udfyldes af Erin
Human afrikansk Trypanosomiasis (HAT)
Human afrikansk trypanosomiasis (HAT), mere almindeligt kendt som sovesyge, er en dødelig sygdom, der er endemisk over store dele af Afrika syd for Sahara. 70 millioner mennesker bor i udsatte områder, der dækker over halvanden million kvadratkilometer. Mens forekomsten af HAT ikke er så høj som for andre vektorbårne sygdomme som malaria eller dengue (der var lidt over 7000 rapporterede tilfælde af HAT, men 207 millioner anslåede malariatilfælde i 2012), manglen på kemisk profylakse, den ekstremt ubehagelige (og ofte dødbringende) behandling og manglen på betydelig videnskabelig forskning har nu placeret HAT på hvem ‘ s liste over forsømte tropiske sygdomme.
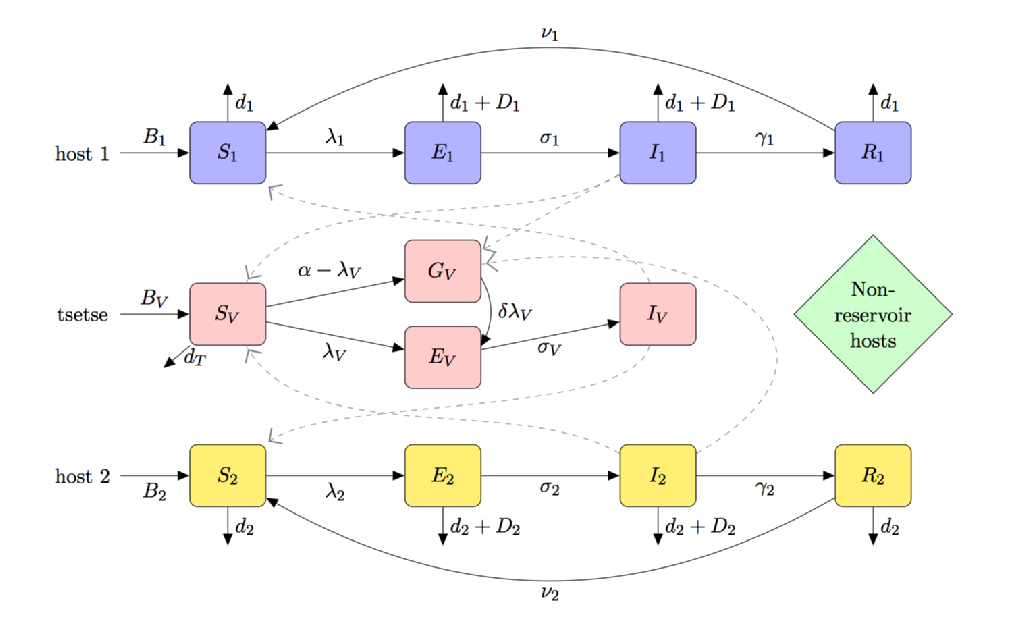
vektoren for HAT er tsetse; dens behov for blodfoder for at forhindre sult og en unik vektor-parasit-interaktion (forårsager et “teneralt følsomhedsfænomen”) betyder, at HATMODELLERING er tydeligt forskellig fra andre vektorbårne sygdomme såsom malaria.
figuren nedenfor er en rumkarikatur af en model til HAT, der inkluderer:
- (delvis) teneral fluefølsomhed
- multiværtsarter (inklusive reservoir og ikke-reservoirværter)
- tsetse-fodringspræference
- sult af ikke-fodret tsetse
Bluetongue sygdom (BTV)
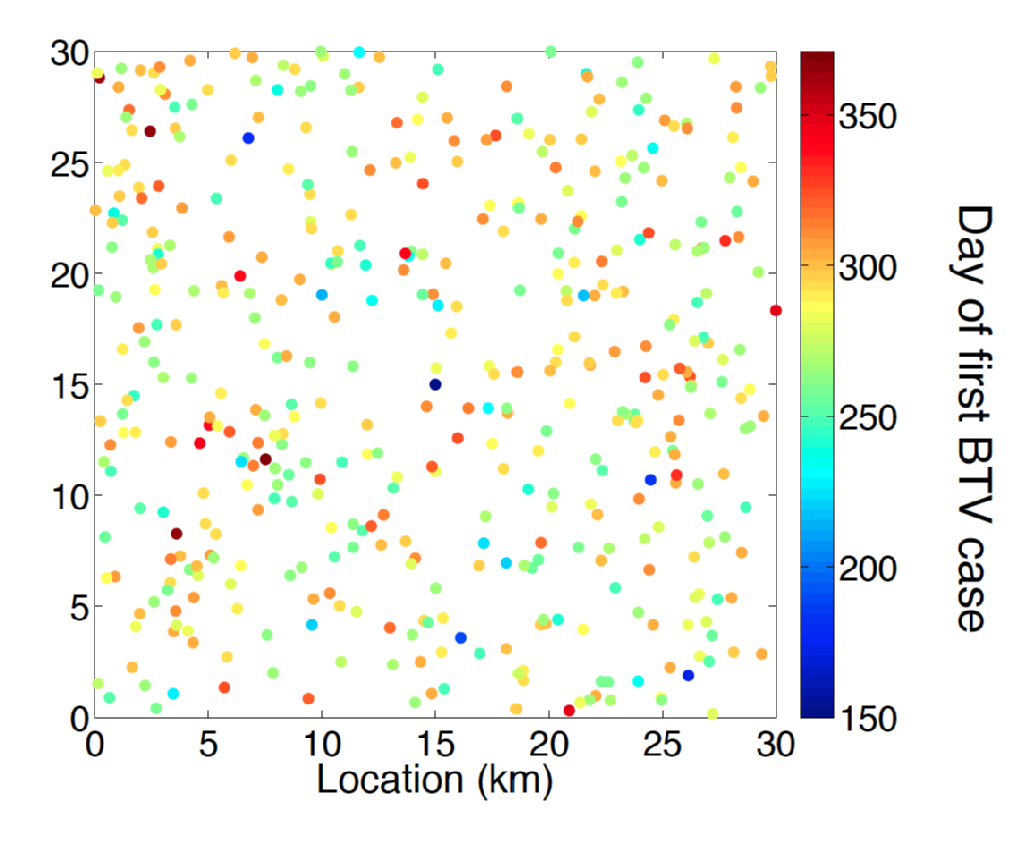
bluetongue er en virussygdom (BTV) hos drøvtyggere, der overføres af forskellige arter af culicoides-slægten bidende midge. Symptomer på husdyr, der er syge med BTV, omfattede ubehag, høj feber og cyanose i tungen, hvilket giver sygdommen sit navn. Blandt får BTV sygdom har en høj associeret dødelighed. Indtil slutningen af 1990 ‘ erne var Det Europæiske sortiment af BTV helt forbundet med rækkevidden af midgevektoren C. Imicola. I slutningen af 90 ‘erne og ind i begyndelsen af 2000’ erne har der været en tidligere hidtil uset udvidelse af BTV til områder i Europa, som er en del af rækken af andre midge arter som dem af C. Obsoletus kompleks og nært beslægtede midge arter. Især et udbrud med oprindelse i Holland i 2006 er det første registrerede eksempel på en BTV-indtrængen til 50 grader nordlig bredde. I de efterfølgende somre blev BTV-tilfælde opdaget i hele Nordeuropa, herunder i Belgien, Tyskland, Storbritannien og Danmark, der demonstrerede Bluetongues evne til at overvintre i det nordeuropæiske miljø. Et forundrende træk ved den nordeuropæiske serologi af Bluetongue er, at sygdommen var forårsaget af en særskilt stamme (BTV-8) fra dem, der var ansvarlige for indtrængen i Sydeuropa, dvs.Spanien (BTV-4) og Italien (BTV-2).
forudsigelse af virkningen af BTV-indtrængen og bedste design af husdyrforvaltning og sygdomsbekæmpelse kræver banebrydende modelleringsmetode. Der forstås meget om epidemiologien af BTV, såsom en solid forståelse af den forventede periode med viræmi for kvæg-og fåreværter og effekten af klimatemperatur på inkubationsperioden for Bluetongue inden for dens midgevektor. Imidlertid, estimering af den spatio-temporale risiko, der er forbundet med vektorspredning væk fra inficeret værtsdyr, er fortsat en betydelig udfordring. Slutningsproblemet her er multifaktorielt, der ikke kun kræver parameterinferens, men også statistisk principielt modelvalg.
Malaria
Malaria følger den generiske transmissionscyklus som tidligere beskrevet; vektoren er den kvindelige myg, der tager sit blodmåltid som en del af reproduktionsprocessen; hannerne af arten er nektavorious og spiller som sådan ingen rolle i transmissionscyklussen. Hyppigheden af fodring bestemmes af dette biologiske behov, og derfor er den gennemsnitlige fodringshastighed normalt omkring en gang hver fjerde dag, og det antages normalt, at mætning for et parti æg opnås inden for dette ene måltid. Der er mange forskellige typer malaria, nogle påvirker mennesker (dette kan skyldes en af fire forskellige typer Plasmodium) og andre påvirker dyr. Slægten Anopheles er ansvarlig for overførsel til mennesker, hvoraf cirka kun 30 ud af 400 arter overvejende forårsager spredning af infektion.
en nøglefunktion, der påvirker malaria, er temperatur; selvom myggen befinder sig inden for det givne område, er eksterne temperaturer under ca.16C (nøjagtigt tempereret afhænger af parasitarten), det er ikke varmt nok til at tillade udvikling. Generelt, da temperaturen stiger fra 16C, jo kortere inkubationsperioden med en pludselig stop over omkring 32C, da parasitten ikke er i stand til at overleve forbi disse temperaturer.
aviær Malaria og Honeycreeper
nogle systemer kan dog være langt mere komplekse end det generelle eksempel givet tidligere. Det lider ikke kun de negative virkninger af aviær Malaria (Plasmodium relictum), som overføres via myggen, men også de af klimaændringer og rovdyr. Samspillet mellem disse dominerende faktorer er stort, med temperaturer og overflod af rovdyr, der påvirker sygdomsforløbet og fuglenes evne (eller manglende evne) til at modstå udryddelse. Desuden udviser nogle arter af honeycreeper evnen til at give resistens over for malaria og lider ingen skadelige virkninger af sygdommen, mens de forbliver infektiøse (disse kaldes mere almindeligt bærere og forårsager utilsigtet et infektionsreservoir ved at overleve den normale “sygdomsfri” forventede levetid, men stadig sprede infektion.
dette værk er udgivet som:
K. S. Rock et al. “Modellering af fremtiden for Honeycreeper: et økologisk og epidemiologisk Problem”. Økologisk modellering (juni 2012)