hvor meget energi frigives i ATP-hydrolyse?
Læsertilstand
ATP kaldes ofte cellens energivaluta. Hundredvis af reaktioner i cellen fra metaboliske transformationer til signalhændelser er koblet til hydrolysen (bogstaveligt betyder “vandløsning”) af ATP med vand . Reaktionen ATP + H2O <> ADP + Pi omdanner adenosintrifosfat (ATP) til adenosindiphosphat (ADP) og uorganisk phosphat (Pi). Den frie energiændring forbundet med denne reaktion driver en stor brøkdel af cellulære reaktioner med membranpotentialet og reducerende effekt er de to andre dominerende energikilder. Men præcis hvor meget er denne energivaluta værd, og hvad afslører den om de kemiske transaktioner, der kan købes? Selvfølgelig er der ikke noget svar på dette spørgsmål, da mængden af energi, der frigøres ved denne hydrolysereaktion, afhænger af de intracellulære forhold, men det er muligt at få en fornemmelse for den omtrentlige “værdi” af denne valuta ved at ty til nogle enkle estimater.

Figur 1: forholdet mellem Gibbs fri energi af ATP-hydrolyse under standardbetingelser til ligevægtskonstanten og forholdet mellem den frie energi af hydrolyse under fysiologiske betingelser og de fysiologiske reaktanter koncentrationer.
Gibbs-fri energiændring (larg) på grund af ATP-hydrolyse afhænger af koncentrationerne af de forskellige deltagere i reaktionen som vist i Figur 1. Når koncentrationerne er længere væk fra deres ligevægtsværdier, er den absolutte værdi af larg større. Under “standard” betingelser (dvs. koncentrationer på 1M for alle reaktanter undtagen vand, der tages ved dets karakteristiske koncentration på 55M) Gibbs fri energi af ATP hydrolyse varierer fra -28 til -34 kJ/mol (dvs. Afhængigheden af Mg-ioner opstår, fordi de positivt ladede magnesiumioner hjælper med at stabilisere ATP-molekylet. Men i cellen er betingelserne aldrig engang tæt på standard tilstandsværdierne. For eksempel ville en koncentration på 1 m ATP betyde, at massen af opløst stof ville svare til selve vandopløsningsmidlet. I figur 1 viser vi den ofte forvirrende afledning af den fysiologiske fri energi (KRUPG) i betragtning af forholdet mellem koncentrationer fra standardværdien (Krupgo). Opdelingen efter udtryk, som er nødvendige for at tage sig af enheder som en logaritme, skal altid indeholde et unitless udtryk. Det er nogle gange overraskende at tro, at hvis cellen var i ligevægt, ville værdien af larg have været nul, og der ville ikke være nogen energi at vinde ved ATP-hydrolyse. Heldigvis er dette aldrig tilfældet i levende organismer. .
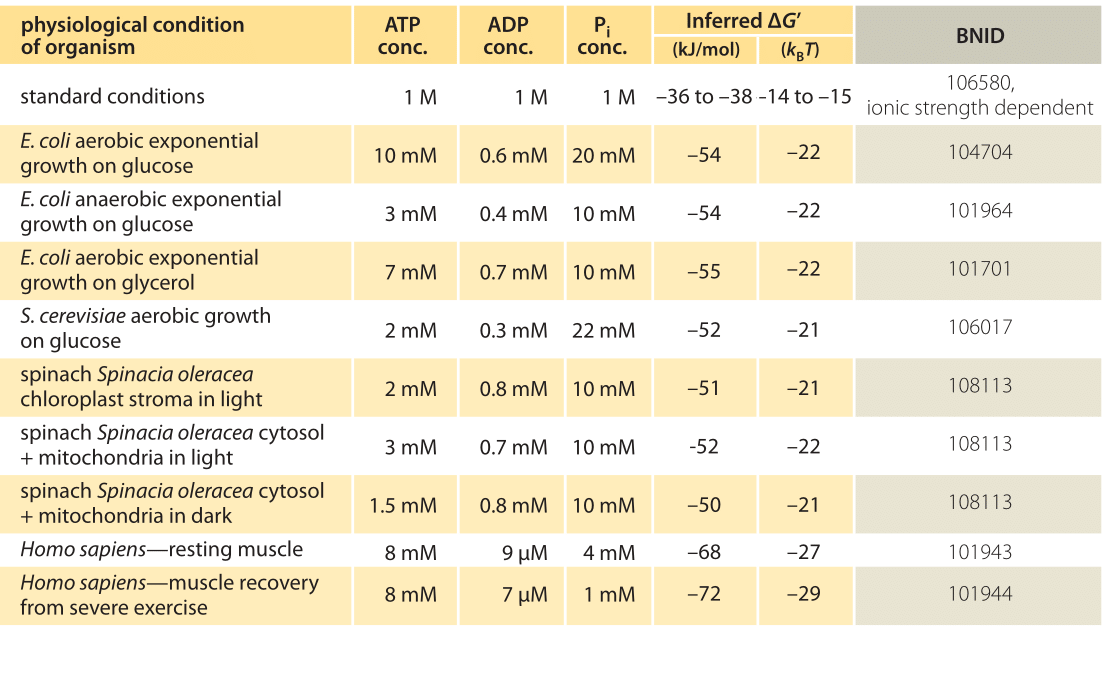
tabel 1: Fri energi til ATP-hydrolyse i forskellige organismer og under forskellige fysiologiske forhold. Udledte beregninger baseret på en værdi på 0 af -37,6 kJ/mol. Dette gør tabelværdierne konsistente indbyrdes, men skaber små afvigelser fra de værdier, der er rapporteret i de primære kilder. Sådanne afvigelser kan skyldes variationer i ionstyrke, pH og målemetoder forstyrrelser. Værdierne afrundes til et eller to signifikante cifre. I spinat, hvor Pi-koncentration ikke blev rapporteret, blev der anvendt en karakteristisk værdi på 10 mM (BNID 103984, 103983, 111358, 105540).
i praksis afhænger de fysiologiske forhold af den organisme, der undersøges, vævet eller rummet i den pågældende celle og af de nuværende energibehov for metaboliske og andre reaktioner. For eksempel i perfunderet rottelever ATP til ADP-forholdet viste sig at være omkring 10:1 i cytosolen, men 1:10 i mitokondrier under høje glykolysehastigheder, og under lave glykolysehastigheder var begge forhold meget tæt på 1 (BNID 111357). Der forventes derfor en række værdier for KPM. Nøglen til at forstå dette interval er at få en fornemmelse af, hvor meget K adskiller sig fra K, dvs.hvordan koncentrationerne adskiller sig fra standardbetingelser. De typiske intracellulære koncentrationer af alle relevante komponenter (ATP, ADP og Pi) ligger i mM-området, meget lavere end standardbetingelser. Forholdet / med koncentrationer i mM-området er meget lavere end en, og reaktionen vil være energisk gunstigere end ved standardbetingelser som vist i tabel 1. Den højeste værdi Kurt -70 kJ / mol (Kurt 30kBT) blev beregnet ud fra værdier i den menneskelige muskel hos atleter, der kom sig efter anstrengelse (BNID 101944). I E. coli-celler, der voksede på glukose, blev der rapporteret om en værdi på -47 kJ/mol (Kurt 20kbt, BNID 101964). For at sætte disse tal i perspektiv fungerer en molekylær motor, der udøver en kraft på cirka 5 pN (BNID 101832) over en 10 nm (BNID 101857) trinstørrelse, i orden 50 pN nm, hvilket kræver lidt mere end 10 kBT energi, godt inden for området, hvad en enkelt ATP kan levere.
beregningerne af larg kræver en nøjagtig måling af de relevante intracellulære koncentrationer. Sådanne koncentrationer måles in vivo hos mennesker ved anvendelse af nuklear magnetisk resonans. Den naturlige form for fosfor (31P) har magnetiske egenskaber, så der er ikke behov for at tilføje noget eksternt stof. Vævet af interesse, såsom muskler, placeres i et stærkt magnetfelt, og forskydninger i frekvensen af radioimpulser bruges til at udlede koncentration af ATP og Pi direkte fra toppe i NMR-spektre. I E. coli, koncentrationerne af ATP kan måles mere direkte med et ATP-bioluminescensassay. En prøve af voksende bakterier fjernet fra kulturen kan analyseres ved hjælp af luciferase, et protein fra bakterier, der lever i symbiose med blæksprutter, men som nu er tilsluttet biologernes værktøjskasse som molekylær reporter. ATP bruges i en reaktion, der producerer lys, der kan måles ved hjælp af et luminometer, og ATP-koncentrationen kan udledes af signalstyrken. Så vi har celleindhold som input, luciferase som en “enhed”, der omdanner mængden af ATP til lysemission, der tjener som det målte output. Ved hjælp af værktøjer som disse finder man, at ATP i “det virkelige liv” er værd omkring dobbelt så meget som under “standard” betingelser på grund af koncentrationerne er mere gunstige for den fremadrettede reaktion.
Vi afslutter med at bemærke, at det er et stående spørgsmål om, hvorfor adeninnukleotidet blev udpeget til at tjene som den vigtigste energivaluta med GTP og de andre nukleotider, der tjener meget mere mindre roller. Er det et tilfælde af tilfældigt valg, der senere blev “frosset ulykke”, eller var der en selektiv fordel for ATP i forhold til GTP, CTP, UTP og TTP?




