- introduktion
- materialer og metoder
- stammer
- DNA-ekstraktion
- STH1 og sth2 PCR-Amplifikationer
- DNA-sekventering
- Microplate Vero Cells præparater
- cellefrie bakteriepræparater
- cytotoksisk Assay og LD50-bestemmelse
- blokade-og Toksinneutraliseringsassay
- Omvs-indkøb og DNA-ekstraktion fra omvs
- resultater
- PCR-Gen-Amplifikationer
- DNA-sekventering
- cytotoksisk analyse og LD50-bestemmelse
- toksin neutralisering
- stks1 gen PCR-Amplifikationer fra omvs
- Diskussion
- Forfatterbidrag
- Finansiering
- interessekonflikt Erklæring
- anerkendelser
- forkortelser
introduktion
i flere år, betydningen af Aeromonas spp. flere undersøgelser viste, at den patogene mekanisme af Aeromonas er multifaktoriel, fordi mange virulensfaktorer er involveret, herunder produktion af cytotoksiner (Castro-Escarpulli et al., 2002, 2003). Disse toksiner kan forårsage diarre eller hæmoragisk colitis og kan spille en vigtig rolle i det hæmolytiske uremiske syndrom (HUS) og TTP-udvikling (Bogdanovi Kart et al., 1991; Fang et al., 1999; Monforte-Cirac et al., 2010).
de cytotoksiner, der er impliceret i disse sygdomme, omfatter Shiga-toksin og det nært beslægtede stks. Varianter er udtrykt i Shigella, Enterobacter, Citrobacter, Acinetobacter, Campylobacter og Hamiltonella bakteriearter (Mauro og Koudelka, 2011). Alperi og Figueras (2010) beskrev tilstedeværelsen af Sth1 og Sth2 i kliniske isolater af Aeromonas spp., forbundet med gastroenteritis, hæmoragisk colitis og HUS. Gener, der koder for disse toksiner, er placeret i forskellige lambdoidbakteriofager, der lysogeniserer denne stamme. Derudover har slægten Aeromonas et nul-sekretionssystem ved navn OMVs. OMV ‘er kan være et middel, hvormed nogle proteiner, RNA, periplasmiske rumkomponenter og andre komponenter forbundet med virulens kan overføres vandret til andre slægter; derfor antages det, at OMV’ er spiller en vigtig rolle i patogenicitet (Guerrero-Mandujano et al., 2015a, b).
af denne grund var formålet med denne undersøgelse at evaluere skader forårsaget af produktionen af stks af stammer isoleret fra bybørn i Vero-cellekulturer.
materialer og metoder
stammer
denne undersøgelse omfattede 66 kliniske isolater fra INP, 54 opnået fra tarm og 12 fra ekstra-intestinale infektioner. Stammer blev isoleret fra prøver opnået til rutinemæssig test på det nævnte hospital; derfor kræves der ikke informeret samtykke fra forældre eller værger til børn. Alle stammer blev genetisk identificeret af 16S rDNA-RFLP., 2011). Den typede stamme for Escherichia coli O157: H7 CECT 4076 blev anvendt som den positive kontrol, og E. coli K12-stamme (5512 ENCB) fra samlingen af Medical Bacteriology Laboratory (Escuela Nacional de Ciencias Biologicas, IPN) blev anvendt som den negative kontrol til toksinproduktion. Stammerne blev opretholdt i korte perioder ved stuetemperatur på blodagarbaserede skråninger; til længere opbevaring blev de enten frosset ved -70 liter C i 20% (vægt/v) glycerol-Todd-kylling bouillon (Oksoid) eller lyofiliseret i 7.5% hesteglucoseserum.
DNA-ekstraktion
alle kulturer blev dyrket på tryptisk sojaagar ved 30 liter C i 18 timer. DNA-renhed og-mængde blev bestemt ved anvendelse af Spektrofotometeret Ampli Kvantum AK-07. DNA blev opbevaret ved -20 liter C indtil brug.
STH1 og sth2 PCR-Amplifikationer
tilstedeværelsen af sth1 og sth2 fra DNA fra OMV ‘ er og genomisk DNA blev detekteret ved enkelt PCR-reaktioner ved anvendelse af primere STH1F/STH1R og STHF/STHR med henholdsvis et 144 og 217 BP-produkt, disse primere blev designet baseret på sekvensen af underenhed A. primerne, reaktionen og amplifikationsbetingelserne blev behandlet som tidligere beskrevet af Hernri al. (2013), med de positive (E. coli O157:H7) og negative (E. coli K12) kontroller.
DNA-sekventering
Polymerasekædereaktionsprodukter blev oprenset ved hjælp af et PureLink-Hurtiggelekstraktionskit (Invitrogen-kar) i henhold til producentens anvisninger. Produkterne blev direkte sekventeret på en Abi-PRISM 310 genetisk analysator (Applied Biosystems, Foster City, CA, USA) ved hjælp af de forreste og omvendte primere, der blev brugt til PCR, i henhold til producentens anvisninger. Sekventering blev udført på Instituto de biolog Kurra, UNAM. Sekvensanalyse blev udført med Basic Local Alignment Search Tool (BLAST) leveret af National Center for Biotechnology Information (NCBI).
Microplate Vero Cells præparater
denne procedure blev udført i 96-brønds mikroplader med Vero (ATCC CCL81) cellemonolag med 80% sammenløb, idet der blev tilsat minimalt essentielt medium (mem; Invitro Karrus) suppleret med 10% V / v føtalt bovint serum (FBS; Invitro Karrus).
cellesuspensionen blev homogeniseret og justeret til 105-106 celler / mL under anvendelse af et Neubauer-kammer. Efter justering blev suspensionen deponeret i 200-liter brønd. Mikropladerne blev inkuberet ved 37 liter C under 5% CO2 i 24 timer (CO2-inkubator, videnskabelig, USA)., 1994).
cellefrie bakteriepræparater
fem kolonier fra hver blodagarplade blev inokuleret i 3 mL Craig-medium (0, 4% gærekstrakt, 3% casaminosyrer, 0, 05% K2HPO4). Disse blev inkuberet i 24 timer ved 37 liter C, og den optiske densitet af den anvendte bakteriekultur var 0,25 ved 600 nm. Cellefrie præparater blev fremstillet ved centrifugering af kulturerne ved 14.000 g i 10 minutter ved 4 liter C efterfulgt af filtrering af supernatanten gennem et membranfilter (porestørrelse 0,45 pm, Sartorius Minisart NML). Cellefrie supernatanter blev opbevaret ved -20 liter C. I alt 66 cellefrie bakteriepræparater blev opnået på denne måde; den positive kontrol (E. coli O157:H7) og den negative kontrol (E. coli K12) blev også opnået på samme måde (Giono-Cereso et al., 1994).
cytotoksisk Assay og LD50-bestemmelse
det cellefrie filtrat (20 liter) blev inokuleret i brønde indeholdende celler og det respektive vækstmedium uden antibiotika. Inokulerede celler blev inkuberet i 96 timer ved 37 liter C med 5% CO2 og observeret hver 24.time på det inverterede mikroskop. Den cytotoksiske virkning forventedes at fremstå som afrunding og krympning af celler med tyk granulering og endelig progressiv og irreversibel ødelæggelse af monolaget. Alle tests blev udført i to eksemplarer; levedygtighedskontrol med MEM og Craig medium blev også udført., 1994).
LD50 blev bestemt i Aeromonas-stammer, der blev påvist som positive for at forårsage cytotoksisk skade i Vero-celler. En standard 96-brønds mikroplade med Vero-celler blev fremstillet som angivet i 2,6, men mediet blev ændret til 100 liter MEM med 1% BFS. Dette præparat blev udsat for 100 liter cellefrit bakteriepræparat, og serielle fortyndinger blev udført på hele rækken af plader. Efter 24 h inkubation ved 37 liter C med 5% CO2 blev LD50 bestemt under det inverterede mikroskop. LD50 blev tildelt brønden, hvor 50% af Vero-celler blev beskadiget og 50% ubeskadiget., 1986).
blokade-og Toksinneutraliseringsassay
toksinneutraliseringsassayet blev udført i de stammer, der inducerede cytotoksisk skade i Vero-celler, fordi denne skade er tegn på stks. Til denne test blev der fremstillet en mikroplade med Vero-celle dyrket til en sammenløb på 90-100% med LD50 af hvert cellefrit bakteriepræparat. For at udføre neutraliseringsanalysen for at vise celleskader produceret som en konsekvens af stks-virkning blev der anvendt to monoklonale antistoffer (Universidad Nacional aut Larsnoma de M) opnået fra E. coli O157:H7.
for hver AB blev der udført en Bradford-proteinkvantificering i henhold til producentens anvisninger (Biorad) med et resultat på henholdsvis 78,2 og 74,8 liter / liter af anti-Stk1 og anti-Stk2 A. den koncentrerede Ab blev bearbejdet og en dobbelt fortynding af Ab. Derefter inkuberes 10 liter af Ab (anti-STH1 eller anti-STH2) med 190 liter af den cellefrie supernatant i en koncentration på LD50 i 1 time ved 37 liter C. Derefter inokuleres 200 liter af sidstnævnte i Vero-celler ved 90% af sammenløbet og inkuberes i 24 timer ved 37 liter C med 5% CO2 (mærker et al., 1986).
Omvs-indkøb og DNA-ekstraktion fra omvs
ydre membranvesikler blev opnået fra Aeromonas hydrophila F-0050. Protokollen blev udført som tidligere beskrevet af Guerrero-Mandujano et al. (2015a).
OMVS’ DNA blev opnået ved hjælp af InstaGene-matricen (BioRad, Rusland) i henhold til producentens anvisninger. Derefter blev OMVS ‘ DNA oprenset med DNA-ekstraktion phenol-chloroform teknik (Guerrero-Mandujano et al., 2015b).
resultater
PCR-Gen-Amplifikationer
Polymerasekædereaktionsscreening af 66 kliniske Aeromonas-stammer viste, at 22/66 (33,3%) stammer indeholdt stk1-genet, 42/66 (63,6%) stammer indeholdt begge gener, ingen stammer indeholdt kun stk2-genet og 2/66 (3%) stammer var negative for begge gener.
DNA-sekventering
BLASTn-analyse viste en lighed på 79 til 99% og en forventet værdi på 3e-16/2e-97 mellem generne af E. coli O157:H7 og amplicon fra Aeromonas spp., stamme.
cytotoksisk analyse og LD50-bestemmelse
cytotoksicitetstesten udført i Vero-cellekulturer viste, at 17/66 (25,7%) cellefrie bakteriepræparater forårsagede cytotoksisk skade, hvilket antyder produktion af en aktiv stks (Figur 1), afsløret af den karakteristiske skade forårsaget af stks.
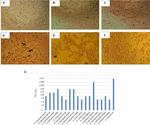
figur 1. Cytotoksicitetsanalyse og LD50-bestemmelse udført i Vero-cellekulturer. A) vero-cellekultur med minimalt essentielt Medium (Levedygtighedstest). (B) vero cellekultur med Craig Medium (Levedygtighedstest). C) negativ kontrol med E. coli K12. (D) positiv kontrol med E. coli O157: H7, cytotoksisk skade vises (pile) ved ødelæggelse af cellemonolaget og “gammel blonder” – effekt. E) cytotoksisk beskadigelse af A. hydrophila f-0050 stamme. F) cytotoksisk beskadigelse af A. caviae 421423 stamme. G) grafisk gengivelse af LD50-titeren for alle stammer.
resultaterne til bestemmelse af LD50-titeren var som følger: 6/17 (35,2%) cellefrie bakteriepræparater præsenterede en titer på 1:16; 5/17 (29,4%) cellefrie bakteriepræparater afbildede en titer på 1:8; 3/17 (17,6%) cellefrie bakteriepræparater havde en titer på 1:64; 2/17 (11,7%) cellefrie bakteriepræparater med en titer på 1:32; og 1/17 (5,8%) cellefrie bakteriepræparater med en titer på 1:256 (figur 1g).
toksin neutralisering
anvendelsen af anti-STKS1 Ab i 11/17 (64.7%) stammer skaden på celler i supernatanten blev fuldstændigt hæmmet ved 39,1 liter/liter AB-koncentration; i 4/17 (23,5%) cellefrie bakteriepræparater blev reduceret celleskade observeret ved den samme koncentration; og i 2/17 (11,7%) cellefrie bakteriepræparater blev celleskader fuldstændigt hæmmet ved en koncentration 78,2 liter/liter. 2 viste, at i 9/17 (52,9%) cellefrie bakteriepræparater blev celleskader fuldstændigt hæmmet ved 37,4 liter/liter, og 6/17 (35,2%) cellefrie bakteriepræparater viste reduceret celleskade ved samme koncentration; og i 2/17 (11.7%) cellefrie bakteriepræparater, blev celleskader fuldstændigt hæmmet med en Ab-koncentration på 74,8 liter/liter (figur 2 og 3).

figur 2. Inhibering af cytotoksisk virkning induceret i Vero-cellekultur ved cellefri bakteriepræparater af Aeromonas spp. stammer, der bærer genet sth1 eller sth2.
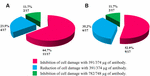
figur 3. Procentdel af stammer, der viste hæmning eller reduktion af celleskader. (A) neutralisering med anti-Stk1 Ab. (B) neutralisering med anti-Stk2 Ab.
stks1 gen PCR-Amplifikationer fra omvs
polymerasekædereaktion af OMVS’ DNA af A. hydrophila F-0050 afslørede OMVs indeholdt gen stks1; derfor kan OMVs være et potentielt middel til overførsel af horisontale virulensgener (figur 4).
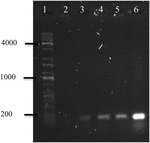
figur 4. Elektroferogram af stk1-genamplifikation fra OMVS ‘ DNA. (1) Kapa universel stige, (2) negativ kontrol, (3) OMV ‘er af A. hydrophila F-0050, (4) A. hydrophila F-0050, (5) OMV’ er af E. coli O157:H7 og (6) E. coli O157:H7.
Diskussion
slægten Aeromonas, som producent af stks, kan være et fremvoksende patogen, der hovedsageligt forårsager diarre hos pædiatriske patienter (Hernrich., 2011; Figueras og Baes-Hidalgo, 2014). Ikke desto mindre er denne slægt blevet mere relevant inden for det medicinske område, da det er et patogen, der forårsager HUS (San Joaku og Pickett, 1988; Bogdanovi Karin et al., 1991; Robson et al., 1992; Fang et al., 1999; Monforte-Cirac et al., 2010).
i denne undersøgelse fandt vi ved PCR-amplifikation af stk1-og stk2-generne, at 22/66 (33.3%) af aeromonad-stammerne indeholdt stks1-genet, 42/66 (63,6%) stammer indeholdt begge gener, og der var ingen stammer indeholdende stks2 alene. Dette kan få os til at antyde, at dette gen er bredt fordelt i Aeromonas-stammerne isoleret fra pædiatriske patienter, og at disse patienter kan være i fare for at udvikle HUS.
der er kun en tidligere rapport, hvor stks-generne blev undersøgt i Aeromonas-stammer isoleret fra forskellige hospitaler i Spanien; de opnåede resultater var, at 19/80 (23,7%) stammer havde stks1-genet og kun 1/80 (1.25%) stammen var positiv for begge gener (Alperi og Figueras, 2010). Disse resultater viser, at der er en større fordeling af genet i Meksikanske stammer; vi skal dog tage højde for, at Aeromonas-slægten i Spanien er et kendt gastrointestinalt patogen isoleret rutinemæssigt hos patienter med en gastrointestinal profil, derfor gives en passende behandling for at konfrontere denne slægt.denne slægt er ikke medtaget på listen over patogener, der forårsager diarre, og den er ikke isoleret rutinemæssigt; som følge heraf er det svært at give nogen behandling og god livskvalitet til patienterne, og der er desuden ingen statistikker om dens udbredelse. Derudover bliver slægten mere relevant på grund af de socioøkonomiske forhold i den Meksikanske befolkning, som inkluderer vandmangel; dette letter overførslen og øger muligheden for, at HUS bliver et folkesundhedsproblem.
sekventering af amplikonerne blev udført, og der blev udført en Blastsøgning, som viste 79-99% lighed og en forventet værdi på 3e-16/2e-97 mellem gener stks1/stks2 sammenlignet med E. coli O157:H7.
LD50 blev bestemt til at evaluere den cytotoksiske skade i Vero-cellekultur; med denne parameter og baseret på mærker et al. (1986), kan stammerne grupperes i lav (2 liter 101 til 6 liter 102), moderat (103-104) og høj (105-108) produktion (figur 1g). Et al. (1986) gennemførte en undersøgelse, hvor de foretog en lignende analyse som den i denne undersøgelse, men med forskellige stammer af STEC opnåede de, at 262/400 (63%) stammer blev grupperet som producenter med lav stks, og 48% producerede cytotoksisk skade; ikke desto mindre blev den cytotoksiske skade i 40% af disse stammer hæmmet med anti-stks antistoffer.
i denne undersøgelse forårsagede 25,7% af bakteriefrie præparater cytotoksisk skade, der var karakteristisk for stks i Vero-celler, hvilket antyder produktion af aktiv stks, alle Aeromonas-stammer blev grupperet som lave producenter af stks; imidlertid blev den cellulære skade hæmmet hos 50-70% af de cellefrie supernatanter, og hos 20-30% af cellefrie supernatanter blev den cellulære skade reduceret (figur 3). De cellefrie supernatanter, hvor celleskader blev reduceret, kunne dette have været på grund af to varianter i toksinet, der er til stede i supernatanten, og da de er forskellige immunologisk, kunne det ikke hæmmes fuldstændigt, og den cellulære skade forblev., 1986).
to tidligere undersøgelser., 1996; Alperi og Figueras, 2010) opnåede henholdsvis 10,2% og 10,53% af Aeromonas-stammerne. Årsagen til en højere procentdel af Aeromonas-stammer, der producerer aktiv stks, kan skyldes den høje tilgængelighed af stks-bakteriofagen inde i kulturen, da nogle STEC-stammer bærere af stks-bakteriofagen er blevet isoleret fra byspildevand fra rensningsanlæg, spildevand fra slagterier og kvægstole (Garca-Aljaro et al., 2004, 2009). Tilsvarende er der udført transduktionsundersøgelser in vivo med stks-fager fra E. coli, som kan inficere tarmmikrobiota-bakterier, hvilket giver den toksigeniske egenskab til stammer, der ikke var inficeret før (Acheson et al., 1998; Schmidt et al., 1999; Gamage et al., 2003). Det samme kunne ske med slægten Aeromonas, når man inducerer en gastrointestinal profil, efterfulgt af det faktum, at slægten Aeromonas har evnen til at fange og integrere virulensfaktorer i dets genom, og en af disse er det kodende gen.
resten af stammerne forårsagede cytotonisk skade i cellen, hvilket muligvis antyder produktion af andre toksiner end stks, da Aeromonas er en slægt, der er i stand til at producere to cytotoniske enterotoksiner, termostabil (AST) og termolabil (ALT) (Figueras og Baes-Hidalgo, 2014), der kan forårsage cytotonisk skade i Vero-celler; en anden mulighed er, at Aeromonas-stammerne har mere end en bakteriofag indsat i deres genom, da det er blevet påvist, at STEC-stammer med dobbelt lysogeni er i stand til at regulere bakteriofager for at hæmme kapaciteten af lytisk cyklusinduktion, hvilket resulterer i et fald i STC-produktion, men uden at miste genet (Garca-Aljaro et al., 2004; Imamovic og Muniesa, 2011). Derfor er det nødvendigt at fastslå, hvor mange bakteriofager Aeromonas-stammer indeholder, herunder i den foreliggende undersøgelse, for at kunne korrelere tilstedeværelsen af stks-bakteriofager og mængden produceret af stks.
på den anden side repræsenterer tilstedeværelsen af bakteriofager i inducerbare Aeromonas en vandret overførselsmekanisme for genet, men det er ikke den eneste. I nyere undersøgelser er det blevet bestemt, at Aeromonas er i stand til at producere OMV ‘ er (Guerrero-Mandujano et al., 2015a) og disse OMV ‘ er er i stand til at transportere integreret DNA (Guerrero-Mandujano et al., 2015b). I denne undersøgelse forstærkede vi stk1-genet fra DNA ‘et ekstraheret fra OMV’ erne af en A. hydrophila stamme af klinisk oprindelse, som inducerede cytotoksisk skade i Vero-celler, og denne skade blev hæmmet med anti-stk-antistoffer. Dette indikerer, at bakteriofagen er transportmekanismen for genet; desuden er OMV ‘ erne og det nyligt kaldte transportsystem Type 0 i stand til at sprede genet interspecies eller intraspecies. Ikke desto mindre er det nødvendigt at bekræfte, om genet indeholdt i omvs er komplet. Resultaterne opnået i denne undersøgelse understøtter hypotesen om, at genet er en anden formodet virulensfaktor for Aeromonas, der kan overføres gennem OMV ‘ er. Det kan repræsentere en anden mekanisme til horisontal transport af genet til andre Aeromonas-stammer og/eller andre bakterielle slægter.
af denne grund bør denne slægt inkluderes som mulig årsag til gastroenteritis, når man prøver at identificere årsagsmidler og bør rapporteres som en del af standard sundhedsovervågningsprocedurer.
Forfatterbidrag
IP-m og AG-m udførte eksperimenterne, og MR-R udførte bioinformatikanalyserne og udarbejdede manuskriptet; CH-C designede primeren; VB-G, og JM-l kommenterede og reviderede manuskriptet kritisk; GC-E udtænkte undersøgelsen, deltog i dens design og koordinering, vurderede dataene og udarbejdede manuskriptet. Alle forfattere læste og godkendte det endelige manuskript. Vi vil gerne takke Sofia Marteli Mulia for venlig at korrigere manuskriptets stil.
Finansiering
GC-E, VB-G modtaget støtte fra Estímulos al Desempeño da Investigación og Comisión y Fomento de Actividades Académicas (Instituto Politecnico Nacional) og Sistema Nacional de Investigadores (SNI, CONACyT). Denne undersøgelse blev finansieret af sekretariatet for forskning og Postgraduate fra National Polytechnic Institute (SIP 20160609). SIP-IPN var ikke involveret i udviklingen af undersøgelsesdesignet, indsamling, analyse, og fortolkning af data, i rapportens skrivning eller i beslutningen om at indsende papiret til offentliggørelse. IP-M og AG-M havde et stipendium fra CONACyT og BEIFI.
interessekonflikt Erklæring
forfatterne erklærer, at forskningen blev udført i mangel af kommercielle eller økonomiske forhold, der kunne fortolkes som en potentiel interessekonflikt.
anerkendelser
Vi takker Dr. Patricia Barbosa for at tilvejebringe stammeisolater og Dr. Armando Navarro for at tilvejebringe de monoklonale antistoffer.
forkortelser
Ab, antistof; HUS, hæmolytisk uræmisk syndrom; INP, Instituto Nacional de Pediatrica; LD50, Median letal dosis; OMVs, Outer membrane vesicles; PCR, Polymerase chain reaction; STEC, Shiga toxin-producing E. coli; Stx, Shiga-like toxin; TTP, Thrombotic thrombocytopenic purpura.
Acheson, D. W., Reidl, J., Zhang, X., Keusch, G. T., Mekalanos, J. J., and Waldor, M. K. (1998). In vivo transduction with shiga toxin 1-encoding phage. Infect. Immun. 66, 4496–4498.
Google Scholar
Alperi, A., and Figueras, M. J. (2010). Menneskelige isolater af Aeromonas besidder Shiga-toksingener er (sth1 og sth2) meget lig brovirulente genvarianter af Escherichia coli. Clin. Mikrobiol. Inficere. 16, 1563-1567. doi: 10.1111 / j. 1469-0691.2010. 03203.Google Scholar
CrossRef Fuld tekst/Google Scholar
Bogdanovic, R. (1991). Hæmolytisk-uræmisk syndrom forbundet med Aeromonas hydrophila enterocolitis. Pediatr. Nephrol. 5, 293-295. doi: 10.1007
CrossRef Fuld tekst | Google Scholar
Castro-Escarpulli, G., Aguilera-Arreola, M. G., M., soler, F. L., Et Al. (2002). Slægten Aeromonas > et vigtigt patogen i København? Enf. Infec. Mikrofon. 22, 206–216.
Google Scholar
Castro-Escarpulli, G., Figueras, M. J., Aguilera-Arreola, M. G., Soler, L., Fern Larsen, E., Aparicio, G. O., et al. (2003). Karakterisering af Aeromonas spp. isoleret fra frossen fisk bestemt til konsum. Int. J. Fødevarer Mikrobiol. 84, 41–49. doi: 10.1016 / S0168-1605 (02)00393-8
CrossRef fuldtekst | Google Scholar
Fang, J. S., Chen, J. B., Chen, V. J. og Hsu, K. T. (1999). Hæmolytisk-ureæmisk syndrom hos en voksen mand med Aeromonas hydrophila enterocolitis. Nephrol. Dial. Transplantation. 14, 439–440. doi: 10.1093/ndt / 14.2.439
CrossRef Fuld tekst / Google Scholar
Figueras, M. J. og Baes-Hidalgo, R. (2014). “Aeromonas,” i Encyclopedia of Food Microbiology, eds C. A. Batt og M. L. Tortorello (Cambridge, MA: Academic Press), 24-30.
Gamage, S. D., Strasser, J. E., kridt, C. L. og Vaiss, A. A. (2003). Ikke-patogen Escherichia coli kan bidrage til produktionen af shiga-toksin. Inficere. Immun. 71, 3107–3115. doi: 10.1128 / IAI.71.6.3107-3115.2003
CrossRef fuldtekst/Google Scholar
Garca-Aljaro, C., Muniesa, M., Jofre, J. og Blanch, A. R. (2004). Forekomst af stc2-genet i coliforme populationer fra vandmiljøer. Appl. Environ. Mikrobiol. 70, 3535–3540. doi: 10.1128 / AEM.70.6.3535-3540.2004
CrossRef fuldtekst/Google Scholar
Garca-Aljaro, C., Muniesa, M., Jofre, J. og Blanch, A. R. (2009). Genotypisk og fænotypisk mangfoldighed blandt inducerede, stks2-bærende bakteriofager fra miljømæssige Escherichia coli stammer. Appl. Environ. Mikrobiol. 75, 329–336. doi: 10.1128 / AEM.01367-08
CrossRef Fuld tekst / Google Scholar
Giono-Cereso, S., Rodr Ceres-Ceres, M. G., Rodr Ceres-Cadena, M. J. og Valdespino-g Ceres, J. L. (1994). Identifikation af enterotoksiner og cytotoksiner af Escherichia coli ved vero-cellekultur og fastfasehybridisering (colony blot). Pastor Latinoam. Mikrobiol. 36, 231–241.
Google Scholar
Guerrero-Mandujano, A. Produktion af ydre membranvesikler i en klinisk stamme af Aeromonas hydrophila. EC Microbiol. 1, 113–117.
Google Scholar
Guerrero-Mandujano, A., Palma-Martsen, I. og Castro-Escarpulli, G. (2015b). Transport DNA ved ydre membranvesikler af Aeromonas hydrophila. EC Microbiol. 2, 354–357.
Google Scholar
hake, K. M., Sugiyama, A., Ivade, Y., Midorikova, Y. og Yamauchi, T. (1996). Diarreale og miljømæssige isolater af Aeromonas spp. fremstil et toksin svarende til shiga – lignende toksin 1. Curr. Mikrobiol. 32, 239–245. doi: 10.1007/s002849900043
CrossRef Fuld tekst | Google Scholar
hernia-Cortes, C., Aguilera-Arreola, M. G., Ch-pervers-m-pervers, Y., Arsate-Barbosa, P., Lara-Castro-escarpulli, G. (2011). Genetisk identifikation af stammer af Aeromonas spp. isoleret ved National institute of pediatrics. Pastor Enfer. Infecc. Pædiatrisk. 24, 157–165.
Google Scholar
Hernrick-Cortes, C., M-Tenorio, A., Aguilera-Arreola, M. G. og Castro-Escarpulli, G. (2013). Design og standardisering af fire multiplekspolymerasekædereaktioner til påvisning af bakterier, der forårsager gastrointestinale sygdomme. Afr. J. Microbiol. 7, 2673-2681. doi: 10.5897 / AJMR2013.5452
CrossRef Fuld tekst | Google Scholar
Imamovic, L., Og Muniesa, M. (2011). Kvantificering og evaluering af infektiviteten af Shiga-toksinkodende bakteriofager i oksekød og salat. Appl. Environ. Mikrobiol. 77, 3536–3540. doi: 10.1128 / AEM.02703-10
CrossRef Fuld tekst / Google Scholar
mærker, L. R. O ‘ Brien, A. D. (1986). Produktion af shiga – lignende toksin af Escherichia coli. J. Inficere. Dis. 154, 338–341. doi: 10.1093 / infdis / 154.2.338
CrossRef Fuld tekst | Google Scholar
Mauro, S. A. og Koudelka, G. B. (2011). Shiga-toksin: udtryk, distribution og dets rolle i miljøet. Toksiner 3, 608-625. doi: 10.3390 / toksiner3060608
CrossRef Fuld tekst/Google Scholar
Monforte-Cirac, M. L., Palacian-Ruis, M. P., Aisa-Iriarte, M. L., og Espuelas-Monge, M. (2010). Hemolytisk uremisk syndrom af Aeromonas: om et klinisk tilfælde. Pastor Clin. Ånd. 210, 206–207. doi: 10.1016 / j. cer.2009.08.002
CrossRef Fuld tekst / Google Scholar
Robson, L. M., Leung, A. K. C. og Trevenen, C. L. (1992). Hæmolytisk-uræmisk syndrom forbundet med Aeromonas hydrophila enterocolitis. Pædiatrisk. Nephrol. 6, 221–222. doi: 10.1007
CrossRef Fuld tekst / Google Scholar
San Joakin, V. H. og Pickett, D. A. (1988). Aeromonas-associeret gastroenteritis hos børn. Pediatr. Inficere. Dis. J. 7, 53-57. doi: 10.1097/00006454-198801000-00013
CrossRef Fuld tekst / Google Scholar
Schmidt, H., Bielasjska, M. Og Karch, H. (1999). Transduktion af enteriske Escherichia coli isolater med et derivat af shiga-toksin 2-kodende bakteriofag f3538 isoleret fra Escherichia coli O157:H7. Appl. Environ. Mikrobiol. 65, 3855–3861.
Google Scholar