Normal cellemetabolisme afhænger af vedligeholdelsen af blod phinden for meget snævre grænser (7,35-7,45).
selv relativt milde udflugter uden for dette normale pH-område kan have skadelige virkninger, herunder reduceret iltforsyning til væv, elektrolytforstyrrelser og ændringer i hjertemuskelkontraktilitet; overlevelse er sjælden, hvis blodets pH falder under 6,8 eller stiger over 7,8.
problemetfor kroppen er, at normal metabolisme er forbundet medkontinuerlig produktion af hydrogenioner (h+) og kulsyre(CO2), som begge har tendens til at reducere pH. mekanismensom overvinder dette problem og tjener til at opretholde normal blod-pH(dvs.bevare syre-base homeostase) er en kompleks synergihandling, der involverer kemiske buffere i blod, de røde celler(erythrocytter), som cirkulerer i blod og funktionen af treorganer: lunger, nyrer og hjerne.
før du forklarer, hvordan disse femelementer bidrager til den samlede vedligeholdelse af blodets pH, detville være nyttigt at hurtigt gennemgå nogle grundlæggende begreber.
- hvad er en syre, hvad er en base og hvad er pH?
- Hvad er en buffer? – bicarbonatbuffersystemet
- lungefunktion, transport af CO2 og syre-basebalance
- nyrer og syre-base balance
- forstyrrelser af syre-BASE BALANCE
- årsager til syre-base forstyrrelser
- respiratorisk acidose – (hævet pCO2(a),reduceret pH)
- respiratorisk alkalose – (reduceretpco2(a), øget pH)
- metabolisk acidose – (faldethco3–, nedsat pH)
- metabolisk alkalose – (øgethco3– , øget pH)
- kompensation – en konsekvens af syre-baseforstyrrelse
- blandede syre-base forstyrrelser
- Resume
- nogle foreslog viderelæsning
hvad er en syre, hvad er en base og hvad er pH?
en syre er et stof, der frigiverhydrogenioner (H+) ved dissociation i opløsning.
for eksempel: Saltsyre (HCl) dissocierer til hydrogenioner og chloridioner
HCl ![]() H+ + Cl-
H+ + Cl-
kulsyre (H2CO3) dissocierer tilhydrogenioner og bicarbonationer
H2CO3 ![]() H+ +HCO3–
H+ +HCO3–
Vi skelner mellem stærke syrer som saltsyre ogsvage syrer som kulsyre. Forskellen er, at stærke syrerdissociere mere end svage syrer. Derfor er hydrogenionkoncentrationen af en stærk syre meget højere end for en svagsyre.
en base er et stof, som i opløsning acceptererhydrogenioner.
for eksempel accepterer basisbicarbonat (HCO3–)hydrogenioner til dannelse af kulsyre:
HCO3– + H+ ![]() H2CO3
H2CO3
pH er en skala på 0-14 af surhed og alkalinitet. Rent vand har en pH på 7 og er neutral (hverken sur eller alkalisk). pH over 7ER alkalisk og under 7 sur. Således er blodets pH (7,35-7,45) lidt alkalisk, selvom udtrykket alkalosiser i klinisk medicin måske forvirrende forbeholdt blodets pH større end 7.45og udtrykket acidose er forbeholdt pH i blodet mindre end 7,35.
pH er et mål for hydrogenionkoncentration (H+).De to er relateret i henhold til følgendekvation:
pH = – log10
hvor er koncentrationen af hydrogenioner inmol pr. liter (mol/L)
fra denne ligning
pH 7,4 = h+ koncentration på 40 nmol/L
pH 7,0 = h+ koncentration på 100 nmol/L
pH 6,0 = h+ koncentration på 1000 nmol/L
det er klart, at:
- de to parametre ændres omvendt; da hydrogenionkoncentrationen stiger, falder pH
- på grund af det logaritmiske forhold er en stor ændring i hydrogenionkoncentrationen faktisk en lille ændring i pH. for eksempel fordobler hydrogenionkoncentrationen pH med kun 0,3
Hvad er en buffer? – bicarbonatbuffersystemet
buffere er kemikalier i opløsning, som minimerer ph-ændringen, der opstår, når syrer tilsættes ved at ‘moppe op’ hydrogenioner. En buffer er en opløsning af en svag syre og denskonjugatbase. I blod er princippet buffersystem den svagesyre, kulsyre (H2CO3) og dens konjugatbase, bicarbonat (HCO3–). For at forklare hvordandette system minimerer ændringer i pH, Antag at vi tilføjer en stærk syre,f. eks. HCl, til bicarbonatbufferen:
syren vil dissociere og frigive hydrogenioner:
HCl ![]() H + + Cl-
H + + Cl-
bicarbonatbufferen absorberer derefter ‘hydrogenionerne’ og danner carbonsyre i processen:
HCO3– + H+ ![]() H2CO3 (kulsyre)
H2CO3 (kulsyre)
det vigtige punkt er, at fordi hydrogenionerne fra Hclhar været inkorporeret i den svage kulsyre, som ikke adskiller sig så let, det samlede antal hydrogenioner i opløsningog derfor ændrer pH ikke så meget, som det ville have forekommeti fravær af bufferen.
selvom en buffer i høj grad minimerer pH-ændring, eliminerer den ikke det, fordi selv en svag syre (somkulstofsyre) dissocierer til en vis grad. PH af en bufferopløsning er en funktion af de relative koncentrationer af svagsyre og dens konjugerede base.
pH = 6,1 + log ( / )
hvor = koncentration afbicarbonat
= koncentration af kulsyre
dette forhold, kendt som Henderson-Hasselbalch ligning,viser, at pH styres af forholdet mellem base(HCO3–) koncentration og syre(H2CO3) koncentration.
som hydrogenioner tilsættes til bicarbonatbufferen:
H+ +HCO3– ![]() H2CO3
H2CO3
bicarbonat (base) forbruges (koncentration falder) ogcarbonsyre produceres (koncentration stiger). Hvis hydrogenioner fortsætter med at blive tilsat, vil alt bicarbonat til sidst blive forbrugt (omdannet til kulsyre), og der ville være nobuffering effekt – pH ville så falde kraftigt, hvis mere syre blev tilsat.
Hvis kulsyre imidlertid kontinuerligt kunne fjernes fra systemet og bicarbonat konstant regenereres, kunne bufferkapaciteten og derfor pH opretholdes på trods af fortsat tilsætning af hydrogenioner.
som det vil blive klart med flere detaljer om fysiologien afsyre-base balance, det er faktisk hvad der sker i kroppen. I det væsentlige, lungerne sikre fjernelse af kulsyre (som kulsyre) og nyrerne sikre kontinuerlig regenerering afbicarbonat.
denne rolle af lungerne er afhængig af en singularkarakteristisk for bicarbonatbuffersystemet, og det er kulsyrens evne til at omdannes til kulsyre ogvand.
den følgende ligning skitserer forholdet mellem alleelementer i bicarbonatbuffersystemet, som det fungerer ikrop
H+ +HCO3– ![]() H2CO3
H2CO3 ![]() H2O + CO2
H2O + CO2
det er vigtigt at bemærke, at de to elementer i bicarbonatbuffersystemet er reaktionerne er reversible.Retning er afhængig af den relative koncentration af hverelement. En stigning i kulstofkoncentration tvinger reaktion til venstre med øget dannelse af kulsyre og i sidste ende hydrogenioner.
Dette forklarer kulsyre potentiale og bringer os til den vigtige bidrag, som lungerne og røde blodlegemer gør til den samlede syre-basebalance.
lungefunktion, transport af CO2 og syre-basebalance
en konstant mængde CO2 i blod, der er afgørende for normalsyre-base balance, afspejler en balance mellem den, der produceres som et resultat af vævscellemetabolisme, og den, der udskilles af lungerne uden luft.
Ved at variere den hastighed, hvormed kulsyre erudskilles, lungerne regulerer blodets indhold af kulsyre.Sekvensen af begivenheder fra kulsyre produktion ivæv til eliminering i udløbet luft er beskrevet i Fig. 1.Kulsyre diffunderer ud af vævsceller til omgivelserkapillært blod (Fig. 1a). En lille del opløses i blodplasma og transporteres uændret til lungerne.
men de fleste diffusererind i røde celler, hvor det kombineres med vand for at danne kulsyre.Syren dissocierer med produktion af hydrogenioner ogbicarbonat. Hydrogenioner kombineres med iltet hæmoglobin(hæmoglobin virker som en buffer her), hvilket forhindrer en farligfald i cellulær pH, og bicarbonat diffunderer langs en koncentrationgradient fra røde blodlegemer til plasma.
således transporteres det meste af det kulstof, der produceres i vævene, til lungerne som bicarbonati blodplasma.
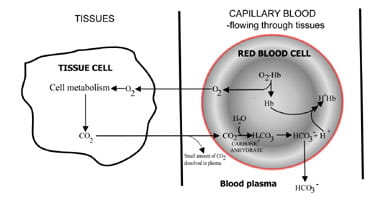
Fig. 1A. CO2 produceret i vævkonverteret til bicarbonat til transport til lunger.
|
|
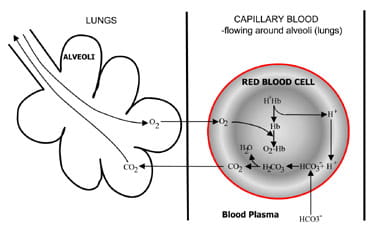
Fig. 1b. At the lungs bicarbonate convertedback to CO2 and eliminated by the lungs.
Ved alveolerne i lungerne vendes processen (Fig. 1b).Hydrogenioner forskydes fra hæmoglobin, da det optager iltfra inspireret luft. Hydrogenionerne bufres nu afbicarbonat, som diffunderer fra plasma tilbage til røde blodlegemer, og der dannes carbonsyre. Da koncentrationen af dette stiger, er detomdannet til vand og kulsyre. Endelig diffunderer kulstofdioksidenaf en koncentrationsgradient fra røde blodlegemer til alveoler tiludskillelse i udløbet luft.
respiratoriske kemoreceptorer i hjernestammen reagerer på ændringeri koncentrationen af kulilte i blod, hvilket forårsager øgetventilation (vejrtrækning), hvis koncentrationen af kulilte stiger ogreduceret ventilation, hvis kulilte falder.
nyrer og syre-base balance
Normal cellulær metabolisme resulterer i kontinuertproduktion af hydrogenioner. Vi har set, at ved at kombinere med disse hydrogenioner minimerer bicarbonatbufferen i blodet deres virkning. Buffering er dog kun nyttig på kort sigt,og i sidste ende skal hydrogenioner fjernes fra kroppen.Desuden er det vigtigt, at bicarbonatet, der bruges tilbufferhydrogenioner udskiftes kontinuerligt.
disse to opgaver,eliminering af hydrogenioner og regenerering af bicarbonat, erudført af nyrerne. Renale tubulaceller er rige påsymet carbonanhydrase, hvilket letter dannelsen af carbonsyre fra kulsyre og vand. Kulsyre dissocierer tobicarbonat og hydrogenioner. Bicarbonatet reabsorberes iblod, og hydrogenionerne passerer ind i tubulumets lumen oger elimineret fra kroppen i urinen.
denne urineliminering erafhængig af tilstedeværelsen i urin af buffere, hovedsagelig fosfat og ammoniakioner.
forstyrrelser af syre-BASE BALANCE
de fleste syre-base forstyrrelser skyldes
- sygdom eller skade på organer (nyre, lunger, hjerne), hvis normale funktion er nødvendig for syre-base homeostase,
- sygdom, der forårsager unormalt øget produktion af metaboliske syrer, således at homeostatiske mekanismer overvældes
- medicinsk intervention (f. eks. ventilation, nogle lægemidler)
arterielle blodgasser er blodprøven, der bruges til at identificere ogovervåge syre-base forstyrrelser. Tre parametre målt underblodgasanalyse, arterieblod pH (pH), partialtryk af kulsyre i arterielt blod (pCO2(a)) ogkoncentration af bicarbonat (HCO3–) er af afgørende betydning (se tabel i for reference (normalt) interval).Resultaterne af disse tre tillader klassificering af syrebaseforstyrrelse til en af fire etiologiske kategorier:
- Respiratory acidosis
- Respiratory alkalosis
- Metabolic acidosis
- Metabolic alkalosis
|
Adults |
Neonates |
|
|
pH |
7.35-7.45 |
7.30-7.40 |
|
pCO2 (kPa) |
4.7-6.0 |
3.5-5.4 |
|
Bicarbonate |
22-28 |
15-25 |
TABLE I. Omtrentlige reference(normale)intervaller
for at forstå, hvordan resultaterne af pH, pCO2 (A)og bicarbonat bruges til at klassificere syre-base forstyrrelser i dettemåde, vi skal vende tilbage til Henderson-Hasselbalch ligningen
pH = 6,1 + log ( / )
Vi måler pH og bicarbonat, men ikke kulsyre (H2CO3). Der er dog et forholdmellem pCO2 (a) og H2CO3, som tillader omlægning af Henderson-Hasselbalch-ligningen interms af de tre parametre (pH, pCO2(a) ogbicarbonat) målt under blodgasanalyse:
pH = 6,1 + log ( /( pCO2(a) karbonat0.23))
Ved at fjerne alle konstanter fra denne ligning kan forholdet mellem de tre målte parametre forenkles:
ph-værdi / pCO2(a)
dette forhold, der er afgørende for en forståelse af alt detfølger vedrørende syrebaseforstyrrelser, siger, at arterielblodets pH er proportional med forholdet mellem bicarbonatkoncentrationtil pCO2(a). Det tillader følgendeduktioner:
- pH forbliver normal, så længe forholdet : pCO2(a) forbliver normalt
- pH stiger (dvs.alkalose forekommer), hvis enten øges eller pCO2(a) falder.
- pH falder (dvs. hvis enten falder eller pCO2(a) stiger
- hvis begge pCO2(A) og øges med relativt samme mængde, er forholdet og derfor pH normalt
- hvis begge pCO2 (A) og reduceres med relativt samme mængde, er forholdet og derfor pH normalt.
syre-base forstyrrelser påvirker primært entenpco2 (a), i hvilket tilfælde Det kaldes arespiratorisk forstyrrelse, eller i hvilket tilfælde Det kaldes Anon-respiratorisk eller metaboliskforstyrrelse:
- hvis den primære forstyrrelse er en hævet pCO2(A) (som forårsager acidose – se ovenfor), kaldes tilstanden respiratorisk acidose
- hvis den primære forstyrrelse er en reduceret pCO2(A) (som forårsager alkalose – se ovenfor), kaldes tilstanden respiratorisk alkalose
- hvis den primære forstyrrelse er forbundet med reduceret bicarbonat (hvilket resulterer i acidose – se ovenfor), kaldes tilstanden metabolisk acidose
- hvis den primære forstyrrelse er forbundet med hævet bicarbonat (hvilket resulterer i acidose) resultater i alkalose – se ovenfor), tilstanden kaldes metabolisk alkalose
årsager til syre-base forstyrrelser
respiratorisk acidose – (hævet pCO2(a),reduceret pH)
respiratorisk acidose er karakteriseret ved øgetpco2(A) på grund af utilstrækkelig alveolær ventilation(hypoventilation) og deraf følgende reduceret eliminering afco2 fra blodet. Luftvejssygdomme, såsombronkopneumoni, emfysem, astma og kronisk obstruktiv luftvejesygdom, kan alle være forbundet med hypoventilation tilstrækkelig tilforårsage respiratorisk acidose.
nogle lægemidler (f. eks. morfin ogbarbiturater) kan forårsage respiratorisk acidose ved at deprimererespiratorisk center i hjernen. Skader eller traumer på brystvæggenog muskulaturen involveret i åndedrætsmekanikken kanreducere ventilationshastigheden. Dette forklarer respiratorisk acidoseder kan komplicere sygdomsforløbet som poliomyelitis,Guillain-Barre syndrom og genopretning fra alvorligt brysttraume.
respiratorisk alkalose – (reduceretpco2(a), øget pH)
derimod er respiratorisk alkalose karakteriseret ved faldetpco2(A) på grund af overdreven alveolær ventilationog resulterende overdreven eliminering af CO2 fra blod.Sygdom, hvor der på grund af reduceret ilt i blodet (hypoksæmi) stimuleres respiratorisk center kan resultere i åndedrætsalkalose.
eksempler her omfatter alvorlig anæmi, lungeemboliog voksen respiratorisk syndrom. Hyperventilation tilstrækkelig tilforårsage respiratorisk alkalose kan være et træk ved angstanfald ogsvar på svær smerte. En af de mindre velkomne egenskaber vedsalicylat (aspirin) er dets stimulerende virkning på åndedrætsorganetcenter. Denne effekt tegner sig for respiratorisk alkalose, somopstår efter overdosering af salicylat. Endelig overenthusiastiskmekanisk ventilation kan forårsage respiratorisk alkalose.
metabolisk acidose – (faldethco3–, nedsat pH)
reduceret bicarbonat er altid et træk ved metabolicacidose. Dette sker af en af to grunde: øget anvendelse afbicarbonat i buffering af en unormal syrebelastning eller øget tabaf bicarbonat fra kroppen. Diabetisk ketoacidose og lacticacidose er to tilstande, der er kendetegnet ved overproduktion af metaboliske syrer og deraf følgende udmattelse af bicarbonat.i det første tilfælde afspejler unormalt høje blodkoncentrationer af keto-syrer(B-hydroksysmørsyre og aceteddikesyre) de alvorlige stofskifteforstyrrelser, der skyldes mangel på insulin.
alle celler producerer mælkesyre,hvis de mangler ilt, så øget mælkesyreproduktion og resulterende metabolicacidose forekommer i enhver tilstand, hvor ilttilførsel tilvæv er alvorligt kompromitteret.
eksempler inkluderer hjertestop og enhver tilstand forbundet med hypovolemisk chok (f.eks. massivt væsketab). Leveren spiller en vigtig rolle i fjernelsen af den lillemængde mælkesyre, der produceres under normal cellemetabolisme, således at mælkesyreacidose kan være et træk ved leversvigt.
unormalt tab af bicarbonat fra kroppen kan forekomme underalvorlig diarre. Hvis det ikke er markeret, kan dette føre til metabolisk acidose.Manglende regenerering af bicarbonat og udskillelse af hydrogenionerforklarer den metaboliske acidose, der forekommer i renalfejl.
metabolisk alkalose – (øgethco3– , øget pH)
bicarbonat hæves altid i metabolisk alkalose. Sjældent kan overdreven administration af bicarbonat eller indtagelse af bicarbonati antacidpræparat forårsage metabolisk alkalose, men det ernormalt forbigående. Unormalt tab af hydrogenioner fra kroppen kanvære det primære problem. Bicarbonat, som ellers ville blive forbrugt i buffering af disse tabte hydrogenioner som følge heraf akkumuleres i blod. Mavesaft er sur og gastriskaspiration eller enhver sygdomsproces, hvor maveindholdet ertabt fra kroppen repræsenterer et tab af hydrogenioner.
denprojektil opkastning af mavesaft forklarer for eksempelmetabolisk alkalose, der kan forekomme hos patienter med pyloricstenose. Alvorlig kaliumudtømning kan forårsage metabolisk alkalosepå grund af det gensidige forhold mellem hydrogen og kaliumioner.
kompensation – en konsekvens af syre-baseforstyrrelse
det er afgørende for livet,at pH ikke afkald for langt fra normal, og kroppen vil altid forsøge at returnere en unormal pH modnormal når syre-base balance forstyrres. Kompensation gives derefter til denne livsbevarende proces. For at forståkompensation er det vigtigt at huske, at pH styres af theratio : pCO2(A).så længe forholdet er normalt, vil pH være normalt.
overvej patienten med metabolisk acidose, hvis pH er lavfordi bicarbonat er lavt. For at kompensere for det lave og genoprettedet vigtige forhold mod det normale skal patienten sænke hispCO2 (a). Kemoreceptorer i åndedrætscentrum af hjernen reagerer på en stigende hydrogenionkoncentration (lav pH), hvilket forårsager øget ventilation(hyperventilation) og dermed øget eliminering af kulilte; pCO2(a) falder, og forholdet : pCO2 (a) vender tilbagetil normal.
kompensation for metabolisk alkalose, hvor der er høj, derimod involvererdepression af respiration og derved tilbageholdelse af carbon dioksiderså pCO2(a) stiger for at matche stigningenin . Imidlertid har depression afåndedræt den uvelkomne bivirkning af truende tilstrækkeligtiltdannelse af væv. Af denne grund respiratorisk kompensation afmetabolisk alkalose er begrænset.
primære forstyrrelser af pCO2(a) (åndedrætsacidose og alkalose) kompenseres ved nyrejusteringer af udskillelse af hydrogen ion, hvilket resulterer i ændringer, der kompenserer passende for primær ændring i pCO2(a). Således involverer renalkompensation for respiratorisk acidose (raisedpCO2(a)) øget reabsorption afbicarbonat, og renal kompensation for respiratorisk alkalose(reduceret pCO2(a)) involverer reduceret bicarbonatereabsorption.
begrebet syre-base balance under kompensationoverføres visuelt i Fig. 2. Tabel II opsummerer blodgassenresultater, der karakteriserer alle fire syre-base forstyrrelser førog efter kompensation.
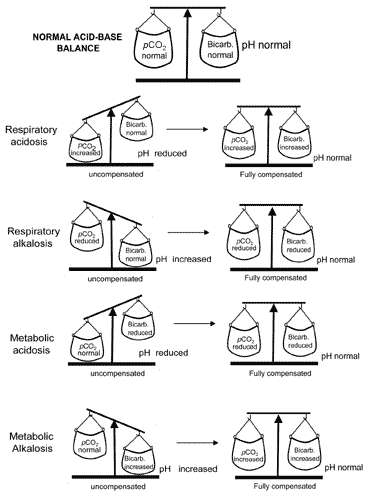
Fig. 2. “Syre-base balance” : compensationrestores normal pH
|
Primary disturbance |
||||
|
Respiratory |
Repiratory |
Metabolic |
Metabolic |
|
|
Some |
Emphysema |
Hyper- |
Renal failure |
Bicarbonate Potassium |
|
Compen- |
RENAL |
RENAL |
RESPIRA- |
RESPIRA- |
|
Initial blood |
pH |
pH |
pH |
pH |
|
Blood gas |
ph pCO2 |
pH pCO2 |
ph pCO2 |
begrænset |
|
Blood gas |
pH normal |
pH normal |
pH normal |
Limited |
Printfriendly version af tabel, pdf.
tabel II. blodgas resulterer i forstyrrelser afsyre-base balance
respiratorisk kompensation for en primær metabolisk forstyrrelseforekommer meget hurtigere end metabolisk (renal) kompensation for en primær respiratorisk forstyrrelse. I det andet tilfælde kompensationforekommer over dage snarere end timer.
Hvis kompensationen resulterer i tilbagevenden af pH til normal, siges patienten at være fuldt kompenseret. Men i mange tilfælde vender kompensationen tilbage til normal uden faktisk at opnå normalitet; i sådanne tilfældepatienten siges at være delvist kompenseret.
forårsager beskrevet ovenfor er metabolisk alkalose meget sjældent fuldkompenseret.
blandede syre-base forstyrrelser
det kan antages ud fra ovenstående diskussion, atalle patienter med syre-base forstyrrelse lider kun af en affire kategorier af syre-base balance. Dette kan godt være tilfældet, men under særlige omstændigheder kan patienter præsentere mere enden forstyrrelse.
for eksempel overveje patienten med en kronisklungesygdom som emfysem, der har en langvarig delvistkompenseret respiratorisk acidose. Hvis denne patient også var adiabetiker, som ikke havde taget sin normale insulindosis og som følge heraf var i en tilstand af diabetisk ketoacidose, ville blodgasresultaterne afspejle den kombinerede virkning af både respiratorisk acidose og metabolsk acidose.
sådanne blandede syre-base forstyrrelser er ikkesjældne og kan være vanskelige at opklare på basis af arterielleblodgasresultater alene.
Resume
vedligeholdelsen af normal blod pH involverer flere organsystemerog afhænger af kredsløbets integritet. Det er ikke overraskende daden forstyrrelse af syre-base balance kan komplicere forløbet afmeget forskellige sygdomme såvel som traumer til mange dele afkrop. Kroppen har betydelig magt til at bevare blodets pH, ogforstyrrelser indebærer normalt enten alvorlig kronisk sygdom eller akutkritisk sygdom.
resultaterne af arteriel blodgasanalyse kanidentificere syre–base forstyrrelse og give værdifuld information somtil dens årsag.
nogle foreslog viderelæsning
- Thomson, Adams JF. Klinisk syre-base balance. 1997
- Harrison RA. Syre-base balance. Respir pleje Clin N. Amerika 1995; 1,1: 7-21
- trætræ P. arteriel blodgasanalyse. Sygepleje Standard 2004; 18,21: 45-52
- Sirker AA, Rhodes a, Gounds RM, Bennet Red. Syre-base fysiologi: den ‘traditionelle’ og den ‘moderne’ tilgang. Anæstesi 2002; 57: 348-56