přenašeči nemoci (konkrétně biologické přenos spíše než mechanické) je ten, ve kterém přenosu infekce v populaci (hostitelská populace) dochází jen prostřednictvím druhého populace (vektory). Vektory jsou obvykle hematofágní (krmení krví) členovci, jako jsou komáři, sandflies nebo klíšťata. Existuje mnoho takových onemocnění, jejichž dynamika je velmi zajímavá z hlediska kontroly infekce. Malárie, leishmanióza, horečka dengue a virus západního Nilu jsou jen některé, které mají v současné době obrovský sociální dopad na lidské populace.
každý rok v oblasti 225 milionů lidí je infikováno parazitem malárie a v roce 2009 přibližně 781 000 z nich vedlo k úmrtnosti vyvolané onemocněním. Příběh je podobný pro leishmanióza tam, kde jsou kolem 12 milionů lidí po celém světě, kteří jsou myšlenka být nakažený v daném čase a asi 80 000 lidí ročně zemře na nejzávažnější forma, viscerální leishmanióza. Taková onemocnění jsou v rozvojovém světě rozšířená; kombinace optimální prostředí pro vektory v tropických oblastech a nedostatek lékařské pomoci vést k rozsáhlé endemics.
Lidské nemoci nejsou jediným problémem; existuje mnoho dalších, které infikují jiné skupiny hostitelů, které jsou také zajímavé, a to zejména z hlediska ochrany ohrožených druhů.
typický průběh infekce přenášené vektory převodovka, ignorování onemocnění, hostitele nebo vektor specika, začíná s infikovaným vektorem (krevní krmení nebo sání dospělé členovci) s krví jídlo z vnímavých členem hostitelské populace. Po kousnutí má hostitel šanci nakazit se touto chorobou. V této fázi, pokud je infikován, je hostitel považován za exponovaný, ale nevyléčí žádné nepříznivé účinky infekce a nemůže nemoc přenášet. Doba po nakažení, ale před tím, než se stane infekční, je známá jako doba latence. Když parazit dosáhl určité fázi v jeho reprodukční cyklus, hostitel se stává infekční, po které, pokud je pokousaný, to může přenášet onemocnění na citlivých vektorové prostřednictvím svého parazita-infikované krve a dokončení přenosu cyklu (znázorněno na obrázku níže).
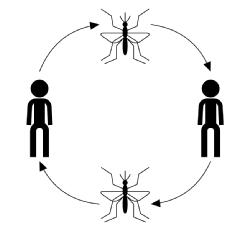
přenos choroby je obvykle charakterizován:
- množství a prostorového šíření obou hostitelů a vektorů
- demografie
- rychlost krmení nebo vektor touha kousnout
- úspěch nebo selhání přenosu
Obvykle matematických modelů nemocí přenášených vektory jsou založeny na dvou-obyvatelstvo SI(R) model vykazuje „criss-cross“ infekce podmínky, kde jsou síly infekce podmínky pro hostitelů a vektorů, resp.:
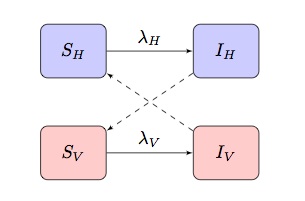
V závislosti na modelované nemoci a populaci může být toto přizpůsobeno tak, aby zahrnovalo další specifičtější rysy.
Modelování Dynamiky Onemocnění Přenášených vektory
Existuje mnoho různých typů matematických model pro přenašeči nemoci převodovka; v ideálním případě jsou to snažila být pořád matematicky povolný a tak jednoduché, jak je to možné, při zachování obecné dynamiky biologických systému. Nepřekvapivě modely z literatury značně sahají; z deterministického na stochastický, endemické (včetně narození a úmrtí) či epidemie (epidemie omezenou dobu), zahrnující prostorové šíření, prostorové heterogenity, doby latence, věkové struktury, získávání a ztráta imunity, více kmenů a mnoho dalších. I když vezmeme v úvahu pouze jednu konkrétní nemoc, rozdíly v nemoci v různých populacích mohou vést ke změnám nejen v parametrizaci, ale také v tom, jak si člověk může přát použít modelovací přístup.
některé práce Kat se zaměřují na zjednodušení, která jsou často prováděna za účelem snížení složitosti modelů. Tato práce se zabývá účinky použití modelů přenosu „pouze pro hostitele“, jako je předpoklad kvazi-rovnováhy na dynamiku onemocnění a také účinek vynechání období latence na epidemické předpovědi.
–
vyplní Erin
Africká Trypanosomiáza (HAT)
Africká trypanosomiáza (KLOBOUK), hovorově známé jako spavá nemoc, je smrtelné onemocnění, které je endemické ve velké části Subsaharské Afriky. 70 milionů lidí žije v rizikových oblastech o rozloze přes jeden a půl milionu kilometrů čtverečních. Zatímco prevalence KLOBOUK není tak vysoká jako u jiných parazitárních onemocnění, jako je malárie nebo horečka dengue (bylo jich tam jen více než 7000 hlášeny případy KLOBOUK, ale 207 milionů odhadovaných případů malárie v roce 2012), nedostatek chemické profylaxe, extrémně nepříjemné (a často smrtící) léčba a nedostatek významné vědecké bádání má nyní umístěny KLOBOUK na KTERÝ je seznam opomíjených tropických nemocí.
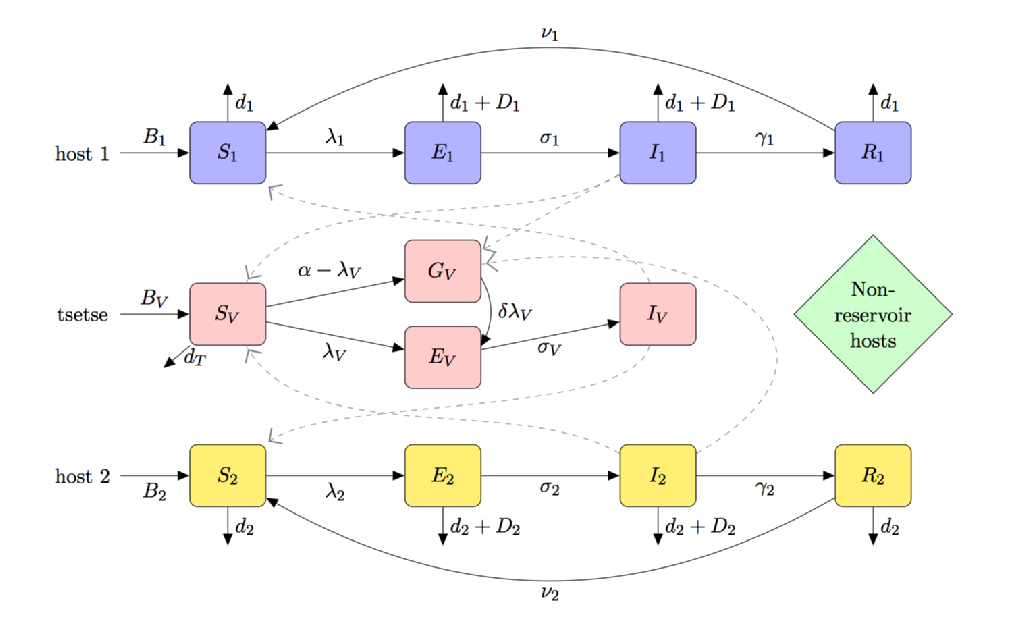
vektor pro klobouk je tsetse; jeho potřeba krmení krví, aby se zabránilo hladovění a jedinečná interakce vektoru a parazita (způsobující „fenomén tenerální citlivosti“) znamená, že modelování klobouku se výrazně liší od jiných nemocí přenášených vektory, jako je malárie.
níže uvedený obrázek je kompartmentovou karikaturou modelu klobouku, který zahrnuje:
- (částečné) teneral fly citlivost
- multi-hostitelské druhy (včetně nádrže a non-rezervoárových hostitelů)
- tse-tse krmení preference
- hladovění nekrmený tse-tse
Katarální horečky ovcí (BTV)
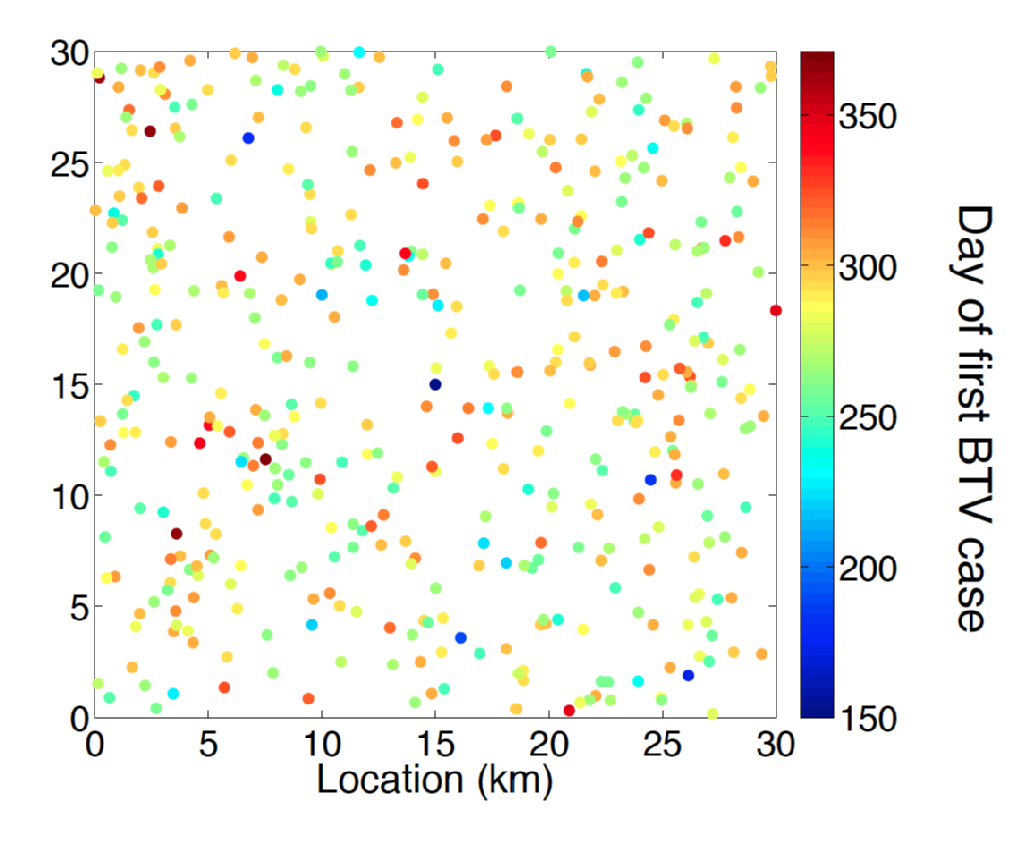
Katarální horečka ovcí je virové onemocnění (BTV) z přežvýkavců přenášené různých rodu Culicoides biting midge druhů. Symptomy u hospodářských zvířat nemocných BTV zahrnovaly nepohodlí, vysokou horečku a cyanózu jazyka, což dává nemoci jeho jméno. Mezi ovcí BTV nemoc má vysokou související úmrtnost. Až do konce 90. let byl Evropský rozsah BTV zcela spojen s rozsahem vektoru midge C.Imicola. Na konci 90. let a na začátku 2000s tam byl dříve nebývalé expanze BTV do oblastí Evropy, které jsou součástí řady dalších midge druhů, jako jsou ty, C. Obsoletus komplex a úzce souvisí midge druhů. Zejména ohnisko pocházející z Nizozemska v roce 2006 je prvním zaznamenaným příkladem vpádu BTV do 50 stupňů severní šířky. V následujících létech byly případy BTV objeveny v celé severní Evropě, včetně Belgie, Německo, Velká Británie a Dánsko prokazující schopnost katarální horečky ovcí přezimovat v Severoevropském prostředí. Záhadný rys Severní evropy sérologie Katarální horečky ovcí je, že nemoc byla způsobena výraznou kmen (BTV-8) od osoby odpovědné za invazi do Jižní Evropy, tedy Španělsko (BTV-4) a Itálie (BTV-2).
predikce dopadu invaze BTV a nejlepší návrh řízení hospodářských zvířat a kontroly nemocí vyžaduje špičkovou metodiku modelování. Hodně je zřejmé, o epidemiologii BTV jako pevné pochopení očekávané období virémie pro skot a ovce hostitele a vliv klimatických teploty na inkubační doba Katarální horečky ovcí v rámci své midge vektorů. Odhad časoprostorového rizika, které představuje rozptýlení vektorů od infikovaných hostitelských hospodářských zvířat, však zůstává významnou výzvou. Problém inference je zde multi-faktoriál vyžadující nejen odvození parametrů, ale také statisticky principiální výběr modelu.
Malárii
Malárie následuje obecný přenosový cyklus jako předchozí popsané; vektor je samice komára, který bere její krev jídlo jako součást reprodukčního procesu; samci tohoto druhu jsou nectavorious a jako takové nehrají žádnou roli v přenosu cyklu. Frekvence krmení je určena touto biologickou potřebou, a proto je průměrná rychlost krmení obvykle přibližně jednou za čtyři dny a obvykle se předpokládá, že v rámci tohoto jídla je dosaženo nasycení pro jednu dávku vajec. Existuje mnoho různých typů malárie, některé postihují člověka (to může být způsobeno jedním ze čtyř různých typů plasmodia) a jiné postihují zvířata. Rodu Anopheles je zodpovědný za přenosu na člověka, z nichž přibližně pouze 30 ze 400 druhů převážně způsobit šíření infekce.
klíčovým prvkem ovlivňující malárie je teplota; i když komár sídlí v dané oblasti, vnější teploty pod cca 16C (přesné mírného pásma je závislá na druhu parazita), to není dost teplé, aby umožnila rozvoj. Obecně platí, že jak se teplota zvyšuje od 16C čím kratší je inkubační doba s náhlé zastavení výše o 32C jako parazit není schopen přežít minulosti této teploty.
ptačí malárie a Havajský Honeycreeper
některé systémy však mohou být mnohem složitější než obecný příklad uvedený dříve. Jedním takovým příkladem je Havajský Honeycreeper (Drepanididae); trpí nejen nepříznivé účinky z Ptačí Malárie (Plasmodium relictum), který je přenášen prostřednictvím komára (Culex quinquefasciatus), ale také ty, které ze změny klimatu, a predace. Souhra mezi těmito dominujícími faktory je skvělá, přičemž teploty a množství predátorů ovlivňují průběh nemoci a schopnost (nebo neschopnost) ptáků odolat vyhynutí. Navíc některé druhy honeycreeper vykazují schopnost rezistenci k malárii, utrpení žádné škodlivé účinky na nemoci, zatímco zbývající infekční (tyto jsou více obyčejně odkazoval se na jako nosiče a nechtěně způsobit rezervoár infekce přežití normální „nemoc-free“ života, ale stále se šířící infekce.
tato práce byla publikována jako:
K. S. Rock et al. „Modelování budoucnosti havajského Honeycreeper: ekologický a epidemiologický problém“. Ekologické modelování (Červen 2012)