obecný název: terbutalin sulfát
dávková forma: injekce, roztok
lékařsky hodnoceno Drugs.com. Naposledy aktualizováno září 1, 2020.
- Přehled
- Nežádoucí Účinky
- Dávkování
- Odborné
- Interakce
- Další
sterilní vodný roztok k podkožní injekci
Rx Pouze
UPOZORNĚNÍ: DLOUHODOBÉ TOKOLÝZY
terbutalin užívané k léčbě sulfát nebyl schválen a neměl by být používán pro dlouhodobé zmírnění kontrakcí dělohy (za 48 až 72 hodin). Zejména terbutalin sulfát by neměl být používán k udržováníkolýza v ambulantním nebo domácím prostředí. Po podání terbutalin sulfátu těhotným ženám byly hlášeny závažné nežádoucí účinky, včetně úmrtí. U matky tyto nežádoucí účinky zahrnují zvýšenou srdeční frekvenci, přechodnou hyperglykémii, hypokalémii, srdeční arytmie, plicní edém a ischemii myokardu. Zvýšená srdeční frekvence plodu a novorozenecká hypoglykémie se mohou objevit v důsledku podání matky (viz kontraindikace: prodloužená Tokolýza).
- popis terbutalinu
- Terbutalin-Klinická farmakologie
- Předklinické
- Farmakokinetika
- indikace a použití pro Terbutalin
- kontraindikace
- varování
- zhoršení astmatu
- Použití Anti-Pobuřující Agenti
- Účinky na Kardiovaskulární systém
- záchvaty
- bezpečnostní Opatření
- Obecné
- lékové Interakce
- Karcinogeneze, Mutageneze, Poškození Fertility
- Těhotenské teratogenní účinky
- Použití V Práce a Dodávky
- kojící matky
- pediatrické použití
- Geriatrické Použití
- nežádoucí účinky
- Předávkování
- dávkování a podání terbutalinu
- jak se Terbutalin dodává
- HLAVNÍ DISPLEJ
- HLAVNÍ DISPLEJ
- SERIALIZATION IMAGE
- Více o tom, terbutalin užívané k léčbě
- Spotřebitelské zdroje
- Odborné zdroje
- Související léčba vodítka
popis terbutalinu
Terbutalin sulfát, USP, účinná látka injekce Terbutalin sulfátu, USP, je beta‑adrenergní agonista bronchodilatátor dostupný jako sterilní, nepyrogenní, vodný roztok v lahvičkách pro subkutánní podání. Každý mililitr roztoku obsahuje 1 mg Terbutalinu Sulfát, USP (0.82 mg volné báze), chlorid sodný pro isotonicity, 0.055% edetan disodný dihydrát jako stabilizační činidlo a kyselina chlorovodíková pro úpravu cílové pH 4. Terbutalin sulfát je (±) – a–3,5-dihydroxybenzyial-sulfát (2:1) (sůl). Molekulární vzorec je (C12H19N03)2•H2SO4 a strukturní vzorec je:
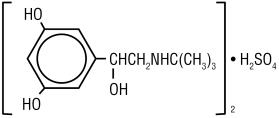
terbutalin užívané k léčbě Sulfát, USP je bílé až šedo-bílý krystalický prášek. Je bez zápachu nebo má slabý zápach kyseliny octové. Je rozpustný ve vodě a v 0,1 N kyselině chlorovodíkové, mírně rozpustný v methanolu a nerozpustný v chloroformu. Jeho molekulová hmotnost je 548,65.
Terbutalin-Klinická farmakologie
injekce terbutalin sulfátu je agonista beta-adrenergních receptorů. Farmakologické studie In vitro a in vivo prokázaly, že Terbutalin vykazuje preferenční účinek na beta2-adrenergní receptory. Zatímco je známo, že beta2-adrenergní receptory predominantní receptory v bronchiální hladké svaloviny, údaje ukazují, že je populace beta2-receptory v lidském srdci, existující v koncentraci od 10% do 50%. Přesná funkce těchto receptorů nebyla stanovena(Viz Upozornění). Kontrolované klinické studie u pacientů, kterým byl podáván Terbutalin subkutánně, neprokázaly preferenční beta2-adrenergní účinek.
farmakologické účinky beta-adrenergních agonistů, včetně Terbutalinu, jsou alespoň v části připadající na stimulaci prostřednictvím beta-adrenergních receptorů intracelulární adenyl cyklázy, enzymu, který katalyzuje konverzi adenosin trifosfátu (ATP) na cyklický 3′,5′-adenosin monofosfát (cAMP). Zvýšené hladiny cAMP jsou spojeny s relaxací hladkého svalstva průdušek a inhibicí uvolňování mediátorů okamžité přecitlivělosti z buněk, zejména ze žírných buněk.
kontrolované klinické studie ukázaly, že injekce terbutalin sulfátu zmírňuje bronchospasmus u akutních a chronických obstrukčních plicních onemocnění významným zvýšením průtoku plic (např. zvýšení FEV1 o 15% nebo více). Po subkutánním podání 0,25 mg Terbutalinu sulfát injekce, měřitelné změny v exspirační průtok se obvykle vyskytuje do 5 minut, a klinicky významné zvýšení FEV1 dochází během 15 minut. Maximální účinek se obvykle vyskytuje během 30 až 60 minut a klinicky významná bronchodilatační aktivita může pokračovat po dobu 1,5 až 4 hodin. Doba trvání klinicky významného zlepšení je srovnatelná s dobou pozorovanou u dávek epinefrinu v equimilligramu.
Předklinické
Studie u laboratorních zvířat (miniprasata, hlodavců a psů) ukázaly, že výskyt srdečních arytmií a náhlé smrti (s histologický průkaz nekrózy myokardu), kdy beta-agonisty a methylxanthiny jsou podávány současně. Klinický význam těchto nálezů není znám.
Farmakokinetika
Subkutánní podání 0,5 mg terbutalin užívané k léčbě sulfát na 17 zdravých, dospělých, mužských subjektů vyústil v průměrný (SD) maximální plazmatické terbutalin užívané k léčbě koncentrace 9,6 (3.6) ng/mL, který byl pozorován na medián (rozsah) 0, 5 (0,08 až 1.0) hodin po podání. Průměrné hodnoty (SD) AUC (0 až 48) a celkové hodnoty tělesné clearance byly 29,4 (14,2) hod•ng/mL a 311 (112) mL/min. Terminální poločas byl stanoven u 9 ze 17 subjektů a měl průměr (SD) 5,7 (2,0) hodin.
po subkutánním podání 0, 25 mg terbutalin sulfátu dvěma mužským subjektům byly maximální sérové koncentrace terbutalinu 5, 2 a 5, 3 ng / mL pozorovány přibližně 20 minut po podání.
Eliminační poločas léčiva v 10 ze 14 pacientů byla přibližně 2,9 hodin po subkutánním podání, ale delší poločasy eliminace (mezi 6 až 14 hodin) byly nalezeny v dalších 4 pacientů. Přibližně 90% léčiva bylo vyloučeno močí 96 hodin po subkutánním podání, přičemž přibližně 60% tohoto léku bylo nezměněno. Zdá se, že Sulfátový konjugát je hlavním metabolitem terbutalinu a vylučování močí je primární cestou eliminace.
indikace a použití pro Terbutalin
injekce Terbutalin sulfátu, USP je indikován k prevenci a zvrácení bronchospasmu u pacientů ve věku 12 let a starších s astmatem a reverzibilním bronchospasmem spojeným s bronchitidou a emfyzémem.
kontraindikace
1. Prodloužená Tokolýza
Terbutalin sulfát nebyl schválen a neměl by být používán k prodloužené tokolýze (po 48-72 hodinách). Terbutalin sulfát by se zejména neměl používat k udržovací tokolýze v ambulantním nebo domácím prostředí (viz varování v krabici: prodloužená Tokolýza).
2. Hypersenzitivita
injekce terbutalin sulfátu je kontraindikována u pacientů, o nichž je známo, že jsou přecitlivělí na sympatomimetické aminy nebo jakoukoli složku tohoto léčivého přípravku.
varování
zhoršení astmatu
astma se může akutně zhoršit v průběhu hodin nebo chronicky během několika dnů nebo déle. Pokud pacient potřebuje více dávek terbutalin sulfátu než obvykle, může to být marker destabilizace astmatu a vyžaduje přehodnocení pacienta a léčebného režimu, se zvláštním zřetelem na možnou potřebu protizánětlivé léčby, např.
Použití Anti-Pobuřující Agenti
použití beta-adrenergních agonistů bronchodilatancia sama o sobě nemusí být dostatečné pro kontrolu astmatu u mnoha pacientů. Je třeba včas zvážit přidání protizánětlivých látek, např. kortikosteroidů.
Účinky na Kardiovaskulární systém
terbutalin užívané k léčbě sulfát, stejně jako všechny ostatní beta-adrenergní agonisté mohou vyvolat klinicky významné kardiovaskulární účinky měřitelné jako zrychlený puls, zvýšený krevní tlak, a/nebo příznaky. Ačkoli jsou tyto účinky po podání terbutalin sulfátu v doporučených dávkách neobvyklé, může být nutné léčbu přerušit. Kromě toho bylo hlášeno, že beta‑agonisté způsobují změny elektrokardiogramu (EKG), jako je zploštění T vlny, prodloužení QTc intervalu a deprese segmentu ST. Klinický význam těchto nálezů není znám. Proto by měl být terbutalin sulfát, stejně jako všechny sympatomimetické aminy, používán s opatrností u pacientů s kardiovaskulárními poruchami, zejména koronární nedostatečností, srdečními arytmiemi a hypertenzí.
záchvaty
u pacientů užívajících Terbutalin byly vzácně hlášeny záchvaty; záchvaty se u těchto pacientů po přerušení léčby neopakovaly.
bezpečnostní Opatření
Obecné
terbutalin užívané k léčbě, stejně jako u všech sympatomimetické aminy, by měl být používán s opatrností u pacientů s chorobami kardiovaskulárního systému, včetně ischemické choroby srdeční, hypertenze a srdeční arytmie; u pacientů s hypertyreóza či diabetes mellitus, a u pacientů, kteří jsou neobyčejně citlivé na sympatomimetické aminy nebo kteří mají konvulzivní poruchy. Významné změny systolického a diastolického krevního tlaku byly vidět a lze očekávat, že může u některých pacientů vyskytnout po použití nějaké beta-adrenergní bronchodilatancia.
po podání terbutalinu byly hlášeny okamžité hypersenzitivní reakce a exacerbace bronchospasmu.
Beta-adrenergní agonista léky mohou vyvolat významnou hypokalemii u některých pacientů, případně prostřednictvím intracelulární posun, který má potenciál vyvolat nežádoucí kardiovaskulární účinky. Pokles je obvykle přechodný a nevyžaduje doplnění.
bylo hlášeno, že vysoké dávky intravenózního terbutalinu zhoršují preexistující diabetes mellitus a ketoacidózu.
lékové Interakce
současné použití Terbutalinu sulfát injekce u jiných sympatomimetik není doporučováno, protože kombinovaný účinek na kardiovaskulární systém mohou být škodlivé pro pacienta.
Inhibitory Monoaminooxidázy nebo Tricyklická Antidepresiva:terbutalin užívané k léčbě by měl být podáván s krajní opatrností u pacientů léčených inhibitory monoaminooxidázy nebo tricyklickými antidepresivy, nebo do 2 týdnů po ukončení léčby, jako zmocněnci, protože účinek Terbutalinu na cévní systém může být znásoben.
Beta-blokátory: Beta-adrenergních receptorů blokátory nejen blokovat plicní účinek beta-agonistů, jako Terbutalinu sulfát injekce, ale může vyvolat závažné bronchospasmus u astmatických pacientů. Proto by pacienti s astmatem neměli být normálně léčeni beta-blokátory. Nicméně, za určitých okolností, např. jako profylaxe po infarktu myokardu, může existovat žádné přijatelné alternativy k použití beta-adrenergních blokátorů u pacientů s astmatem. V tomto nastavení lze zvážit kardioselektivní beta-blokátory, i když by měly být podávány s opatrností.
Diuretika: změny na EKG a/nebo hypokalémii, které mohou vyplynout z podání nonpotassium-šetřící diuretika (například smyčky nebo thiazidová diuretika), může být akutně zhoršil beta-agonisty, a to zejména, když doporučené dávky beta-agonisty je překročena. Ačkoli klinický význam těchto účinků není znám, doporučuje se opatrnost při současném podávání beta-agonistů s diuretiky šetřícími draslík.
Karcinogeneze, Mutageneze, Poškození Fertility
V 2-leté studii u Sprague-Dawley potkanů, terbutalin užívané k léčbě sulfát způsobilo významnou a na dávce závislé zvýšení výskytu benigních leiomyomas z mesovarium na potravinových dávkách 50 mg/kg a vyšší (přibližně 810 krát maximální doporučenou denní subkutánní (sc) dávka pro dospělé na základě mg/m2). Ve 21měsíční studii na myších CD-1 neprokázal terbutalin sulfát žádné známky tumorigenicity při dietních dávkách až do 200 mg / kg(přibližně 1600 násobek maximální doporučené denní dávky sc pro dospělé v mg/m2). Potenciál mutagenity terbutalin sulfátu nebyl stanoven.
Reprodukční studie u potkanů použití Terbutalinu sulfát prokázáno žádné poškození plodnosti při perorálních dávkách až do 50 mg/kg (přibližně 810 krát maximální doporučenou denní sc dávka pro dospělé na základě mg/m2).
Těhotenské teratogenní účinky
Kategorie těhotenství C
neexistují adekvátní a dobře kontrolované studie terbutalin sulfátu u těhotných žen. Publikované studie na zvířatech ukazují, že krysy potomci vykazují změny v chování a vývoj mozku, včetně snížené buněčné proliferace a diferenciace, kdy přehrady byly subkutánně léčených s terbutalin užívané k léčbě během pozdní fázi těhotenství a období kojení. Expozice terbutalinu u potkaních samic byla přibližně 24 až 48krát vyšší než běžná dávka u dospělých 2 až 4 mg / den v dávce mg / m2.
Terbutalin sulfát nebyl schválen a neměl by být používán k prodloužené tokolýze (po 48-72 hodinách). Zejména terbutalin sulfát by neměl být používán k udržováníkolýza v ambulantním nebo domácím prostředí. Po podání terbutalin sulfátu těhotným ženám byly hlášeny závažné nežádoucí účinky, včetně úmrtí. U matky tyto nežádoucí účinky zahrnují zvýšenou srdeční frekvenci, přechodnou hyperglykémii, hypokalémii, srdeční arytmie, plicní edém a ischemii myokardu. Zvýšená srdeční frekvence plodu a neonatální hypoglykémie se může objevit jako důsledek mateřské správy (viz tabulka VAROVÁNÍ: Dlouhodobé Tokolýzy a KONTRAINDIKACE: Dlouhodobé Tokolýzy).
V živočišných embryofetální vývojové studii, nebyly pozorovány žádné teratogenní účinky u potomstva při březích potkanů a králíků získal terbutalin užívané k léčbě sulfát při perorálních dávkách až do 50 mg/kg/den, přibližně 810 a 1600 krát, respektive, maximální doporučená denní subkutánní dávka pro dospělé, na základě mg/m2.
terbutalin sulfát by měl být používán během těhotenství pouze tehdy, pokud potenciální přínosy ospravedlňují potenciální riziko pro plod.
Použití V Práce a Dodávky
Protože potenciál pro beta-agonisty rušení s děložní kontraktilitu, použití Terbutalinu sulfát injekce pro zmírnění bronchospasmu během porodu by měla být omezena na ty pacienty, u kterých přínosy jasně převyšují rizika.
Terbutalin prochází placentou. Po jednorázovém intravenózním podání Terbutalinu do 22 ženy v pozdní fázi těhotenství, které byly dány tím, že elektivní Císařský řez z důvodu klinických důvodů, pupečníková krev úrovní terbutalin užívané k léčbě bylo zjištěno, že v rozmezí od 11% na 48% mateřských hladin.
kojící matky
není známo, zda se tento lék vylučuje do mateřského mléka. Injekce terbutalin sulfátu by proto měla být použita během kojení pouze tehdy, pokud potenciální přínos odůvodňuje možné riziko pro novorozence.
pediatrické použití
injekce terbutalin sulfátu se nedoporučuje u pacientů mladších 12 let z důvodu nedostatečných klinických údajů pro stanovení bezpečnosti a účinnosti.
Geriatrické Použití
Klinické studie terbutalin užívané k léčbě sulfát injekce nezahrnovaly dostatečný počet subjektů ve věku 65 a více let ke stanovení, zda reagují odlišně než mladší subjekty. Jiné hlášené klinické zkušenosti nezjistily rozdíly v odpovědích mezi staršími a mladšími pacienty. Obecně platí, že výběr dávky u starších pacientů by měl být opatrný, obvykle začíná na spodním konci dávkovacího rozmezí, vzhledem k vyšší frekvenci snížené funkce jater, ledvin nebo srdeční funkce, a průvodních onemocnění nebo další farmakoterapie.
nežádoucí účinky
nežádoucí účinky pozorované při injekci terbutalin sulfátu jsou podobné těm, které se běžně vyskytují u jiných sympatomimetik. Všechny tyto reakce jsou přechodné povahy a obvykle nevyžadují léčbu.
následující tabulka porovnává nežádoucí účinky pozorované u pacientů léčených s terbutalin užívané k léčbě sulfát podání (0,25 mg a 0,5 mg), s těm, které byly pozorovány u pacientů léčených přípravkem injekce epinefrinu (0,25 mg a 0,5 mg), během osmi dvojitě slepé zkřížené studii zahrnující celkem 214 pacientů.
| Incidence (%) of Adverse Reactions | |||||
| Terbutaline (%) | Epinephrine (%) | ||||
|
0.25 mg |
0.5 mg N = 205 |
0.25 mg N = 153 |
0.5 mg N = 61 |
||
| Reaction Central Nervous System |
|||||
| Tremor | 7.8 | 38.0 | 16.3 | 18.0 | |
| Nervousness | 16.9 | 30.7 | 8.5 | 31.1 | |
| Dizziness | 1.3 | 10.2 | 7.8 | 3.3 | |
| Headache | 7.8 | 8.8 | 3.3 | 9.8 | |
| Drowsiness | 11.7 | 9.8 | 14.4 | 8.2 | |
| Cardiovascular | |||||
| Palpitations | 7.8 | 22.9 | 7.8 | 29.5 | |
| Tachycardia | 1.3 | 1.5 | 2.6 | 0.0 | |
| Respiratory | |||||
| Dyspnea | 0.0 | 2.0 | 2.0 | 0.0 | |
| Chest discomfort | 1.3 | 1.5 | 2.6 | 0.0 | |
| Gastrointestinal | |||||
| Nausea/vomiting | 1.3 | 3.9 | 1.3 | 11.5 | |
| Systemic | |||||
| Weakness | 1.3 | 0.5 | 2.6 | 1.6 | |
| Flushed feeling | 0.0 | 2.4 | 1.3 | 0.0 | |
| Sweating | 0.0 | 2.4 | 0.0 | 0.0 | |
| Pain at injection site | 2.6 | 0.5 | 2.6 | 1.6 | |
Poznámka: Někteří pacienti obdrželi více než jednu dávku, sílu terbutalin užívané k léčbě sulfát a adrenalin. Navíc, tam byly zprávy, úzkost, svalové křeče, sucho v ústech (< 0.5%). Při podávání terbutalinu byly vzácně hlášeny zvýšené hladiny jaterních enzymů a hypersenzitivní vaskulitida.
Chcete-li nahlásit podezření na nežádoucí účinky, kontaktujte Hikma Pharmaceuticals USA Inc.. na 1-877-233-2001, nebo na FDA na 1-800-FDA-1088, nebo www.fda.gov/medwatch.
Předávkování
střední sc smrtelná dávka terbutalin užívané k léčbě sulfát ve zralých potkanů byla přibližně 165 mg/kg (přibližně 2700 krát maximální doporučenou denní sc dávka pro dospělé na základě mg/m2). Medián sc smrtelná dávka terbutalin užívané k léčbě skalice u mladých potkanů přibližně 2000 mg/kg (přibližně 32,000 násobek maximální doporučené denní sc dávka pro dospělé na základě mg/m2).
očekávané příznaky předávkování jsou nadměrné beta-adrenergní stimulaci a/nebo výskytu nebo přehánění některý z příznaků uvedených pod NEŽÁDOUCÍCH ÚČINKŮ, např. záchvaty, angina pectoris, hypertenze nebo hypotenze, tachykardie s rychlostí až 200 tepů za minutu, srdeční arytmie, nervozita, bolest hlavy, třes, sucho v ústech, bušení srdce, nevolnost, závratě, únava, malátnost a nespavost. Může se také objevit hypokalémie. Neexistuje žádné specifické antidotum. Léčba spočívá v přerušení injekce terbutalin sulfátu spolu s vhodnou symptomatickou léčbou. Lze zvážit uvážlivé použití kardioselektivního blokátoru beta-receptorů, přičemž je třeba mít na paměti, že takové léky mohou vyvolat bronchospazmus. Neexistují dostatečné důkazy k určení, zda je dialýza prospěšná pro předávkování injekcí terbutalin sulfátu.
dávkování a podání terbutalinu
injekční lahvičky se mají používat pouze k subkutánnímu podání, nikoli k intravenózní infuzi.
sterilitu a přesné dávkování nelze zajistit, pokud injekční lahvičky nejsou používány v souladu s dávkováním a podáním.
nepoužitou dávku zlikvidujte po použití pro jednoho pacienta.
obvyklá subkutánní dávka injekce terbutalin sulfátu je 0,25 mg injikovaná do laterální deltové oblasti. Pokud nedojde k významnému klinickému zlepšení během 15 až 30 minut, může být podána druhá dávka 0, 25 mg. Pokud pacient nereaguje během dalších 15 až 30 minut, je třeba zvážit další terapeutická opatření. Celková dávka do 4 hodin by neměla překročit 0,5 mg.
Poznámka: parenterální léčivé přípravky by měly být před podáním vizuálně zkontrolovány na přítomnost částic a změnu barvy, kdykoli to roztok a obal dovolí.
jak se Terbutalin dodává
injekce Terbutalin sulfátu, USP, 1 mg / mL, se dodává v objemu 1 mL obsaženém v 2 mL lahvičce z jantarového skla. Jedna injekční lahvička obsahuje 1 mg terbutalin sulfátu na 1 mL roztoku; 0,25 mL roztoku poskytne obvyklou klinickou dávku 0,25 mg.
NDC 0143-9375-10 krabička s 10 injekčními lahvičkami.
uchovávejte při teplotě 20° až 25°C (68° až 77 ° F).
Chraňte před světlem uchováváním injekčních lahviček v původní krabičce až do výdeje.
nepoužívejte, pokud je roztok zbarven.
nepoužitou dávku zlikvidujte po použití pro jednoho pacienta.
výrobce:
HIKMA FARMACÊUTICA (PORTUGAL), S. A..
Estrada do Rio da Nejdůležitější -, nº 8, 8A e 8B-Fervença,
2705 – 906 Terrugem SNT,
PORTUGALSKO
Distribuovány pomocí:
Hikma Pharmaceuticals USA Inc.
Eatontown, NJ 07724 USA
Novaplus je registrovaná ochranná známka společnosti Vizient, Inc.
revidováno: Říjen 2020
PIN552-NOV/2
HLAVNÍ DISPLEJ
NDC 0143-9375-01 Rx POUZE
terbutalin užívané k léčbě
SULFÁT
INJEKCE, USP
1 mg/mL
PRO SUBKUTÁNNÍ
POUŽÍT

HLAVNÍ DISPLEJ
NDC 0143-9375-10 Rx POUZE
terbutalin užívané k léčbě
SULFÁT
INJEKCE, USP
1 mg/mL
PRO SUBKUTÁNNÍ
POUŽITÍ
10 X 1 mL jednodávkových injekčních Lahviček
STERILNÍ, NONPYROGENIC, VODNÉ
ROZTOKU PRO SUBKUTÁNNÍ INJEKCI.
nepoužívejte, pokud je roztok změněn.
poznámka: obvyklá jednorázová dávka je jedna čtvrtina obsahu injekční lahvičky. SEE PRESCRIBING
INFORMATION.
SERIALIZATION IMAGE
| Terbutaline SULFATE Terbutaline sulfate injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Hikma Pharmaceuticals USA Inc. (001230762)
o Registraci – HIKMA FARMACEUTICA (PORTUGAL), S. a. (452742943)
Více o tom, terbutalin užívané k léčbě
- Nežádoucí Účinky
- Během Těhotenství nebo Kojení
- Dávkování Informací
- Léku Obrázky
- lékové Interakce
- Porovnat Alternativy
- Ceny & Kupóny
- V angličtině
- 11 Recenze
- třídy Drog: adrenergní bronchodilatancia
- FDA Upozornění (1)
Spotřebitelské zdroje
- Informace pro Pacienta
- Terbutalinu (Pokročilé Čtení)
- terbutalin užívané k léčbě Podkožní (Pokročilé Čtení)
Odborné zdroje
- Předepisování Informace
- Terbutalinu (Profesionální Pacient Poradenství)
- terbutalin užívané k léčbě Tablety (FDA)
Související léčba vodítka
- Předčasný Porod
- Alergického Astmatu
- Astma, Údržba
- Astma, akutní
Medical Disclaimer