protože většina nových hydroxidových iontů je odstraněna, pH se příliš nezvyšuje.
odstranění hydroxidových iontů reakcí s vodíkovými ionty
nezapomeňte, že z ionizace kyseliny ethanové jsou přítomny některé vodíkové ionty.
![]()
![]()
hydroxidových iontů lze kombinovat s těmito vody. Jakmile se to stane, rovnovážné tipy je nahradit. To se děje, dokud se neodstraní většina hydroxidových iontů.
![]()
Znovu, protože budete mít rovnovážných stavů zapojeny, ne všechny z hydroxidu ionty jsou odstraněny – jen většina z nich. Vytvořená voda reionizuje ve velmi malém rozsahu, aby poskytla několik vodíkových iontů a hydroxidových iontů.
alkalické pufrové roztoky
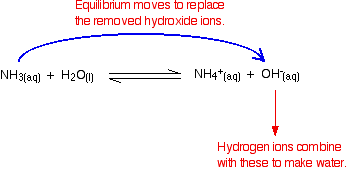
jako typické vezmeme směs roztoků amoniaku a chloridu amonného.
amoniak je slabá báze a poloha této rovnováhy bude dobře vlevo:
![]()
![]()
přidání chloridu amonného k tomu přidává spoustu dalších amonných iontů. Podle Le Chatelierova principu to posune polohu rovnováhy ještě dále doleva.
řešení bude proto obsahovat tyto důležité věci:
-
spousta nezreagovaného amoniaku;
-
spousta amonných iontů z chloridu amonného;
-
dost hydroxidu ionty roztoku alkalické.
jiné věci (jako voda a chloridové ionty), které jsou přítomny, nejsou pro argument důležité.
přidání kyseliny do tohoto pufrovacího roztoku
existují dva procesy, které mohou odstranit vodíkové ionty, které přidáváte.
odstranění reakcí s amoniakem
nejpravděpodobnější základní látkou, se kterou se vodíkový iont srazí, je molekula amoniaku. Budou reagovat za vzniku amonných iontů.
![]()
![]()
většina, ale ne všechny, vodíkových iontů bude odstraněna. Amonný iont je slabě kyselý, a tak se některé vodíkové ionty opět uvolní.
Odstranění vodíkových iontů reakcí s hydroxidem ionty
Pamatujte si, že tam jsou některé hydroxidu ionty přítomné z reakce mezi amoniakem a vody.
![]()
![]()
Vodíkových iontů lze kombinovat s těmito hydroxidu ionty vody. Jakmile k tomu dojde, rovnovážné špičky nahradí hydroxidové ionty. To se děje, dokud se neodstraní většina vodíkových iontů.
![]()
Znovu, protože budete mít rovnovážných stavů zapojeny, ne všechny vodíkové ionty jsou odstraněny – jen většina z nich.
Přidání alkalických tohoto tlumivého roztoku
hydroxidových iontů z alkalických kovů jsou odstraněny pomocí jednoduchého reakce s amonné ionty.
![]()
![]()
Protože amoniak je tvořen slabou základnu, to může reagovat s vodou a tak reakce je mírně reverzibilní. To znamená, že opět většina (ale ne všechny) hydroxidových iontů je z roztoku odstraněna.
výpočty zahrnující vyrovnávací řešení
Toto je pouze stručný úvod. Existuje více příkladů, včetně několika variant, přes 10 stránky v mé knize chemistry calculations.
kyselé pufrové roztoky
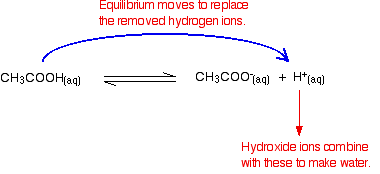
to je lépe vidět na konkrétním příkladu. Nezapomeňte, že kyselý pufr může být vyroben ze slabé kyseliny a jedné z jejích solí.
předpokládejme, že jste měli pufrový roztok obsahující 0,10 mol dm-3 kyseliny ethanové a 0.20 mol dm-3 ethanoátu sodného. Jak vypočítáte jeho pH?
v jakémkoli roztoku obsahujícím slabou kyselinu existuje rovnováha mezi neionizovanou kyselinou a jejími ionty. Takže pro ethanoic kyseliny, máte rovnováhy:
![]()
![]()
přítomnost ethanoate iontů z sodný ethanoate bude mít se stěhoval rovnováhy na levé straně, ale rovnovážné stále existuje.
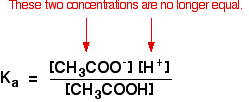
to znamená, že pro ni můžete napsat rovnovážnou konstantu, Ka:
![]()
![]()
Kde jsi udělal výpočty pomocí této rovnice dříve se slabou kyselinou, budete muset předpokládat, že koncentrace vodíkových iontů a ethanoate ionty byly stejné. Každá molekula kyseliny ethanové, která se rozdělí, dává jeden z každého druhu iontu.
to již neplatí pro vyrovnávací roztok:
![]()
Pokud je rovnováha byl tlačil ještě dále vlevo, počet ethanoate ionty přicházející z ethanoic kyseliny bude zcela zanedbatelné ve srovnání s těmi z sodný ethanoate.
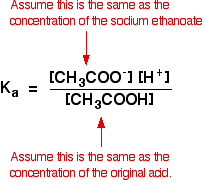
proto předpokládáme, že koncentrace ethanoátových iontů je stejná jako koncentrace ethanoátu sodného – v tomto případě 0,20 mol dm-3.
V slabé kyseliny výpočet, obvykle předpokládáme, že tak málo kyseliny má ionizované, že koncentrace kyseliny v rovnováze je stejná jako koncentrace kyseliny jsme použili. To platí ještě více Nyní, když byla rovnováha posunuta ještě dále doleva.
Tak předpoklady pro tlumivého roztoku jsou:
![]()
Teď, když víme, že hodnoty pro Ka, můžeme vypočítat koncentrace vodíkových iontů, a tedy na pH.
Ka pro ethanoic kyselina je 1.74 x 10-5 mol dm-3.
nezapomeňte, že chceme vypočítat pH pufrového roztoku obsahujícího 0,10 mol dm-3 kyseliny ethanové a 0,20 mol dm-3 ethanoátu sodného.
![]()
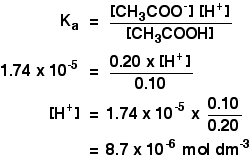
Pak vše, co musíte udělat, je najít pH pomocí výrazu
pH = -log10
Budete mít stále hodnotu koncentrace vodíkových iontů na vašem kalkulačka, takže stiskněte tlačítko protokol a ignorovat negativní znak (aby bylo možné znaménko minus v pH výraz).
měli byste dostat odpověď 5.1 na dvě významná čísla. Nemůžete být přesnější než toto, protože vaše koncentrace byly dány pouze dvěma čísly.