primární struktura bílkovin je definována jako sekvence aminokyselin, z nichž se skládá. Tato sekvence nakonec určuje tvar, který protein přijímá, podle prostorových omezení uspořádání atomů v proteinu, chemických vlastností aminokyselinových zbytků složky a prostředí proteinu.
peptidové vazby, které spojují aminokyselinových zbytků v polypeptidu jsou vytvořeny v kondenzační reakce mezi kyselou karboxylovou skupinou jedné aminokyseliny a základní aminoskupinou další aminokyseliny. V kontextu peptidu se amidová skupina (CO–NH) označuje jako peptidová skupina.
zásadní pro pochopení struktury proteinu je znalost struktury peptidové vazby. Linus Pauling ve třicátých letech použil rentgenovou difrakci ke zkoumání povahy peptidové vazby vytvořené mezi dvěma aminokyselinami. Uvedl, že peptidová skupina (CO-NH) má tuhou rovinnou strukturu. Tato struktura je v důsledku interakce mezi elektrony dvojné vazby karbonylové skupiny a C–N vazby (Obrázek 2) tak, že ten získá parciální (o 40%) double-bond vlastnosti.

tento efekt je příkladem rezonance, kterou lze považovat za sdílení elektronů mezi vazbami. Od jednoduché vazby mezi dvěma atomy jsou delší než dvojné vazby mezi dvěma stejnými atomy, délky C–N a C=O vazby v peptidu skupiny se liší od těch pozorovaných u těchto dluhopisů v jiných kontextech, kde rezonance nenastane. Tedy částečný charakter dvojné vazby C–N v peptidové skupiny znamená, že tato vazba je kratší, než by předpovídal pro C–N jednoduché vazby, zatímco C=O vazby, s částečnou single bond charakter v důsledku rezonance, je delší, než by předpovídal pro C=O dvojné vazby. Délky vazby v peptidové skupině jsou uvedeny na obrázku 3. Porovnejte C-N vazbu peptidové skupiny s vazbou mezi N A Ca (atom C, ke kterému je připojena aminoskupina a karboxylová skupina).

existují dvě možné konformace planární peptidové vazby: v trans peptidové skupiny, Ca atomy jsou na opačných stranách peptidové vazby (Obrázek 3a) a v cis peptidové skupiny, Ca atomy jsou na stejné straně peptidové vazby (Obrázek 3b).
-
vzhledem k prostorovému uspořádání a blízkosti atomů v cis a trans konformacích peptidové vazby, která konformace by podle vás byla upřednostňována?
-
trans konformace by byla energeticky příznivější než konformace cis, protože minimalizuje sterickou překážku.
obecně lze říci, že peptidové vazby jsou v trans konformaci. Formy cis se však mohou vyskytovat v peptidových vazbách, které předcházejí prolinovému zbytku. V takových případech je forma cis stabilnější než obvykle, protože postranní řetězec Proline nabízí méně překážek. Nicméně CIS peptidové vazby se vyskytují pouze v přibližně 10% případů peptidových vazeb předcházejících prolinovým zbytkům.
vzhledem k rovinné povaze peptidové skupiny lze vidět, že polypeptidový řetězec má páteř, která se skládá z řady tuhých planárních peptidových skupin spojených atomy Ca. Obrázek 4 ukazuje část polypeptidu se dvěma rovinnými peptidovými skupinami v trans konformaci. Všimněte si, že ačkoli rotace není povolena ohledně peptidových vazeb, existuje potenciál pro rotaci kolem vazeb Ca–N A Ca–C. Úhly rotace, nazývané torzní úhly, kolem těchto vazeb určují konformaci polypeptidové páteře. Torzní úhly kolem vazeb Ca-N A Ca-C se označují jako ɸ (phi)a ψ. (psi), respektive a jsou definovány jako 180° , když je polypeptid v rozšířené rovinné konformaci, jak je znázorněno na obrázku 4.
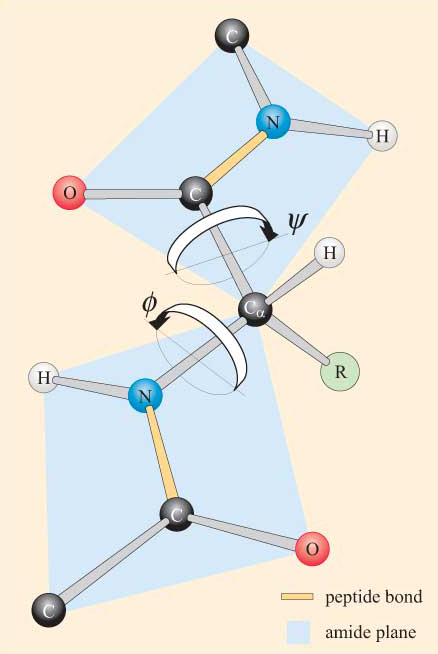
nebudete překvapeni, když zjistíte, že sterická omezení platí pro ɸ a ψ.
v důsledku těchto stérické omezení, jen určité hodnoty ɸ a ψ, a proto konformace peptidu, jsou povoleny, zatímco jiní nejsou.
je možné vypočítat tyto přípustné hodnoty pro daný zbytek v kontextu polypeptidu. Tento výpočet se provádí nejprve určení vzdálenosti mezi všemi non-lepení atomy dvou sousedních peptidových skupin (jako jsou ty na Obrázku 4) na všechny možné hodnoty ɸ a ψ. To je nejsnadněji provedeno pro polypeptid obsahující pouze jeden druh aminokyseliny. Konformační spiknutí ɸ proti ψ pro určitý zbytek je známé jako ramachandranský spiknutí (po jeho vynálezci, g. n. Ramachandran). Takový pozemek nám umožňuje identifikovat ty konformace (tj. pro určitou hodnotu ɸ a ψ), které jsou sterically příznivé nebo nepříznivé (jako na Obrázku 5), podle následujících kritérií:
-
Kde není žádný konflikt mezi van der Waalsovy poloměry non-lepení atomy, konformaci, je ‚dovoleno‘. Tyto konformace leží v modrých oblastech na obrázku 5.
-
konformace vyžadující interatomické vzdálenosti na hranici přípustné jsou definovány jako konformace „vnější mez“. Leží v zelených oblastech na obrázku 5.
-
Teoretické konformací, které vyžadují dva non-lepení atomy být blíže k sobě, než jejich van der Waalsovy poloměry umožňují, jsou sterically ‚zakázáno‘. Ty leží v bílých oblastech na obrázku 5.
Všimněte si, že hodnoty ɸ a ψ na obrázku 5 se pohybují od-180º do + 180º. Otočení peptidové skupiny o 360 ° ji samozřejmě vrátí zpět do výchozí polohy a-180 ° a + 180 ° odpovídají stejné poloze. Zelený pruh v levém dolním rohu grafu na obrázku 5 tedy sousedí s polem v levém horním rohu.

-
Použít Obrázek 5 zjistit, zda tyto hodnoty ɸ a ψ jsou sterically příznivé nebo nepříznivé: (a) ɸ = 90 ° a ψ = 90°; (b) ɸ = −90 ° a ψ = 90°.
-
(a) nepříznivé; b) příznivé.
Ramachandranové grafy mohou být konstruovány pro polymery každé z 20 aminokyselin. Je důležité poznamenat, že Ramachandran pozemky pro mnoho aminokyselinových zbytků jsou obecně velmi podobné, mají pouze tři regiony s příznivým nebo tolerována konformací (označení 1-3 v grafu pro poly-l-alanin v Obrázek 5). Rozdíly se však vyskytují. Například, kde postranní řetězce (R Obrázek 4) je rozvětvené blízkosti Ca, stejně jako v případě threonin, to zabírá více místa v blízkosti peptidové páteře a omezuje přístup atomů v sousedních peptidových skupin. V důsledku toho jsou povolené konformace (úhly ɸ a ψ) omezenější pro polypeptidy rozvětvených aminokyselin.
-
Prolin je také zcela odlišný od ostatních aminokyselin z hlediska povoleno konformací a pro polyproline pouze ɸ hodnoty z −85º k −35º jsou tolerovány. Myšlení o struktuře prolin, jak si vysvětlit tento poměrně úzký rozsah přípustné ɸ hodnoty?
-
boční řetězec prolinu je kovalentně vázán na n aminoskupiny, takže v polyprolinu bude menší svoboda rotace kolem vazby Ca-N než u jiných aminokyselin. V důsledku toho budou povolené hodnoty ɸ relativně omezené ve srovnání s jinými aminokyselinami.
-
Obrázek 6 ukazuje Ramachandran plot pro glycinových zbytků v polypeptidových řetězců. Regiony jsou barevně označeny jako na obrázku 5. Co můžete říci o konformacích, které glycin přijímá? Zvažte strukturu glycinu. Proč se glycin liší od ostatních zbytků, pokud jde o jeho konformace?
-
glycin má mnohem větší konformační svobodu než ostatní aminokyselinové zbytky, protože je méně stericky bráněn.

Ramachandran grafy na Obrázcích 5 a 6 byly vytvořeny pro, respektive, l-alanin a l-glycinu na základě povolených a vnější mezní vzdálenosti pro interatomic kontakty, určená ze známé hodnoty van der Waalsových poloměrů atomů (Tabulka 1).
Tabulka 1 Van der Waalsovy vzdálenosti pro interatomické kontakty.
| typ Kontaktu | Normálně povoleno / Å | Vnější hranice / Å | |
|---|---|---|---|
| H···H | 2.0 | 1.9 |
3.0 |
jsou tedy spíše prediktivní než skutečné konformační grafy. Můžeme samozřejmě použít rentgenovou difrakci k experimentálnímu stanovení „skutečných“ hodnot ɸ a ψ pro rezidua v polypeptidu. Na Obrázku 7, ɸ a ψ hodnoty pro všechny zbytky (s výjimkou glycinu a prolinu) v řadě různých konstrukcí byly stanoveny pomocí high-resolution X-ray difrakce a vyneseny na Ramachandran plot. Vidíme, že existuje nápadná korespondence mezi předpokládanými a skutečnými konformacemi. Všimněte si však, že existují některé zbytky, jejichž konformace mapují „zakázané“ oblasti. Většina těchto reziduí mapuje oblast mezi „povolenými“ regiony 2 a 3, kolem ψ = 0.

-
podívejte se znovu na obrázek 4 a představte si, že můžete otočit nejvyšší peptidovou skupinu o 180°, takže ψ = 0. Jaké skupiny se v této konformaci pravděpodobně střetnou?
-
N–H skupiny sousedních peptidových skupin budou vzájemně konfliktní a budou nuceny do těsné blízkosti.
konflikt související s těmito konformace mohou být ubytováni v malé míře kroucení peptidové vazby. V takových konformacích je tedy peptidová skupina zkroucena ze své obvyklé rovinné konformace.
omezený počet „zakázaných“ konformací určitých reziduí může být v polypeptidu tolerován, pokud je přijatá konformace jako celek energeticky příznivá. Polypeptid bude mít tendenci se skládat tak, že přijme nejstabilnější konformaci. V této konformaci polypeptid minimalizuje svou volnou energii. V dalších částech se podíváme na tuto vyšší úroveň struktury bílkovin.